
Лекция 19. Гетерофункциональные карбоновые кислоты
К гетерофункциональным карбоновым кислотам относятся производные карбоновых кислот, в углеводородном радикале которых один или несколько атомов водорода замещены на другие атомы или атомные группы: галоген, гидроксигруппу, альдегидную группу, кетонную группу, аминогруппу. Гетерофункциональные карбоновые кислоты — это бифункциональные соединения, они обладают свойствами карбоновых кислот и свойствами того класса органических соединений, который определяет заместитель в углеводородном радикале.
Галогенокарбоновые кислоты
Галогенокарбоновыми кислотами называют производные карбоновых кислот, которые в углеводородном радикале содержат один или несколько атомов галогена.
По природе углеводородного радикала различают алифатические, алициклические и ароматические галогенокарбоновые кислоты.
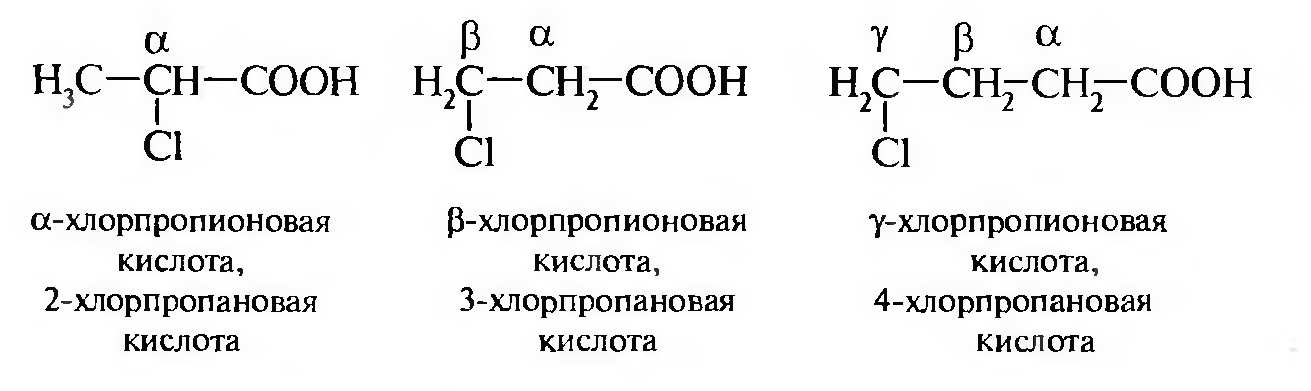
Алифатические галогенокарбоновые кислоты по взаимному расположению атома галогена и карбоксильной группы делятся на: α, β, γ, и т. д.
Например:
 Способы
получения
Способы
получения
1. Действие галогенов на органические кислоты.
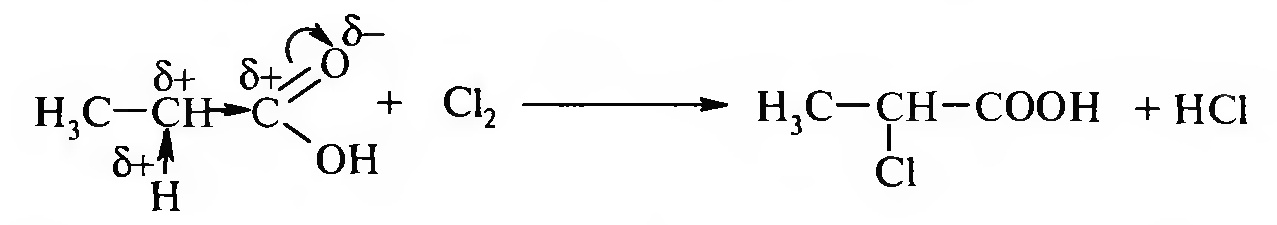 В
этом случае, как правило, получают
α-галогеносодержащие карбоновые
кислоты.
В
этом случае, как правило, получают
α-галогеносодержащие карбоновые
кислоты.
Реакция Геля — Фольгарда — Зелинского. Этот способ имеет большое значение. Он заключается в действии галогена на предельные карбоновые кислоты в присутствии фосфора.
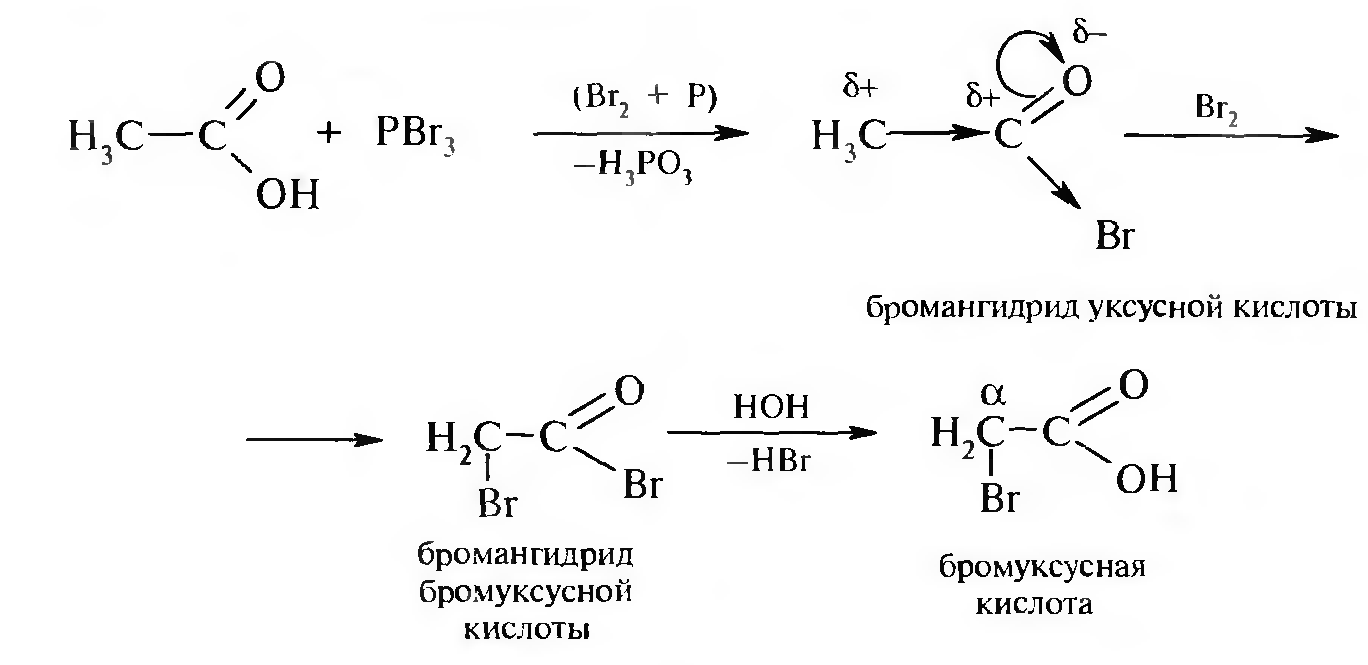
Реакция Геля — Фольгарда — Зелинского осуществляется значительно легче, чем в предыдущем случае. На первой стадии образуется бромангидрид уксусной кислоты. Бром в значительной степени усиливает смещение электронной плотности от α-углеродного атома. Водороды при α-углеродном атоме становятся более подвижны и легко замешаются на галоген. Образовавшийся бромангидрид бромуксусной кислоты при взаимодействии с водой образует бромуксусную кислоту.
3. Действие галогеноводородов на непредельные карбоновые кислоты.
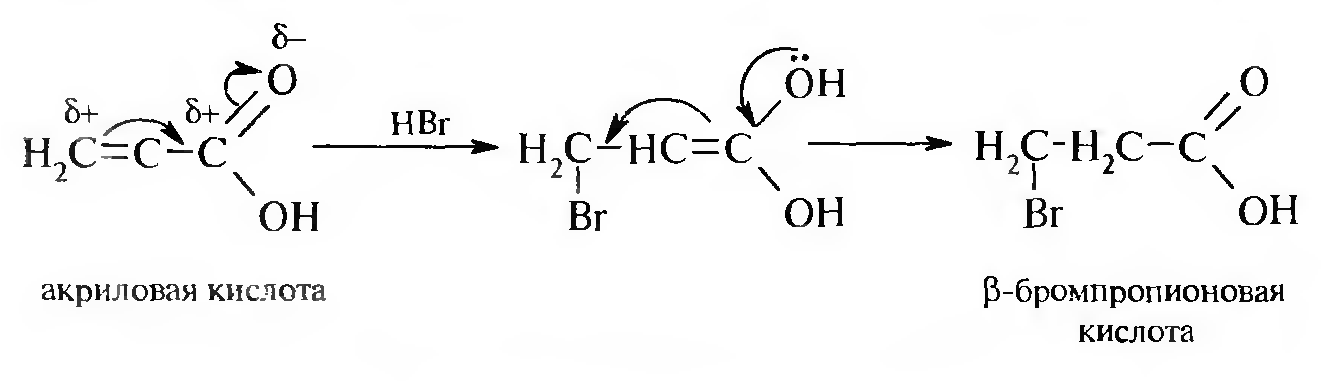
Реакция присоединения протекает против правила Марковникова.
Физические свойства
Галогенокарбоновые кислоты — это бесцветные жидкости или кристаллические вещества, хорошо растворимые в воде; с увеличением молекулярной массы растворимость кислот в воде уменьшается.
Химические свойства
Галогенокарбоновые кислоты более сильные кислоты, чем карбоновые. Введение галогенов в молекулу увеличивает силу кислот.
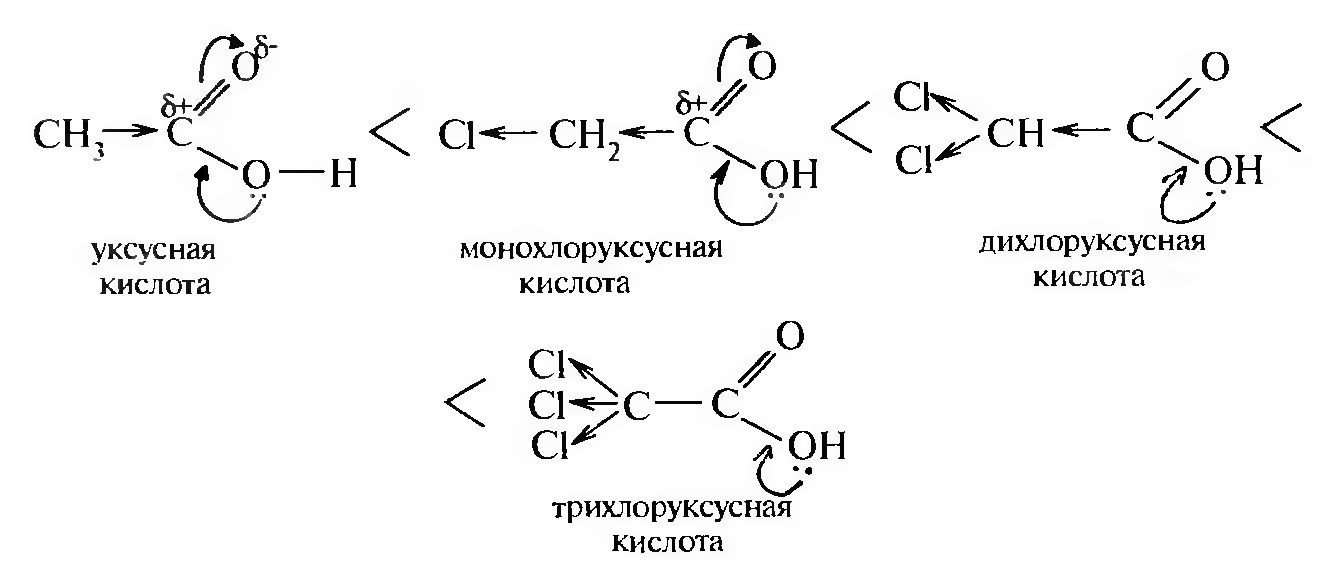
Сила кислот зависит от величины дробного положительного заряда на атоме углерода карбоксильной группы. А величина δ+ увеличивается с введением галогенов, которые обладают отрицательным индуктивным эффектом. Например, трихлоруксусная кислота по силе приравнивается к серной кислоте. Значит, сила кислоты зависит от количества атомов галогена в углеродном радикале. Кроме того, сила кислоты зависит от положения галогена в цепи. Поскольку индуктивное смещение эффективно на протяжении четырех-пяти σ-связей, то α-галогенокарбоновые кислоты более сильные, чем β-, a β— сильнее, чем γ-галогенокарбоновые кислоты.
Для галогенокарбоновых кислот характерны реакции по карбоксильной группе и реакции с участием атома галогена.
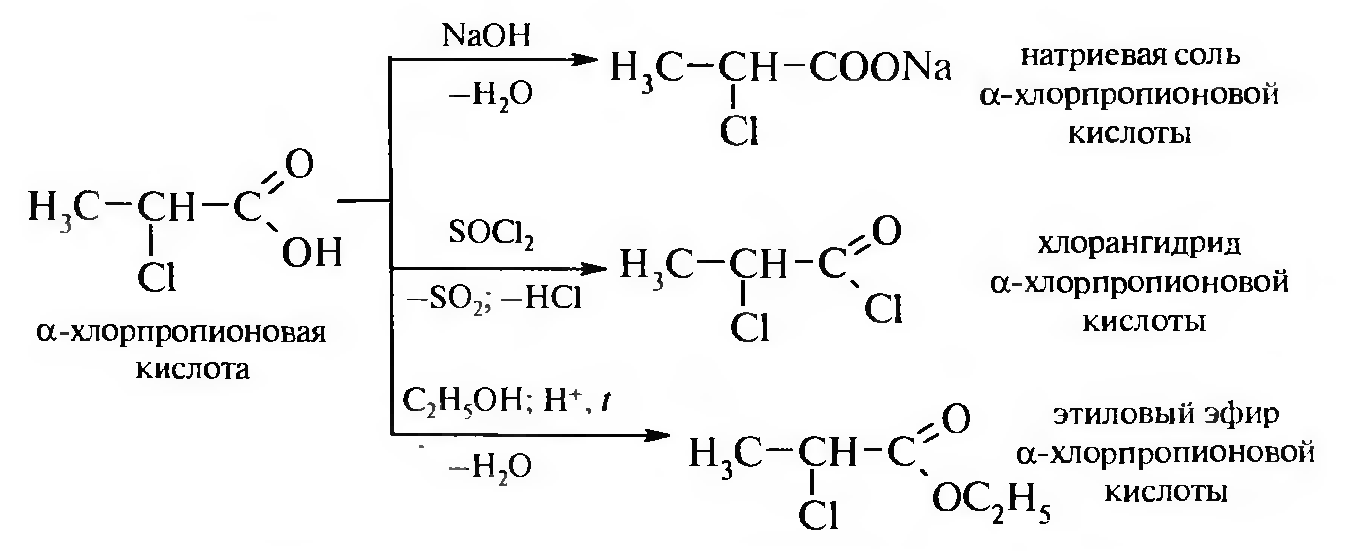
По карбоксильной группе они образуют все функциональные производные карбоновых кислот: соли, сложные эфиры, ангидриды, галогенангидриды, амиды и др.
Например:
Алифатические галогенокарбоновые кислоты, подобно галогенал- канам, вступают в реакции замещения галогена по механизму нуклеофильного замещения (SN). Причем, подвижность галогена зависит от взаимного расположения галогена и карбоксильной группы. Карбоксильная группа, как электроакцепторная группа (-I), увеличивает подвижность атома галогена в молекуле:
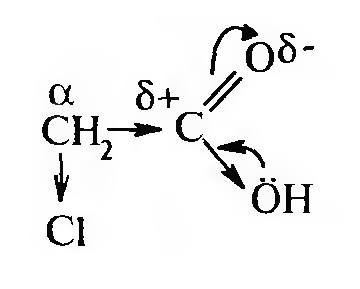
Больше всего галоген будет подвижен при α-углеродном атоме. Подвижность атома галогена можно подтвердить целым рядом реакций:
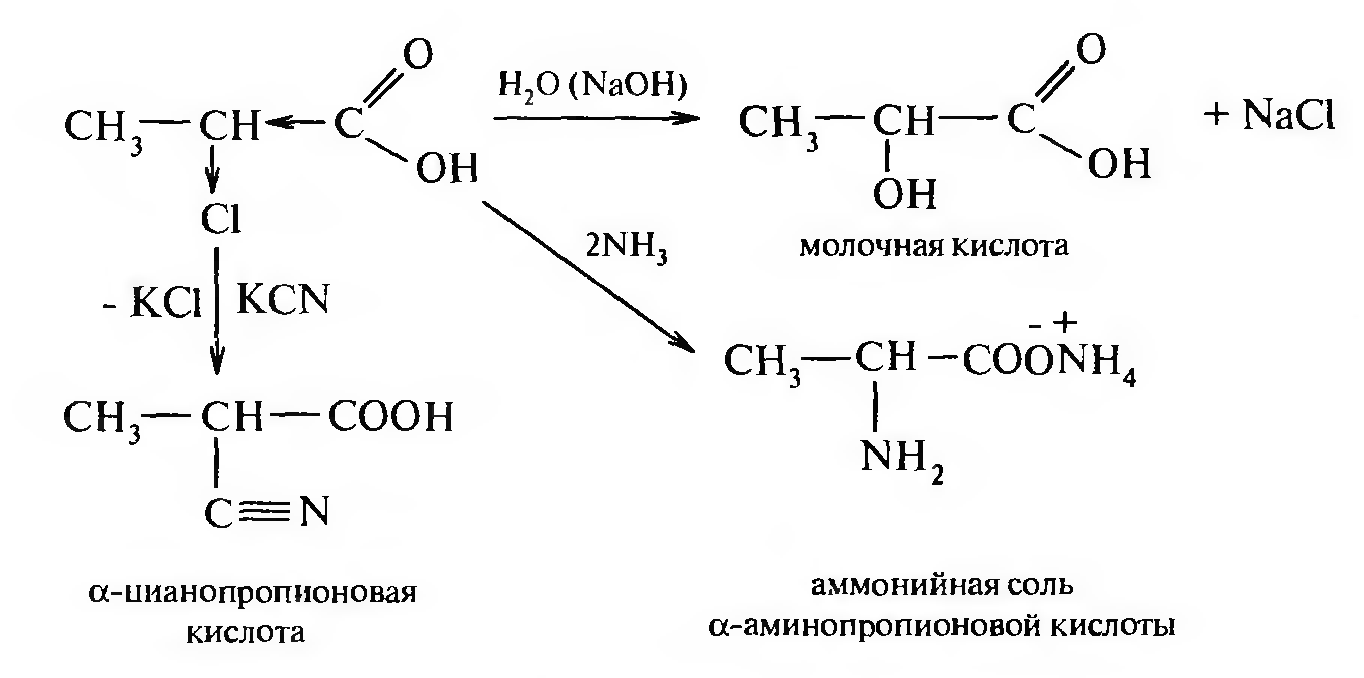
Галоген в β-положении менее подвижен, а в γ-положении влияние карбоксильной группы практически не сказывается.
Галогенокарбоновые кислоты находят широкое применение для получения окси- и аминокислот, широко используются в органическом синтезе лекарственных препаратов, например: уреид α-бромизо- валериановой кислоты — бромизовал — это снотворный препарат.
