
- •18. Спирты 23 Лекция 14. Гидроксильные производные углеводородов. Спирты. Простые эфиры. Тиолы. Тиоэфиры. Фенолы
- •Двух-, трех- и полиатомные спирты
- •Одноатомные фенолы
- •При нагревании галогенопроизводных бензола со щелочами в присутствии катализатора:
- •Сплавление натриевых солей сульфокислот со щелочами:
- •Разложение солей диазония:
- •Сплавление натриевых солей арендисульфокислот со щелочами:
- •Взаимодействие галогенозамещенных фенолов шш дигалогенпро- изводных бензола со щелочами:
- •Восстановление хинонов:
- •Аминофенолы

18. Спирты 23 Лекция 14. Гидроксильные производные углеводородов. Спирты. Простые эфиры. Тиолы. Тиоэфиры. Фенолы
Гидроксильными производными называют производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу.
Гидроксипроизводные углеводородов классифицируют в зависимости от типа гибридизации углеродного атома, связанного с гидроксильной группой:
- спирты (гидроксигруппа расположена при sр3-гибридизованном углеродном атоме);
- фенолы (фенольный гидроксил связан с sр2-гибридизованным углеродным атомом ароматического кольца);
- енолы (гидроксигруппа находится при sр2-гибридизованном углеродном атоме двойной связи);
Следует отметить, что неизвестны гидроксипроизводные углеводородов. содержащие ОН -группу при sр-гибридизованном углеродном атоме.
СПИРТЫ
Гидроксипроизводные углеводородов, содержащие одну или несколько гидроксильных групп при sр3-гибридизованных углеродных атомах, называют спиртами.
В зависимости от числа гидроксильных групп в молекуле различают одно-, двух-, трех- и полиатомные спирты.
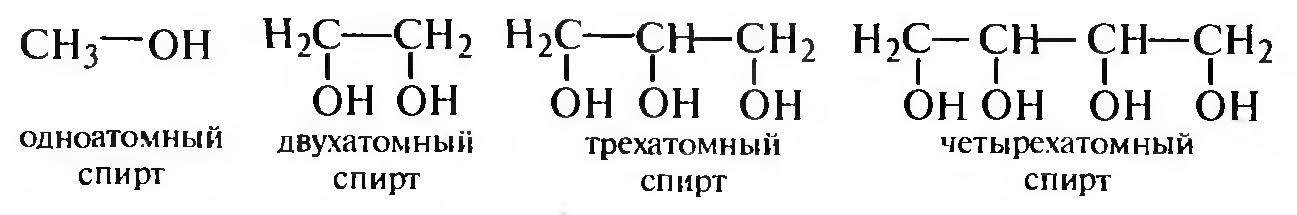
По природе углеводородного радикала спирты делят на алифатические, алициклические и ароматические:
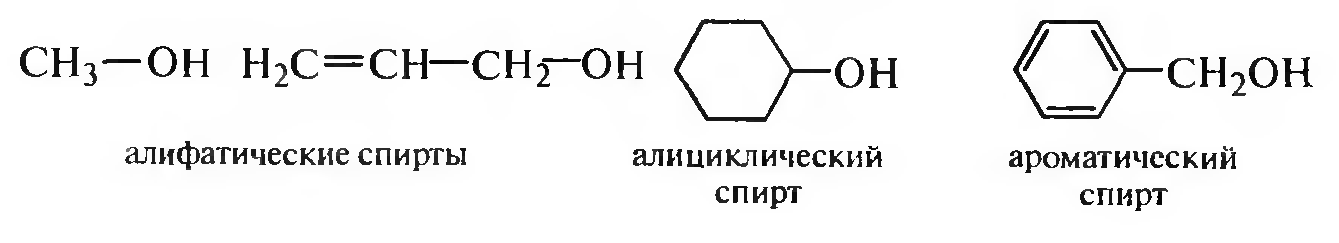
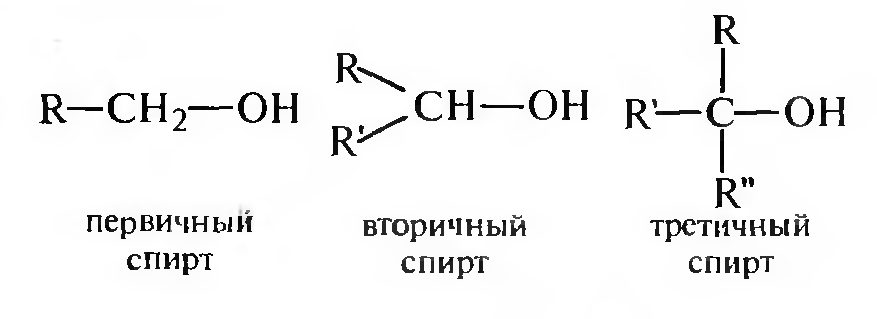
В зависимости от расположения гидроксигруппы в углеводородной цепи молекулы выделяют первичные, вторичные и третичные спирты.
Первичные спирты содержат гидроксигруппу при первичном атоме углерода, вторичные и третичные — соответственно при вторичном и третичном углеродных атомах.
ОДНОАТОМНЫЕ СПИРТЫ
Одноатомными спиртами называют производные углеводородов, содержащие одну гидроксигруппу, связанную с sр3-гибридизованным углеродным атомом.
Одноатомные спирты классифицируют в зависимости от природы углеводородного радикала:
насыщенные (гидроксипроизводные алканов и циклоалканов);
ненасыщенные (гидроксипроизводные ненасыщенных углеводородов, в которых гидроксигруппа не связана с кратной связью);
ароматические (гидроксипроизводные ароматических углеводородов с группой —ОН в боковой цепи)
Номенклатура
По заместительной номенклатуре названия одноатомных спиртов образуют из названия родоначального углеводорода, суффикса -ол и цифрового локанта, указывающего положение гидроксигруппы.
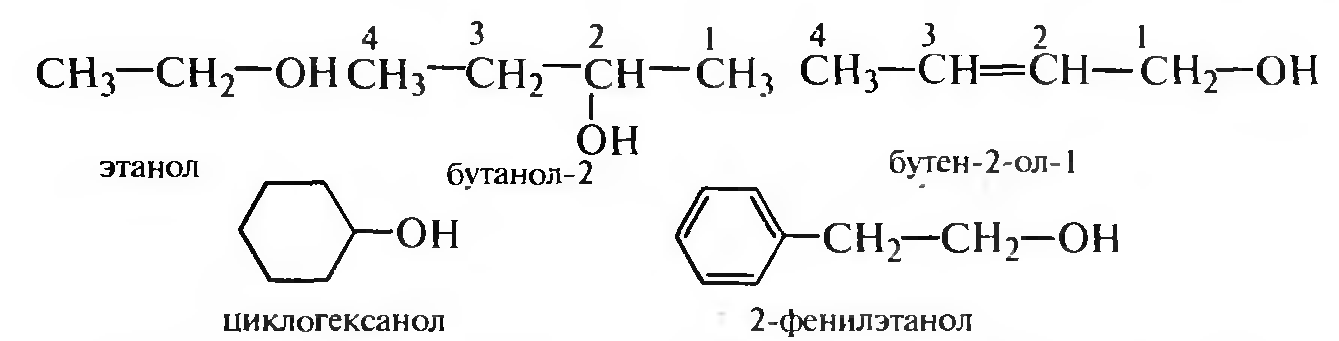
Для названия спиртов широко используют радикально-функциональную номенклатуру, в соответствии с которой к названию углеводородного радикала добавляют слово спирт.
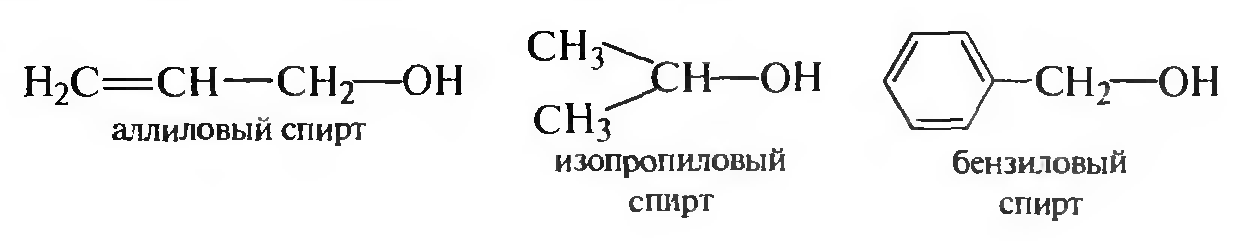
Рациональная (карбинольная) номенклатура спиртов используется в отдельных случаях для упрошения образования названий. Спирты рассматривают как производные метилового спирта СН3ОН, получившего название карбинол. Достаточно распространенными остаются тривиальные названия отдельных спиртов - СН3ОН — древесный спирт, С2Н5ОН — винный спирт и др.
Изомерия
Структурная изомерия спиртов обусловлена различным строением углеводородного скелета и положением гидроксигруппы в углеродной цепи:
изомерия углеродного скелета
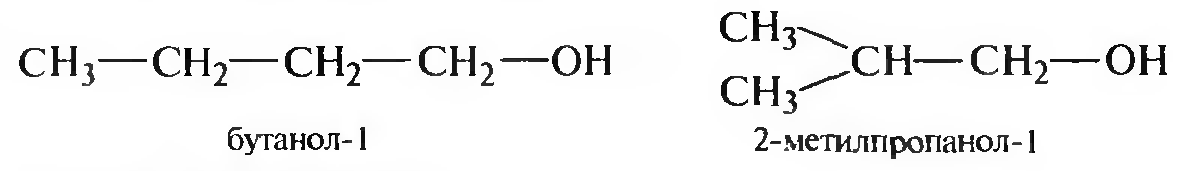
изомерия положения
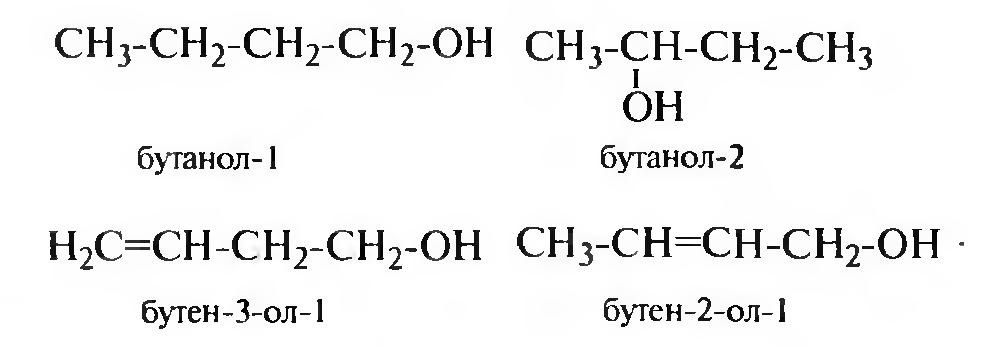
Геометрическая изомерия спиртов обусловлена наличием кратной связи в углеводородном радикале.
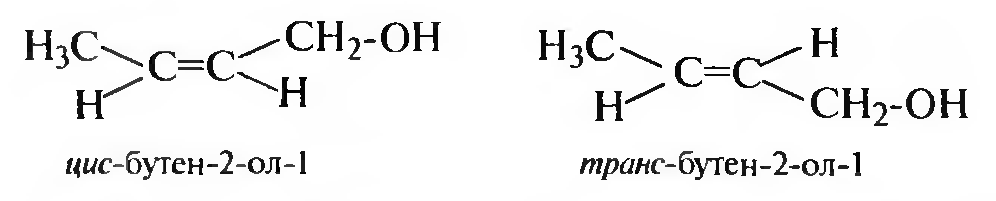
Оптическая изомерия характерна для спиртов, содержащих в своем составе асимметрический атом углерода.
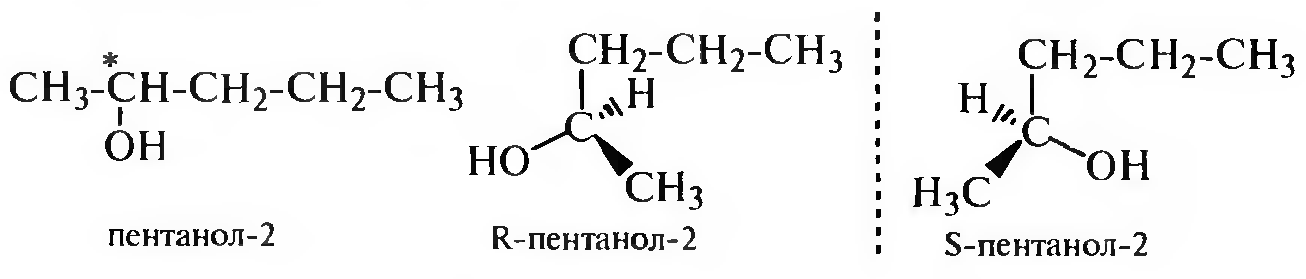
Спирты получают различными синтетическими способами.
Гидратация алкенов. При гидратации этилена получают первичный спирт, его гомологи образуют вторичные и третичные спирты:
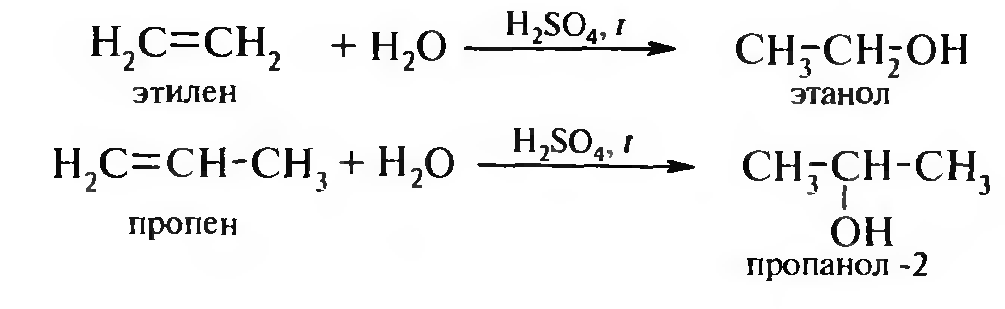
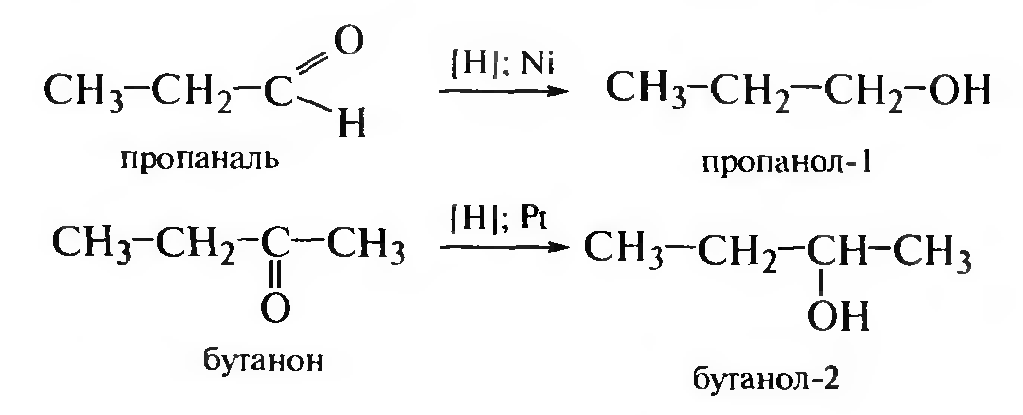
Гидрирование карбонильных соединений. При восстановлении альдегидов, карбоновых кислот и сложных эфиров образуются первичные, а при восстановлении кетонов — вторичные спирты.
Для получения ненасыщенных спиртов из соответствующих альдегидов и кетонов в качестве мягкого селективного восстановителя используют борогидрид натрия NaBH4 (не затрагивает кратные углерод-углеродные связи).
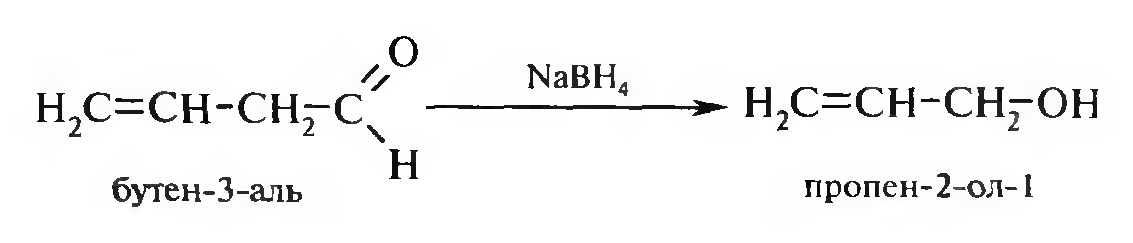
Гидролиз галогенопроизводных углеводородов. В присутствии водных растворов щелочей при нагревании галогенопроизводные углеводородов подвергаются гидролизу с образованием спиртов (SN1 или SN2):
![]()
Взаимодействие карбонильных соединений с магнийорганическими соединениями (реактивами Гриньяра). Магнийорганическое соединение присоединяется к молекуле карбонильного соединения (альдегиды, кетоны, сложные эфиры) по месту разрыва π-связи карбонильной группы. Образовавшийся алкоголят гидролизуется до спирта.
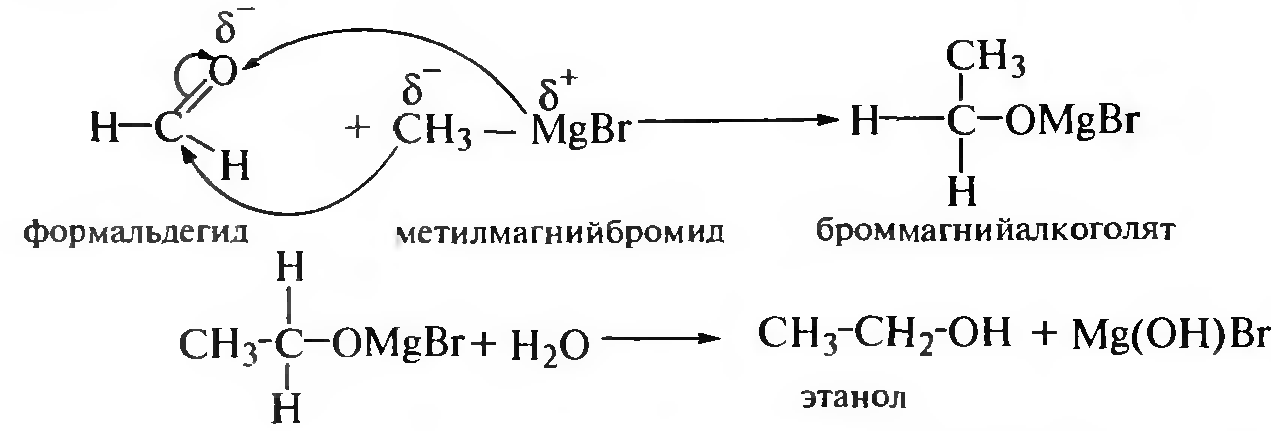
Первичные спирты получают при действии магнийорганических соединений на формальдегид, с другими альдегидами образуются вторичные спирты, с кетонами и сложными эфирами — третичные спирты:

Спиртовое брожение углеводов (глюкозы, фруктозы, крахмала или целлюлозы) позволяет получить этиловый спирт:
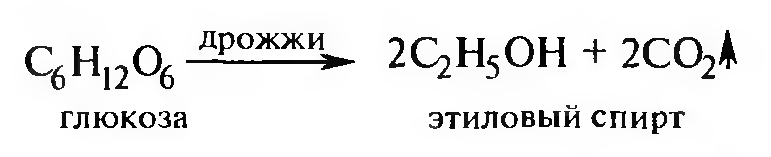
Физические свойства
Спирты — это жидкости или твердые вещества, растворимы во многих органических растворителях. Низшие спирты, в отличие от высших, хорошо растворимы в воде. Спирты состава С1 — С3 обладают характерным алкогольным запахом, С4 — С5 — неприятным «сивушным», высшие алканолы — с приятным фруктовым запахом.
Температура кипения спиртов значительно выше температуры кипения соответствующих углеводородов, их галогенопроизводных. Это объясняется наличием водородных связей, которые обуславливают образование ассоциатов:
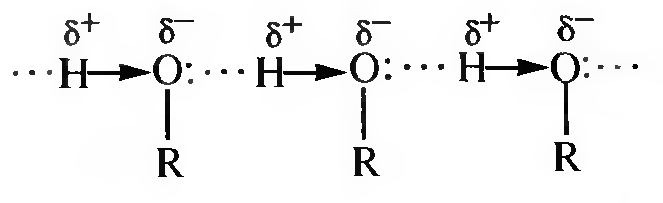
Прочность водородных связей невелика, но для их разрыва при переходе молекулы из жидкого в газообразное состояние требуется дополнительная энергия.
Химические свойства
Химические свойства спиртов обусловлены наличием полярных связей О—Н и С—О, а также не поделенных электронных пар атома кислорода. Для спиртов характерны реакции, протекающие с разрывом связи О—Н (образование алкоголятов, этерификапия. окисление, дегидрирование, взаимодействие с реактивами Гриньяра), с разрывом связи С—О (нуклеофильное замещение ОН-группы. образование простых эфиров, дегидратация) и протонирование.
Кислотно-основные свойства. Спирты являются амфотерными соединениями.
Кислотность спиртов. Полярность связи О—Н в спиртах определяет ее склонность к гетеролитическому разрыву.
Спирты как ОН-кислоты реагируют со щелочными металлами с образованием алкоголятов.
![]()
Алкоголяты легко разлагаются водой до исходных спиртов, что подтверждает более низкую кислотность спиртов по сравнению с водой:
![]()
Из-за низкой кислотности спирты почти не вступают в реакцию со щелочами.
Кислотные свойства спиртов уменьшаются при переходе от первичных спиртов к третичным:
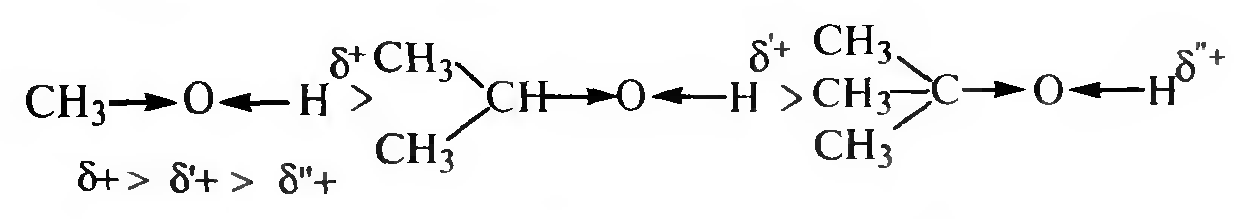
Такая зависимость объясняется проявлением +I-эффекта со стороны углеводородного радикала.
Основные свойства. Обусловлены способностью неподеленныч электронных пар атома кислорода гидроксигруппы спиртов реагировать с протоном с образованием оксониевых солей.
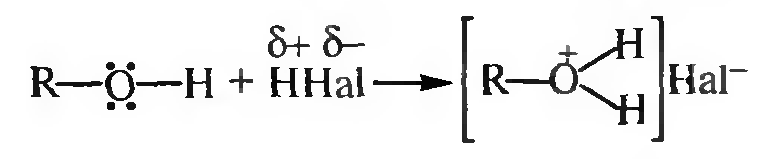
Алкилоксониевые соли во многих реакциях образуются в качестве промежуточных продуктов.
Основные свойства спиртов возрастают при переходе от первичных спиртов к третичным.
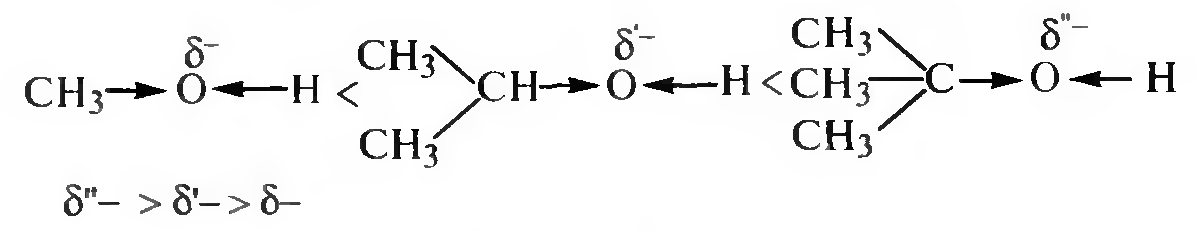
Образование сложных эфиров. Спирты реагируют с органическими и кислородсодержащими минеральными кислотами с образованием сложных эфиров.
Дегидратация спиртов. Для спиртов характерна межмолекулярная и внутримолекулярная дегидратация.
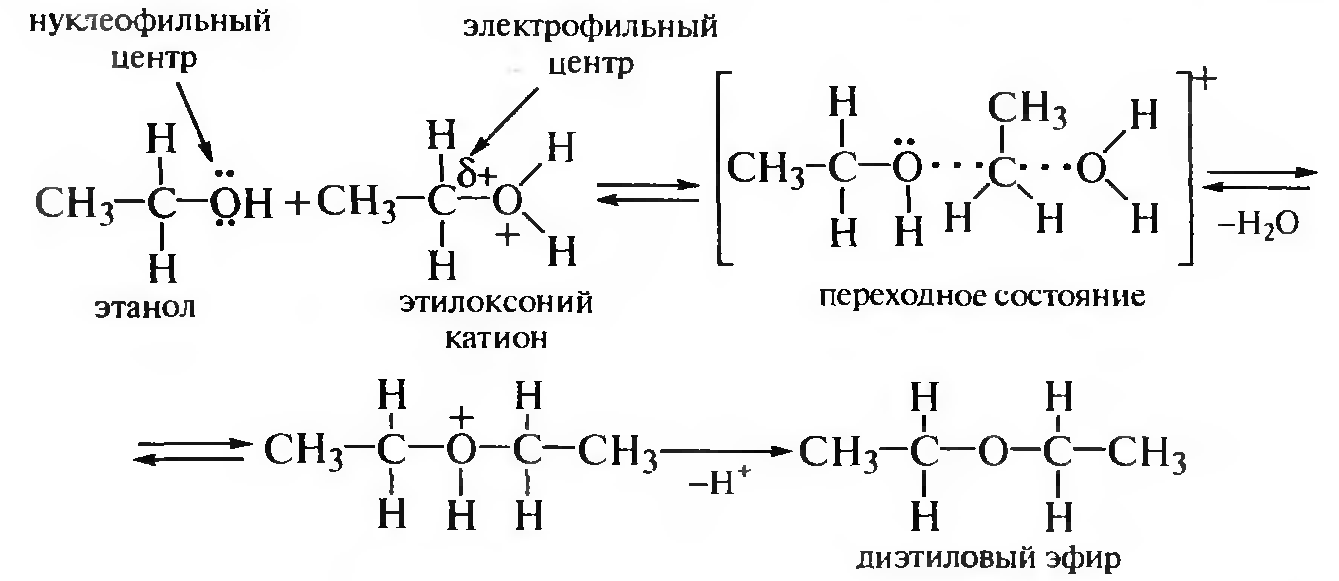
В результате межмолекулярной дегидратации образуются простые эфиры.
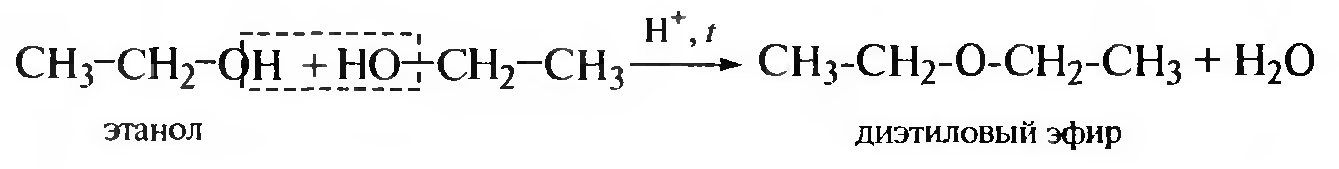
Межмолекулярная дегидратация становится доминирующей при нагревании избытка спирта в присутствии каталитических количеств минеральной кислоты при температуре 140—160°С и протекает по механизму SN1 или SN2
Молекула спирта под действием минеральной кислоты протонируется с образованием оксониевого катиона, а затем происходит замещение группы —ОН:
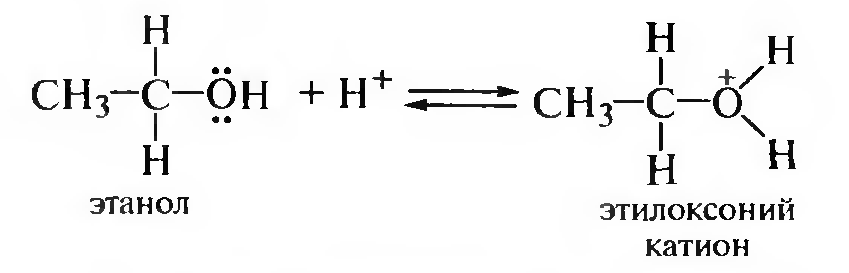
Механизм SN2 включает образование переходного состояния, которое формируется в процессе нуклеофильной атаки электрофильного атома углерода оксониевого катиона второй молекулой спирта:
Механизм SN1 протекает через стадию образования карбкатиона:
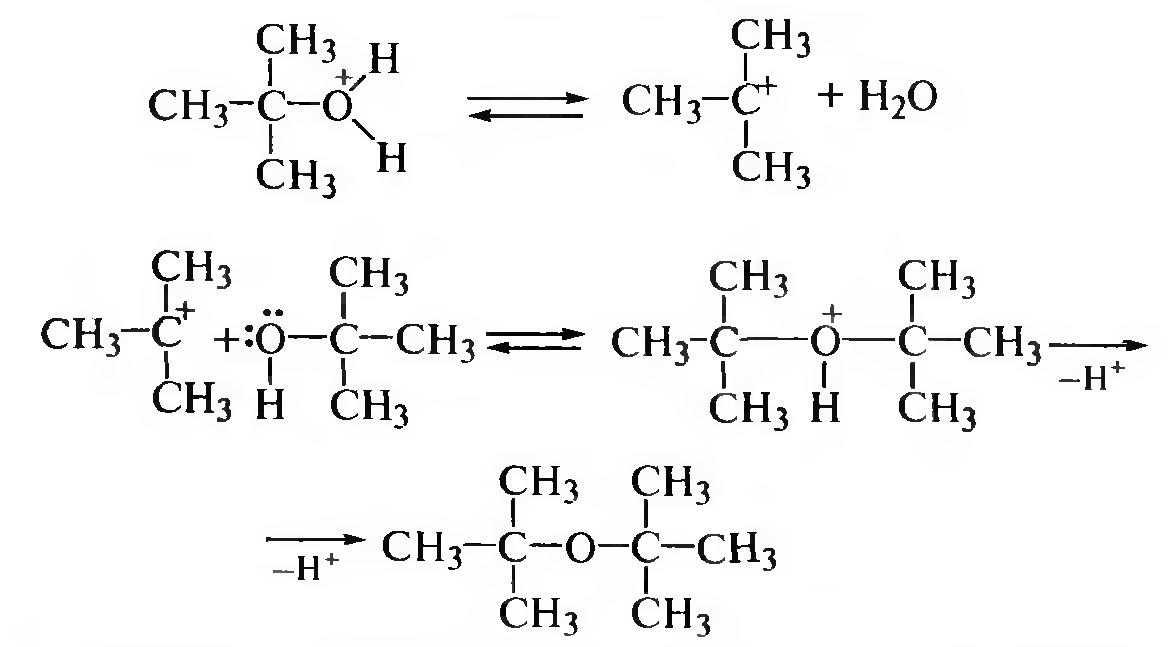
Первичные спирты вступают в реакцию межмолекулярной дегидратации по механизму SN2, третичные — по механизму SN1, а вторичные — как по SN2, так и по SN1.
Продуктами внутримолекулярной дегидратации являются алкены.

Следует помнить, что спирты, в которых с атомом углерода, несущим гидроксильную группу, связаны неравноценные атомы углерода, отщепление молекулы воды происходит по правилу Зайцева, т. е. водород уходит от соседнего, менее гидрогенизированного атома углерода:
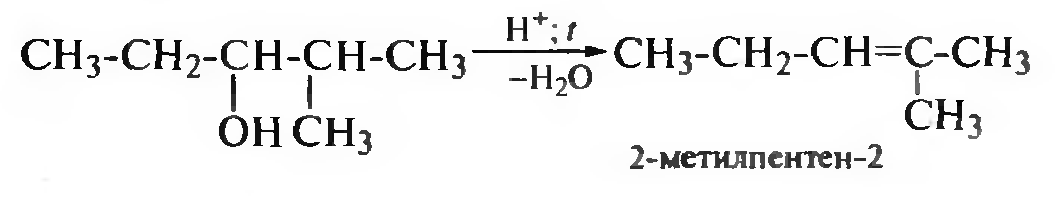
Внутримолекулярная дегидратация становится доминирующей реакцией при нагревании спиртов с избытком минеральной кислоты при температуре выше 170 °С.
Следует отметить, что для спиртов более характерны реакции отщепления. протекающие по механизму Е1. Это связано с кислотностью реакционной среды, в которой сильное основание — алкоксид- анион RO- не существует, так как быстро взаимодействует с протоном.
Дегидратация третичного спирта протекает по механизму Е1.
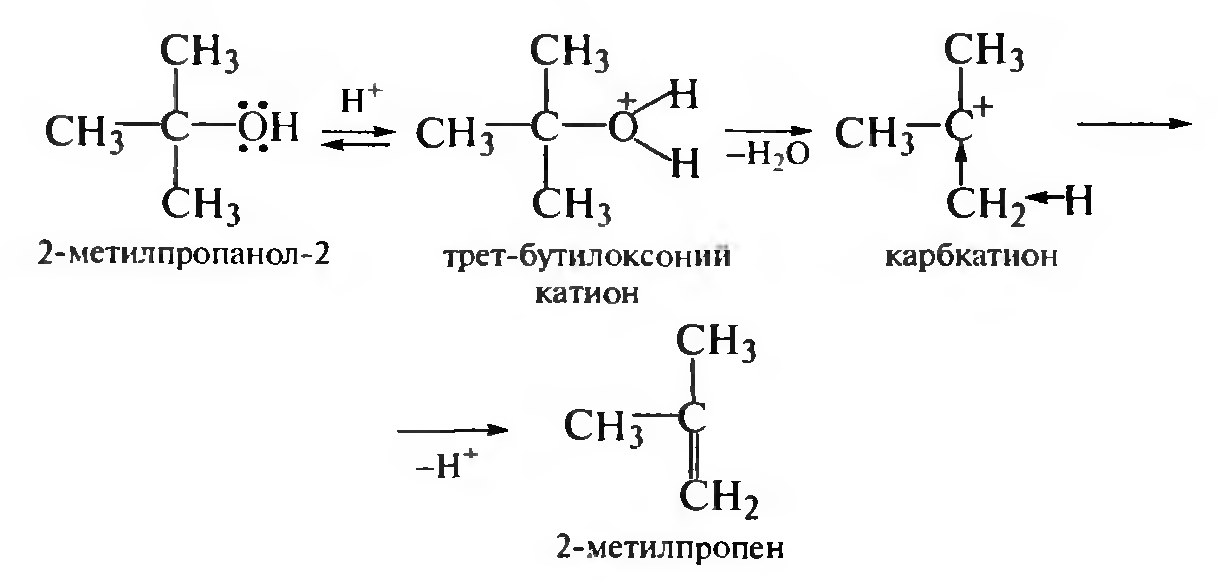
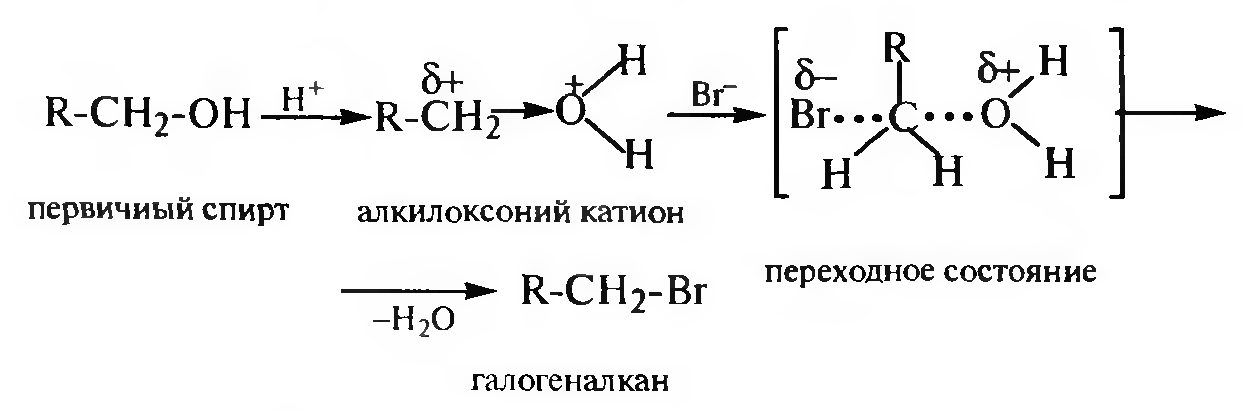
Взаимодействие с галогеноводородными кислотами. При взаимодействии спиртов с галогеноводородными кислотами (HCl, HBr, HI) гидроксильная группа замешается на атом галогена и образуются га- логеноалканы. С первичными спиртами реакция протекает по механизму SN2, с третичными — по SN1. Вторичные спирты реагируют как по механизму SN2, так и по механизму SN1.
Механизм SN2:
Механизм SN1:
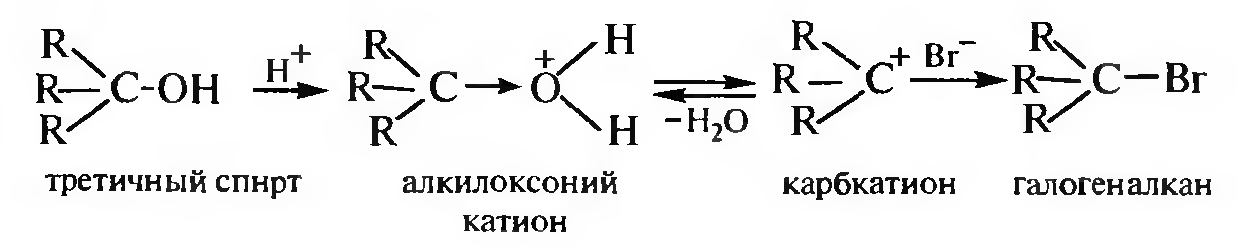
С йодоводородной и бромоводородной кислотами реакция протекает легко, с хлороводородной — значительно труднее. Первичные и вторичные спирты реагируют с хлороводородной кислотой только в присутствии хлорида цинка (кислоты Льюиса).
Первичные, вторичные и третичные спирты при взаимодействии с реактивом Лукаса (эквимолярными количествами концентрированной хлороводородной кислоты и цинка хлорида) с различной скоростью образуют галогенопроизводные углеводородов. Проба Лукаса используется для распознавания первичных, вторичных и третичных спиртов.
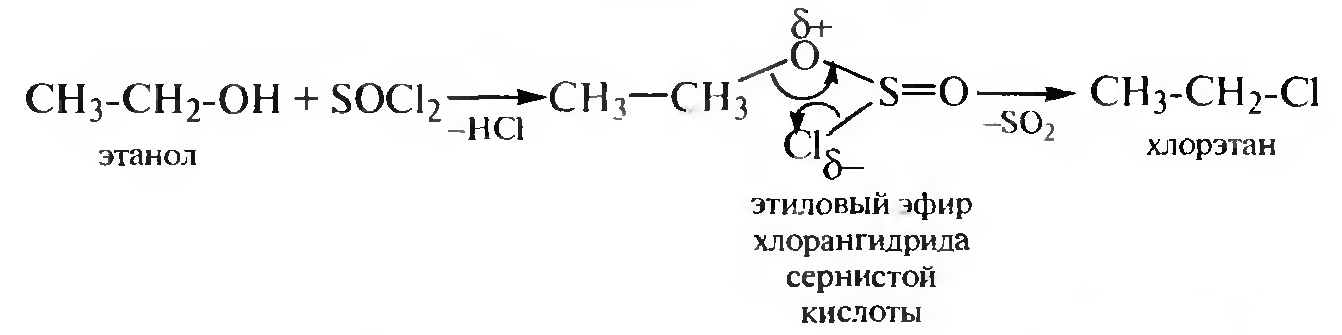
Взаимодействие с галогенангидридами неорганических кислот. Спирты взаимодействуют с галогенидами фосфора (РСl3 PCl5 и др.) и тионилхлоридом (SOCl2) с образованием галогеналканов:
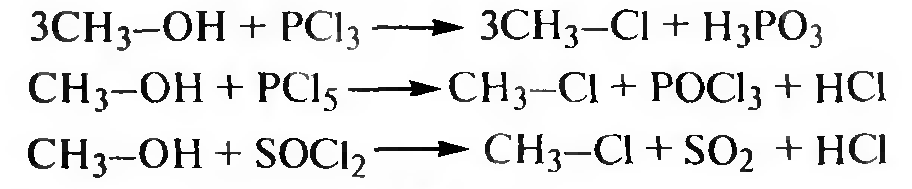
Реакция с тионилхлоридом SOCl2, протекает по механизму внут- римолекулярного нуклеофильного замещения SN1:
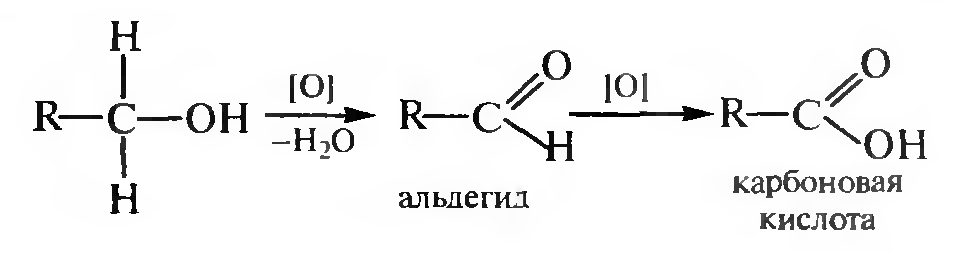
Окисление. Спирты окисляются под действием кислорода воздуха в присутствии катализаторов (Сu, СuО) и различных неорганических окислителей — оксида хрома (VI), хромовой смеси (дихромата калия в серной кислоте), перманганата калия в серной кислоте и др.
Первичные спирты образуют альдегиды (при дальнейшем окислении — карбоновые кислоты с тем же числом углеродных атомов).
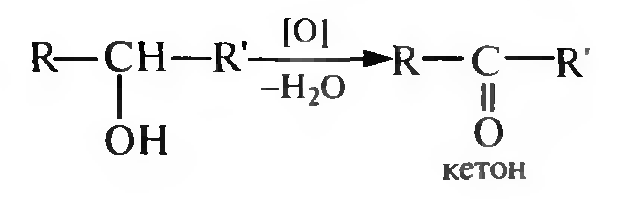
Вторичные спирты окисляются до кетонов
Третичные спирты более устойчивы к окислению. При действии сильных окислителей происходит расщепление углеродного скелета молекулы третичного спирта с образованием смеси карбоновых кислот и кетонов.
В промышленности спирты превращают в альдегиды или кетоны путем каталитического дегидрирования. При пропускании паров спирта нал катализатором (Zn, Сu, Ag) при температуре 300 °С происходит отщепление водорода и образуются альдегиды или кетоны:
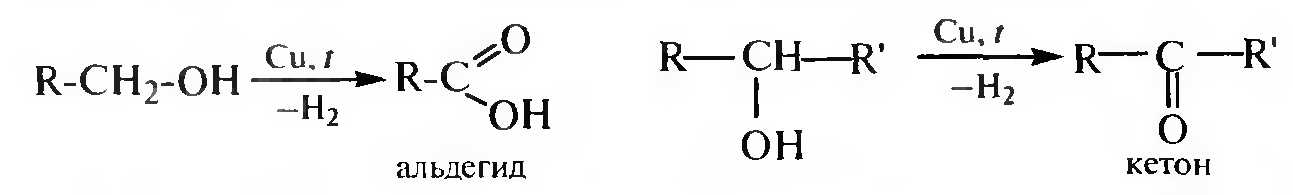
Взаимодействие с магнийорганическими соединениями. Спирты реагируют с реактивами Гриньяра. Атом водорода гидроксигруппы замешается на магнийгалоген и выделяется газообразный углеводород.
![]()
Измерив объем выделившегося газа, определяют количество гидроксильных групп в молекуле спирта (реакция Чугаева — Церевитинова).
