Номенклатура циклоалканов
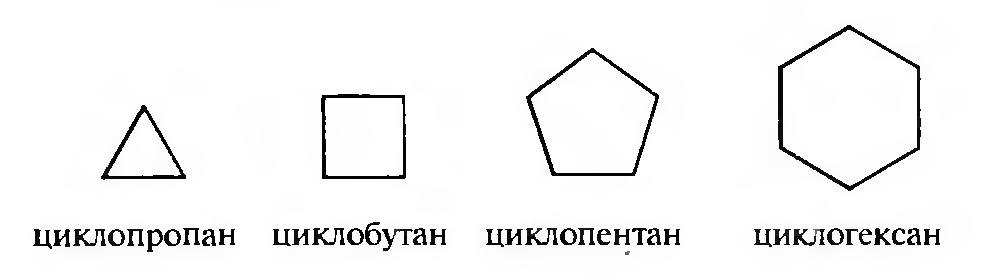
Названия моноциклических циклоалканов образуют в соответствии с правилами ИЮПАК путем добавления к названию алкана с соответствующим количеством атомов углерода префикса цикло-.
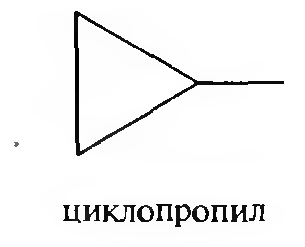
Названия одновалентных радикалов образуют путем замены в названии соответствующего циклоалкана суффикса -ан на –ил.
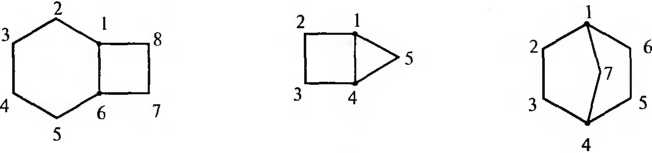
Бициклические циклоалканы называют в зависимости от числа углеродных атомов циклической системы и способа соединения циклов.
2
3
Нумерацию атомов углерода спирановой системы начинают с меньшего икла, с углеродного атома, расположенного рядом с общим.
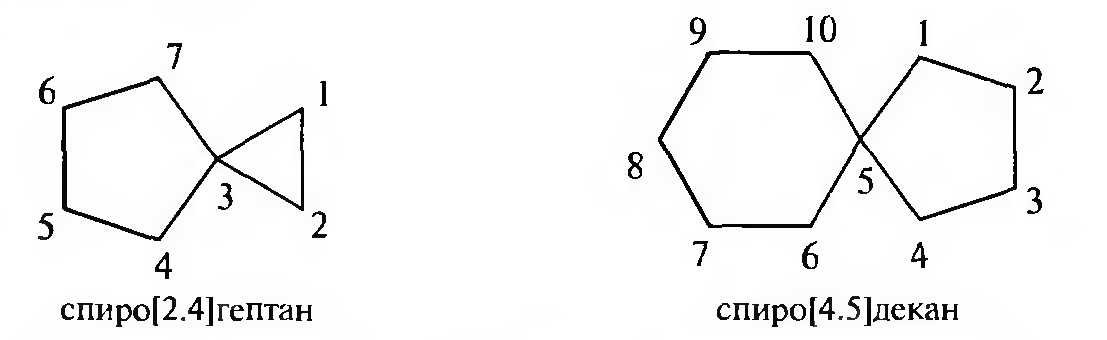
Конденсированные и мостиковые бициклические циклоалканы называют путем прибавления префикса бицикло- к названию алкана с соответствующим числом углеродных атомов. В квадратных скобках между префиксом и названием алкана в порядке убывания указывают число углеродных атомов в каждой из трех цепей, соединенных общими узловыми (третичными) атомами углерода. Нумерацию атомов углерода следует начинать с одного из узловых атомов. В первую очередь нумеруют самую длинную углеродную цепь, затем — более короткую. В мостиковых системах в заключение нумеруют самую короткую углеродную цепь — мостик:
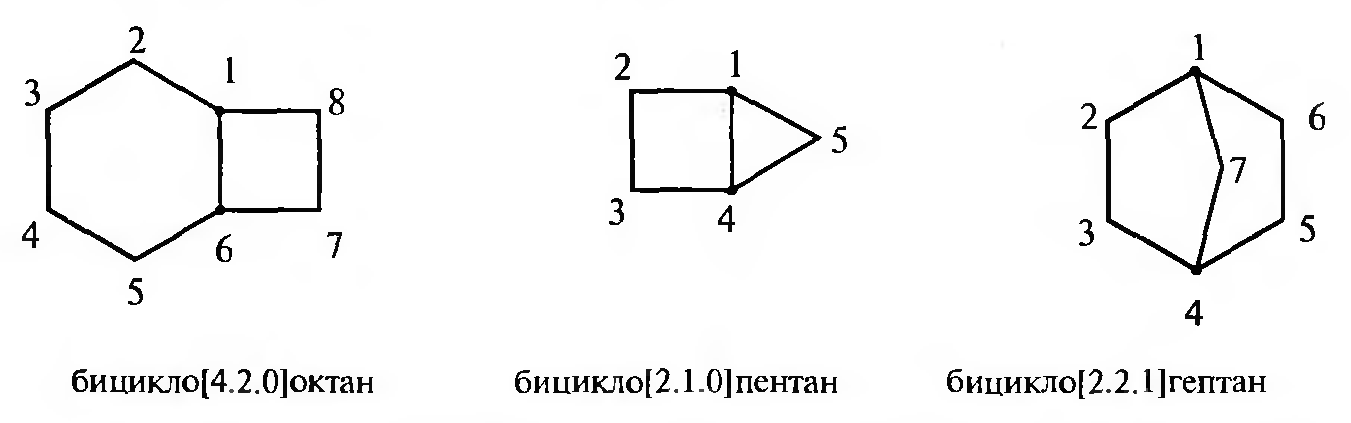
Наряду с систематическими названиями многие бициклические системы имеют тривиальные названия.
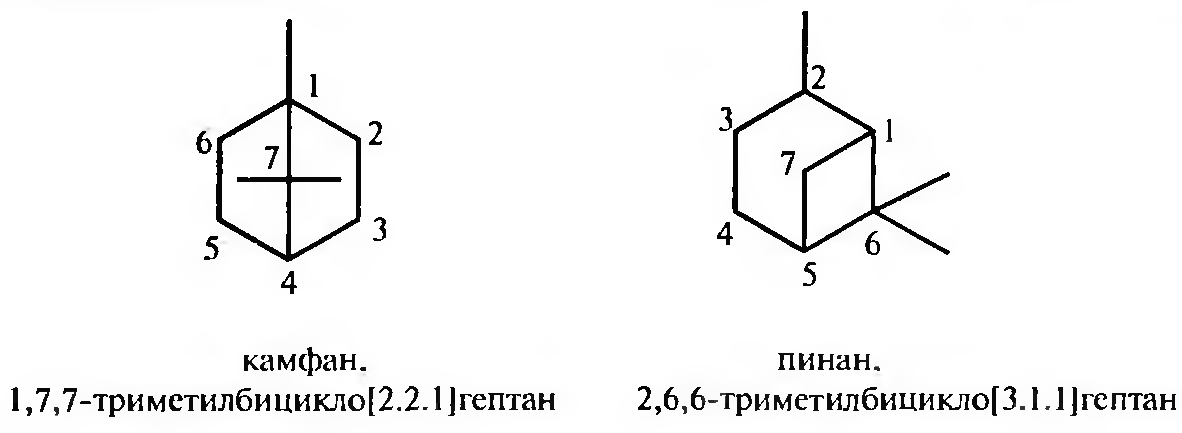
Полициклические соединения содержат более двух циклов, соединенных мостиками. Названия каркасных полициклических углеводородов происходят от эмпирических названий соответствующих геометрических фигур, напоминающих их строение.

Изомерия циклоалканов
Для циклоалканов характерны все виды изомерии.
Структурная изомерия циклоалканов обусловлена величиной цикла, природой и взаимным расположением заместителей:
а) изомерия размера цикла;
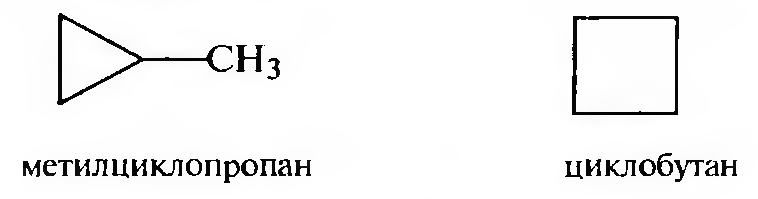
б) изомерия положения заместителей;
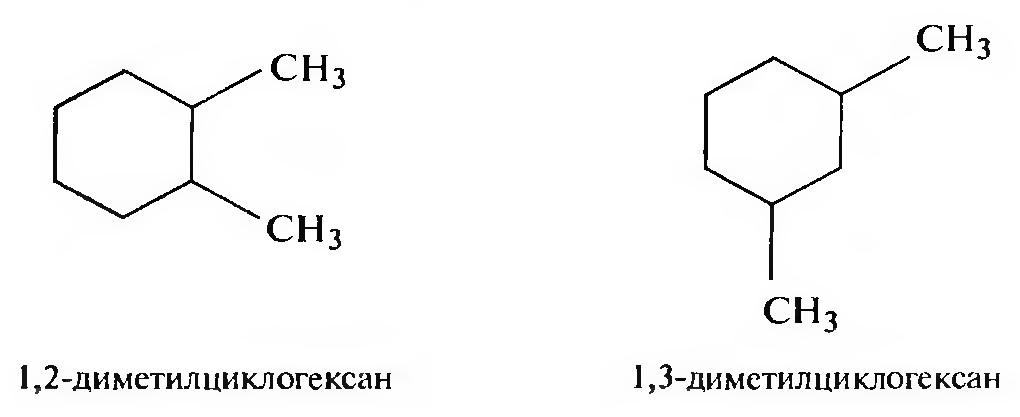
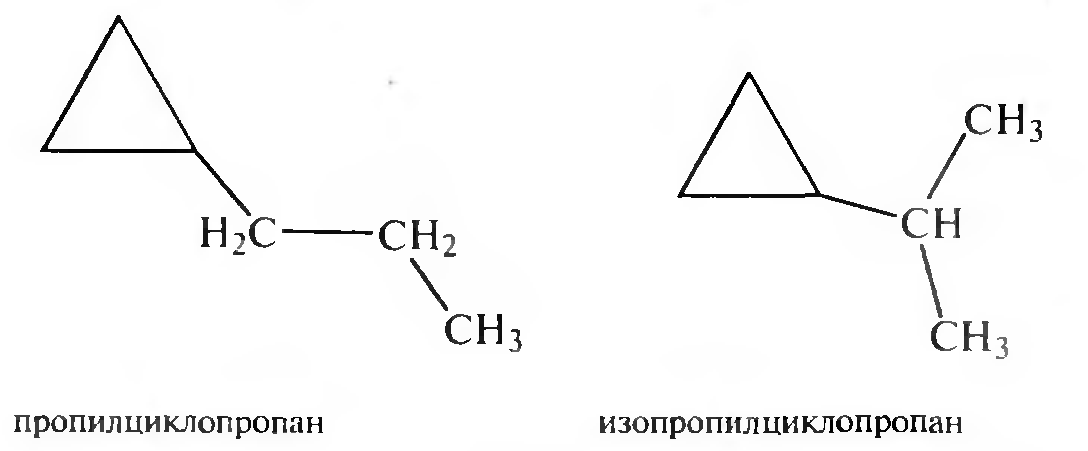
в) изомерия боковых цепей.
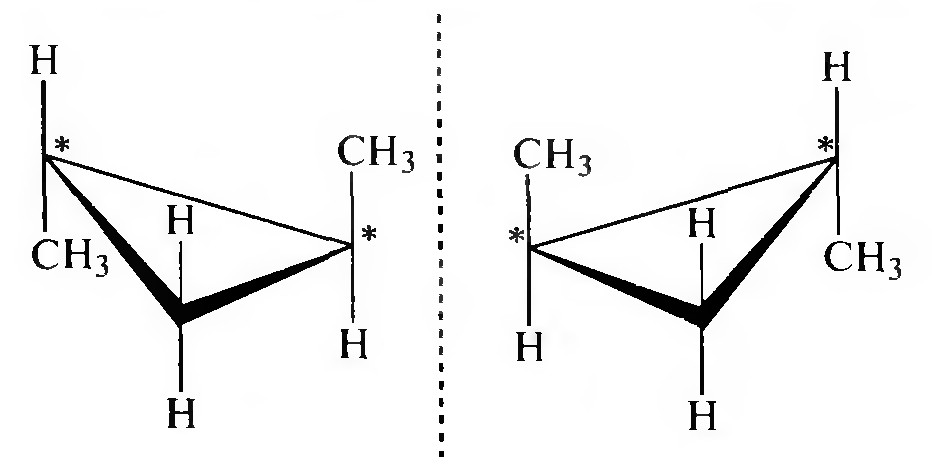
Геометрическая изомерия циклоалканов обусловлена различным расположением заместителей относительно плоскости цикла.
 Следует
учитывать, что циклоалканы, как правило,
имеют не плоское (кроме циклопропана),
а пространственное строение в виде
определенных конформаций.
Следует
учитывать, что циклоалканы, как правило,
имеют не плоское (кроме циклопропана),
а пространственное строение в виде
определенных конформаций.
При рассмотрении геометрических изомеров условно считают строение циклоалканов плоским.
Оптическая изомерия характерна для циклоалканов, молекулы которых не имеют плоскости симметрии.
Способы получения
Циклопропан, пиклогексан и их гомологи могут быть выделены в чистом виде из некоторых видов нефти.
Синтетические способы получения циклоалканов
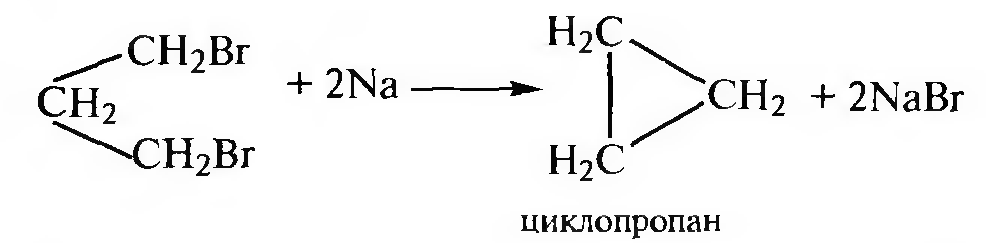
Взаимодействие α,ω-дигалогеналканов с металлическим натрием и цинком. Данный метод — внутримолекулярный вариант реакции Вюрца, позволяющий получить трех-, четырех- и пятичленные циклоалканы.
Пиролиз кальциевых, бариевых или ториевых солей дикарбоновых кислот. При пиролизе (сухой перегонке) солей дикарбоновых кислот образуются циклические кетоны, которые затем восстанавливают до соответствующих циклоалканов.
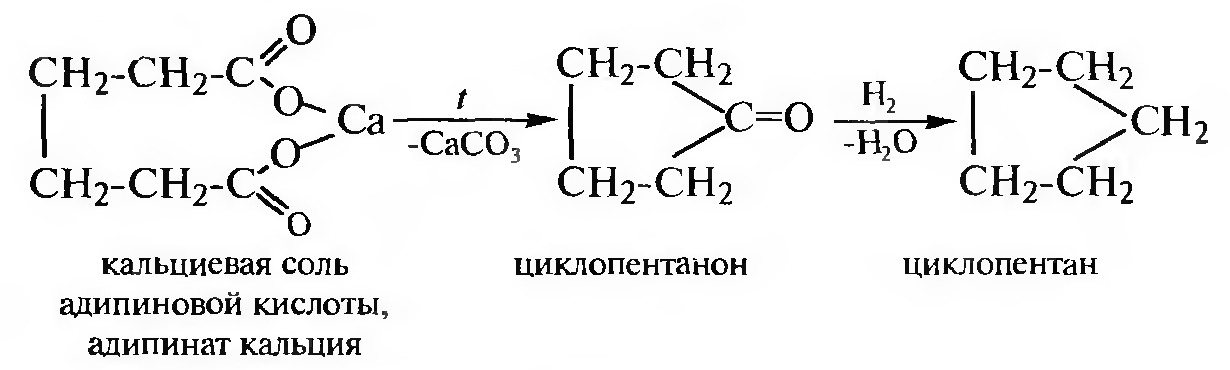
Позволяет получить пяти- и шестичленные циклоалканы.
Циклоприсоединение. Это процесс соединения двух или более ненасыщенных молекул с образованием продукта циклического строения. В зависимости от числа атомов, принимающих участие в образовании цикла, различают [2+1], [2+2] и [4+2] циклоприсоединение. Например, димеризация алкенов ([2+2] циклоприсоединение) позволяет получить циклобутан и его гомологи.
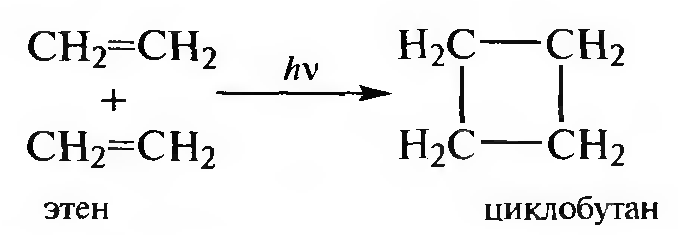
Реакцию Дильса — Альдера (диеновый синтез) относят к реакциям [4+2] циклоприсоединения.
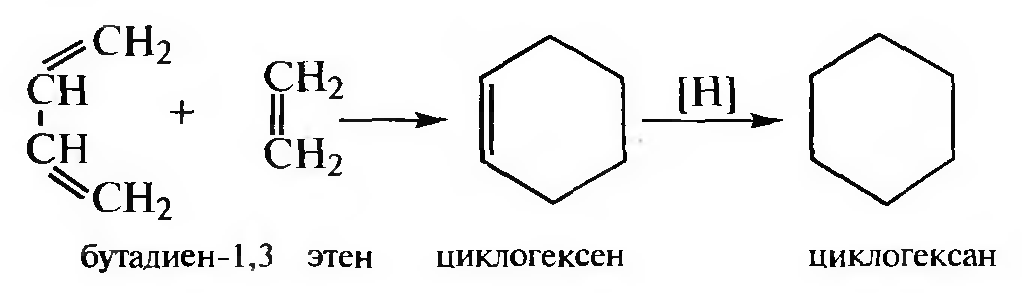
Реакция широко используется для получения циклогексана и его производных.
Электроциклические реакции. Электроциклической реакцией замыкания цикла называют реакцию, в которой происходит образование σ-связи между концами сопряженной системы молекулы.
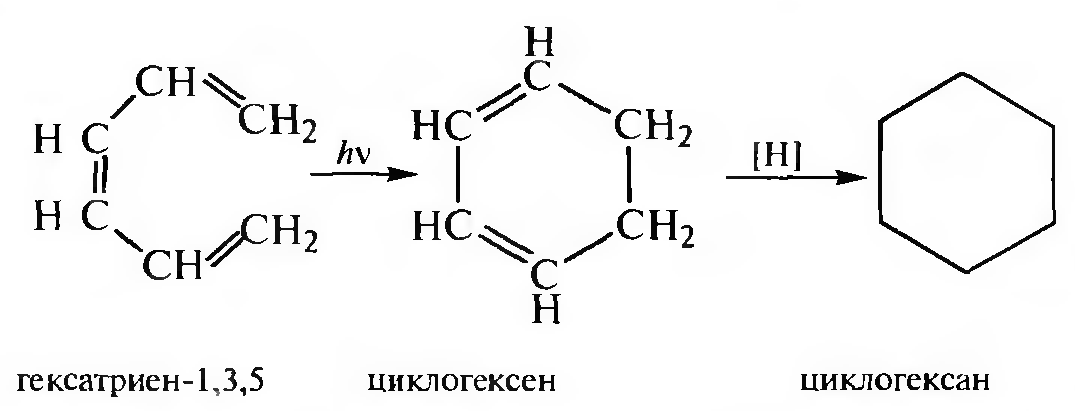
Данный способ позволяет получить ненасыщенные алициклические соединения, которые могут быть восстановлены до циклоалканов.
Физические свойства
В обычных условиях циклопропан и циклобутан — газы; циклоалканы, содержащие от 5 до 11 атомов углерода в цикле, — жидкости; последующие представители — твердые вещества.
Температуры кипения и плавления циклоалканов выше по сравнению с константами соответствующих алканов. Практически не растворимы в воде.
Строение циклоалканов
Циклоалканы представляют собой в определенной степени жесткие структуры.
Для циклоалканов характерны следующие виды напряжений:
торсионное (Питцеровское) напряжение — связано со взаимодействием химических связей в заслоненной или частично заслоненной конформациях;
напряжение Ван-дер- Ваальса — обусловлено взаимным отталкиванием заместителей при сближении на расстояние, близкое сумме их ван-дер-ваальсовых радиусов;
угловое (Байеровское) напряжение — присуще отдельным цик- лоалканам и связано с отклонением валентных углов между углерод- углеродными связями в цикле от нормального (тетраэдрического) значения.
Теория напряжения циклов была предложена немецким химиком- органиком А. Байером в 1885 г. Согласно этой теории циклоалканы представляют собой плоские многоугольники. Единственным фактором, определяющим прочность цикла, считалось наряжение, вызванное отклонением внутренних валентных углов цикла по сравнению с тетраэдрическим углом.
Если рассматривать форму циклоалканов в виде простых геометрических фигур, имеющих плоское строение, то можно отметить, что при переходе от одного цикла к другому происходит изменение валентного угла.
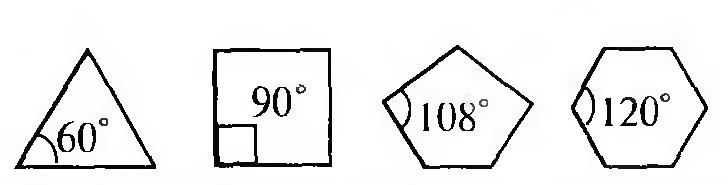
Чем значительнее отклонение, тем выше угловое напряжение и менее устойчив цикл.
В соответствии с вышеприведенным, трехчленный цикл менее устойчив, чем четырехчленный, а последний — менее устойчив, чем пятичленный. Эти представления подтверждались накопленным к тому времени экспериментальным материалом. Однако для шестичленного цикла экспериментальные данные вступали в противоречия с теорией. Шестичленные циклы (внутренний угол 120°), имеющие значительное отклонение валентных углов от тетраэдрического, оказались устойчивее пятичленных, в которых внутренние углы наиболее близки к тетраэдрическим.
Причиной несоответствия теории Байера с экспериментальным материалом явилось ошибочное представление о плоском строении циклов. В действительности же циклоалканы (исключая циклопропан) не имеют плоского строения.
Пространственное строение циклоалканов определяется разной конформационной подвижностью углеродных атомов, зависящей от числа звеньев в цикле. Молекула любого циклоалкана стремится принять в пространстве такую форму (конформацию), в которой сумма углового, торсионного и ван-дер-ваальсового напряжений была бы минимальной.
Н2С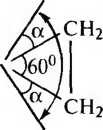

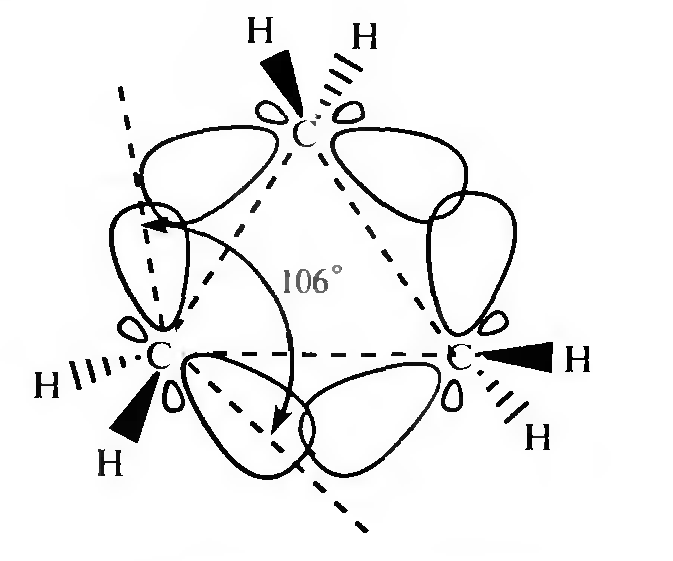
В действительности в молекуле циклопропана валентный угол равен 106°. Согласно квантово-химическим представлениям изменение угла является результатом изменения гибридизации атомов углерода. Гибридизация орбиталей в молекуле циклопропана ближе к sp2-гибридизации алкенов, чем к sp3-гибридизации алканов (промежуточное положение).
Вследствие взаимного отталкивания электронных облаков углерод-углеродных связей максимальная электронная плотность перекрывающихся орбиталей атомов углерода в молекуле циклопропана расположена не по прямой, соединяющей центры связываемых атомов, а за пределами треугольника молекулы.
Образующиеся связи называют «банановыми» или τ-(греч. «may») связями. Они занимают промежуточное положение между σ и π-связями. Образование τ-связей выгодно, так как валентные углы увеличиваются до 106° (вместо теоретически рассчитанных 60°) и снижается угловое напряжение молекулы.