
6. Алканы 1 Лекция 6. Углеводороды
АЛКАНЫ
Алканамн называют углеводороды алифатического ряда, в молекулах которых атомы углерода связаны между собой только простыми σ-связями.
Обшая формула алканов — СлН2п+2. Алканы образуют гомологический ряд, в котором каждый представитель отличается от последующего на группу —СН2— (гомологическая разность):
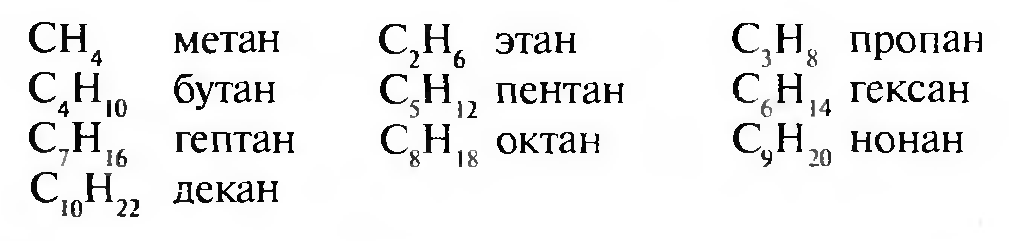
Номенклатура алканов
Первые четыре члена гомологического ряда алканов — метан, этан, пропан и бутан — имеют тривиальные названия. Названия последующих углеводородов с нормальной углеродной цепью образуют от названия греческих числительных, указывающих количество атомов углерода в молекуле, с добавлением суффикса -ан.
Названия алканов с разветвленной углеродной цепью образуются согласно заместительной номенклатуре ИЮПАК следующим образом:
Для построения названия выбирают наиболее длинную нераз- ветвленную углеродную цепь (главную углеродную цепь); если имеется несколько цепей одинаковой длины, выбирают ту, которая имеет наибольшее число разветвлений:
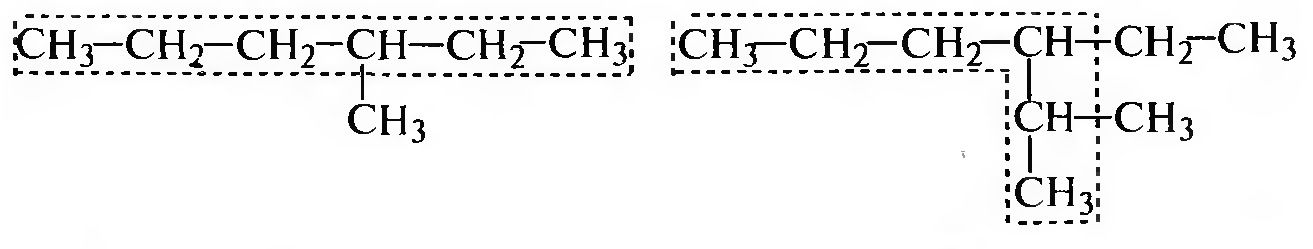
Нумерацию атомов углерода главной цепи проводят с того конца, к которому ближе заместитель:
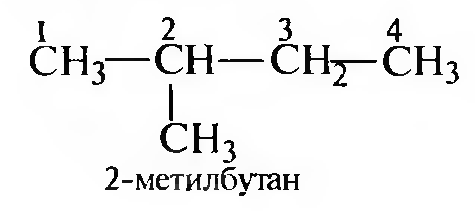
Если одинаковые заместители равноудалены от обоих концов молекулы, начало нумерации определяется алфавитным порядком:
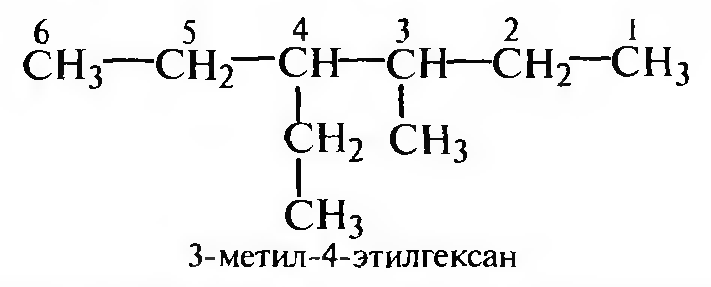
Если одинаковые заместители равноудалены от обоих концов молекулы, нумерацию начинают с того конца, где число заместителей больше:
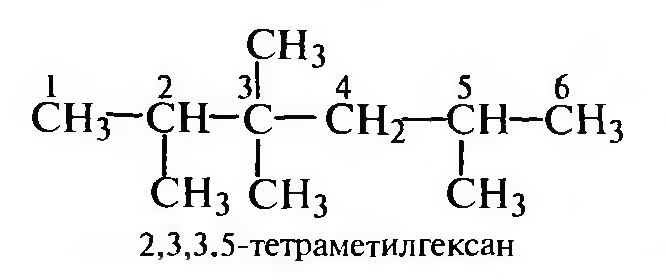
Составляют название соединения, учитывая следующие правила:
- названия заместителей перечисляют в алфавитном порядке, указывая цифровой локант, соответствующий положению каждого заместителя в главной углеродной цепи;
- число одинаковых заместителей обозначают множительными приставками дн-, три-, тетра- и т. д.;
- затем называют углеводород, в основе которого выделена главная углеродная цепь.
Если в молекуле алкана две метальные группы расположены на одном конце углеродной цепи и другие ответвления отсутствуют, используют приставку изо-; если три метальные группы — приставку нео-:
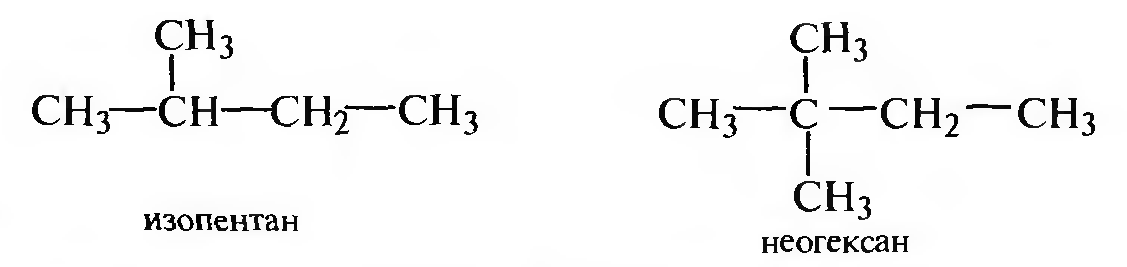
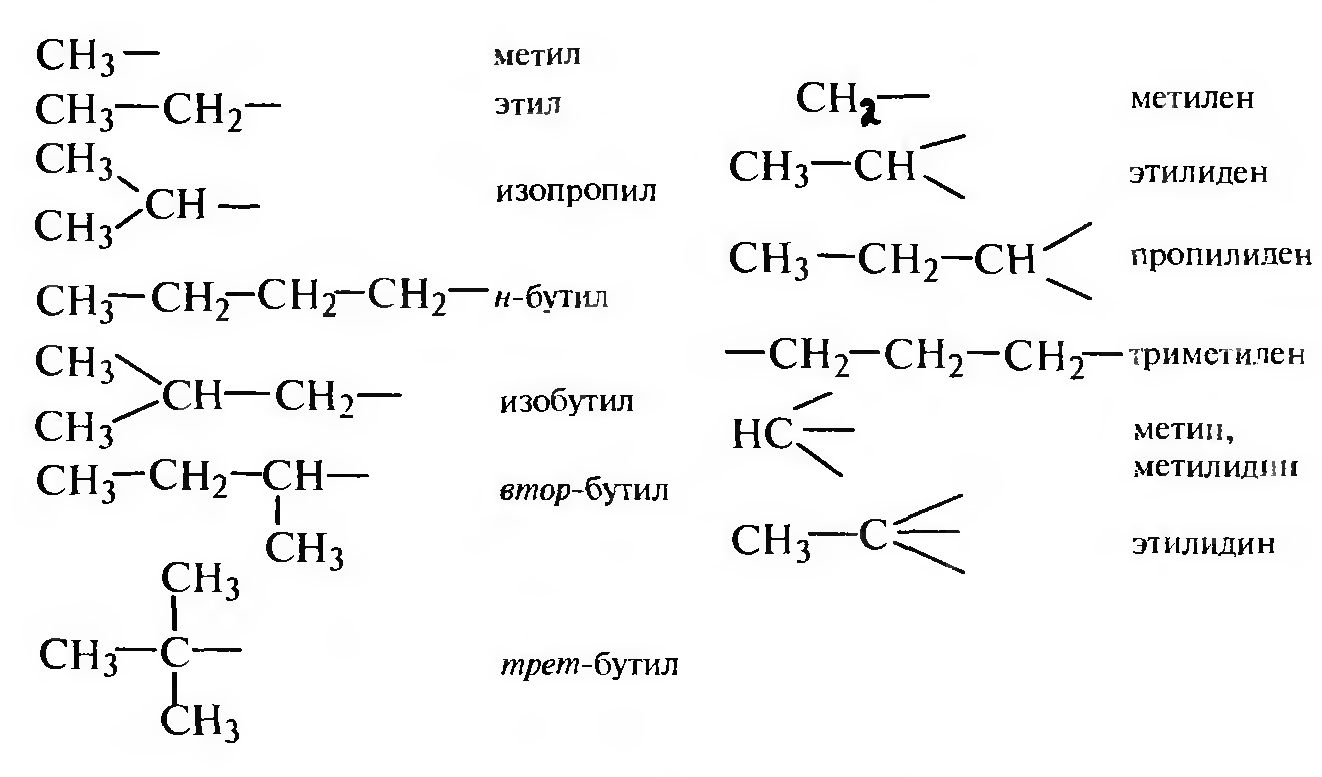
Алкил — остаток углеводорода, образующийся в результате отщепления атома водорода.
Необходимо обратить внимание на то, что не следует путать понятия «углеводородный радикал» как остаток алкана (R—) со «свободным радикалом» (R·), который имеет неспаренный электрон.
Важно запомнить, что при переходе от алкана к алкилу следует заменить суффикс -ан на -ил. Для двухвалентных радикалов с двумя свободными валентностями возле одного углеродного атома суффикс -ан изменяется на -илиден, для трехвалентных радикалов с тремя свободными валентностями возле одного углеродного атома соответственно суффикс -ан изменяют на -илндин.
Наиболее часто встречающиеся радикалы:
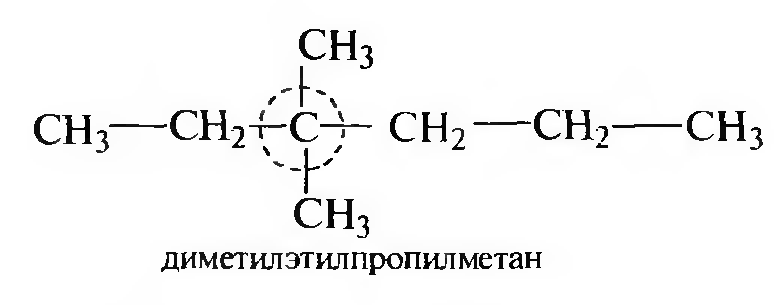
Алканы по рациональной номенклатуре рассматривают как производные метана, в молекуле которого один или несколько атомов водорода замещены на углеводородные радикалы. Заместители вокруг «метанового» углерода перечисляют в порядке увеличения сложности их строения:
Изомерия
Структурная изомерия алканов обусловлена различной последовательностью связывания атомов углерода в молекуле (изомерия цепи)
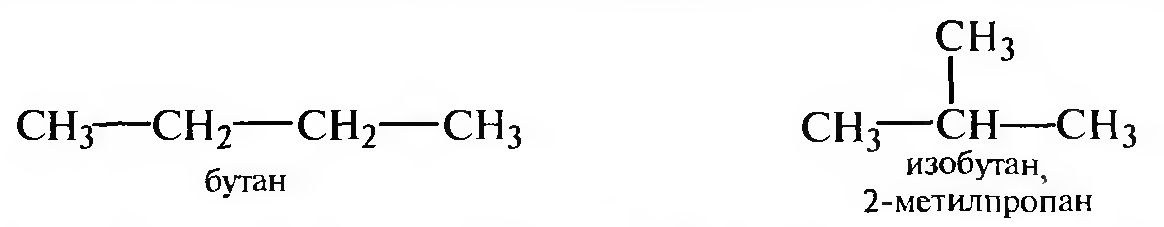
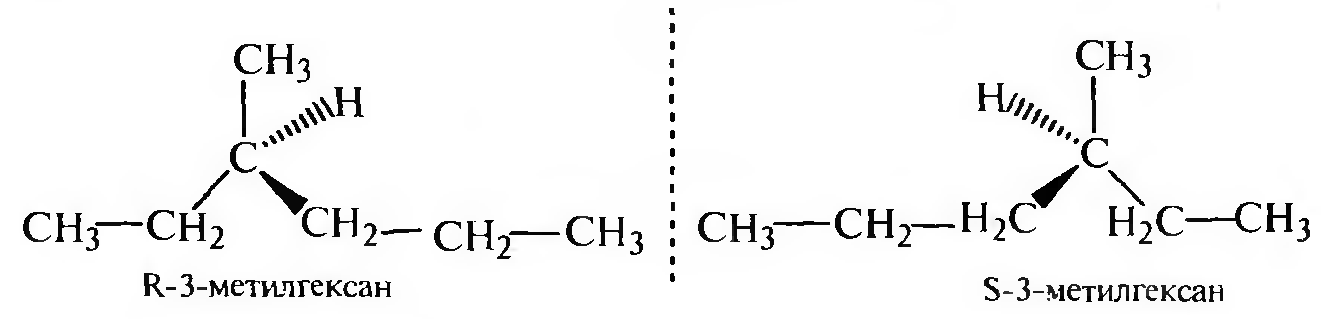
В ряду алканов, начиная с гептана С7Н16, возможно проявление оптической изомерии:
![]()
Fe,
/
CH3I
+
2Na
■
CH3Na
+
CH3I
СНзЫа
+ Nal
метилнатрий
СН3
— снз
+NaI
этан
Если
в качестве исходных веществ используют
два разных галоген- алкана, образуется
смесь алканов, которую трудно разделить.




Природными источниками алканов являются нефть, газ, уголь, торф, сланцы и др. Основная цель промышленного получения алканов — выделение различных фракций или индивидуальных соединений.
Синтетические способы получения
Оксосинтез алканов (метод Фишера — Тропша). Каталитическое гидрирование оксида углерода (II) позволяет получить алканы нормального строения (состав С6— С10). Смесь оксида углерода (II) и водорода пропускают над катализатором Fe — Со при температуре 180— 300 °С.
![]()
Каталитическое гидрирование алкенов и алкинов. Присоединение водорода по месту разрыва кратной связи алкенов и алкинов осуществляют в присутствии катализаторов (тонко измельченных Pt, Pd или Ni).
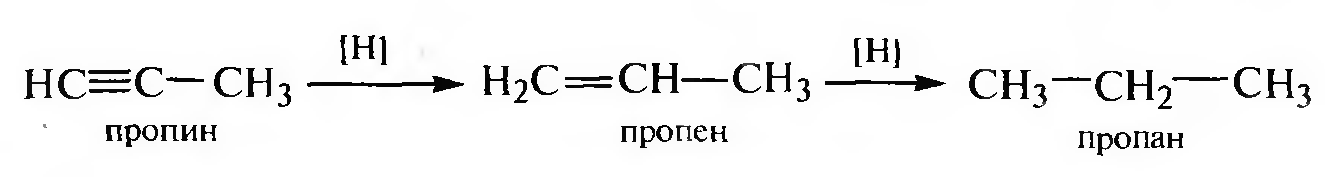
Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца). Используется для синтеза симметричных алканов и протекает через стадию образования металлорганических соединений.
![]()
Реакция Вюрца протекает в две стадии:
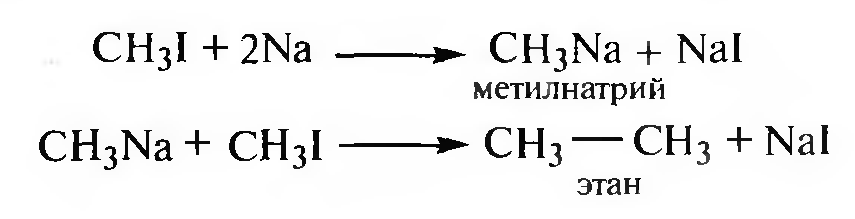
Если в качестве исходных веществ используют используют два разных галогеналкана, получается смесь алканов, которую трудно разделить.
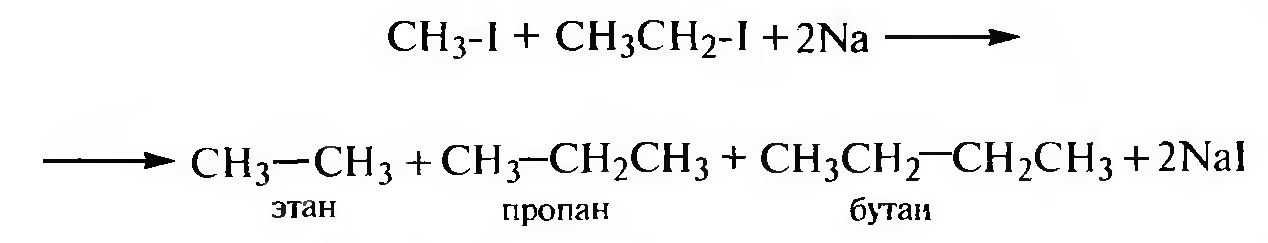
Сплавление солей карбоновых кислот со щелочами. Соли щелочных металлов карбоновых кислот при сплавлении со щелочью образуют алканы.
![]()
Гидролиз металлорганических соединении. Действием воды на карбид алюминия получают метан в лабораторных условиях.
![]()
Электролиз водных растворов солей карбоновых кислот (реакция Кольбе). Чаще электролизу подвергают калиевые или натриевые соли карбоновых кислот:
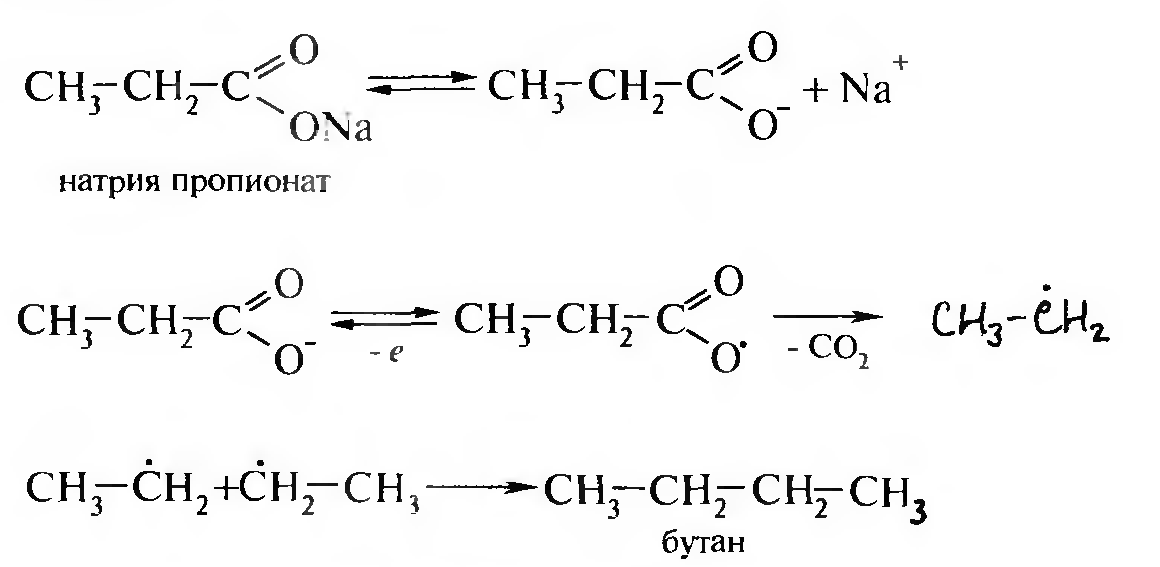
На аноде анион карбоновой кислоты окисляется, образуя свободный радикал, который легко декарбоксилируется. Алкильные радикалы вследствие рекомбинации превращаются в алкан. На катоде образуется водород и соответствующий гидроксид щелочного металла.
