
Второе валентное состояние углерода (sp2 - гибридцзация). Π-Связи.
Состояние sp2-гибридизации — результат взаимодействия одной s- и двух р-орбиталей (рх, ру).
![]()
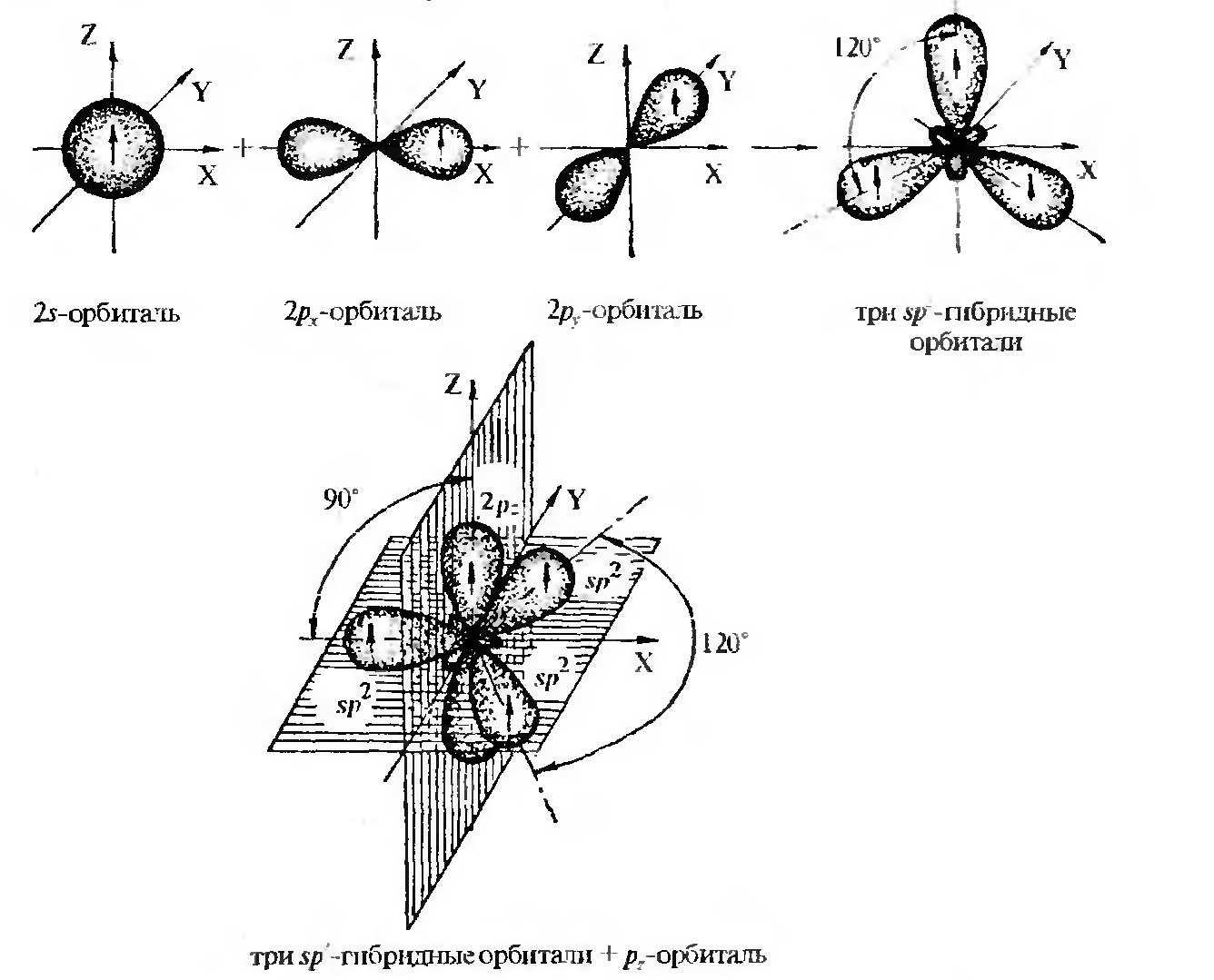
Строение атома углерода в sp2-гибридизации
Образованные три эквивалентные sp2-гибридные орбитали находятся в одной плоскости под углом 120°, поэтому sp2-гибридизация называется тригональной. Негибридизованная рz-орбиталь расположена в плоскости, которая перпендикулярна плоскости расположения гибридных орбиталей. Такая гибридизация характерна для соединений с двойными связями, например, для этилена.
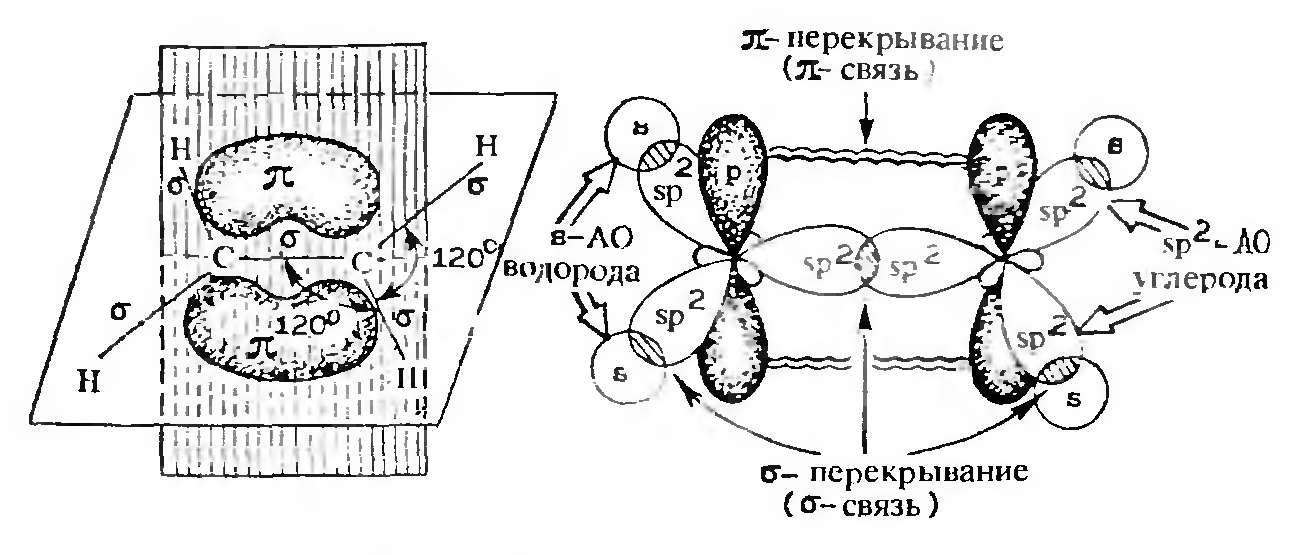
Образование π-связи в молекуле этилена
Атомы углерода в этилене находятся в sp2-гибридизации. Перекрывание трех гибридных орбиталей каждого из углеродов дает σ-связи (четыре С-Н и одну С-С). Кроме того, перекрывание двух негибридизованных р-орбиталей в плоскости, перпендикулярной плоскости σ-связи, называют π-перекрываннем, а образующаяся в результате связь — π-связью. Ее максимальная электронная плотность сконцентрирована в двух областях — выше и ниже оси, соединяющей центры атомов. π-Связь менее прочна, чем σ. π-Связь образуется только между атомами, которые находятся в sp2- или sp-гибридизации.
Третье валентное состояние (sp-гибридизация)
Состояние sp-гибридизации — результат взаимодействия одной s- и одной р-орбитали (рх).
sp-Гибридизацию называют еше линейной потому, что две sp-гиб- ридные орбитали расположены под углом 180°. Остальные две негиб- ридизованные рy- и рz-орбитали находятся в двух взаимно перпендикулярных плоскостях и расположены под прямым углом к sp-гибридным орбиталям. Доля s-облака в каждой из двух гибридных sp-орбиталей равна ½. Такой тип гибридизации характерен для соединений с тройной связью, например, для ацетилена.
В молекуле ацетилена sp-гибридизованные атомы образуют две простые С—Н σ-связи и одну тройную связь между двумя атомами углерода, которая состоит из одной σ- и двух π-связей, расположенных во взаимно перпендикулярных плоскостях.
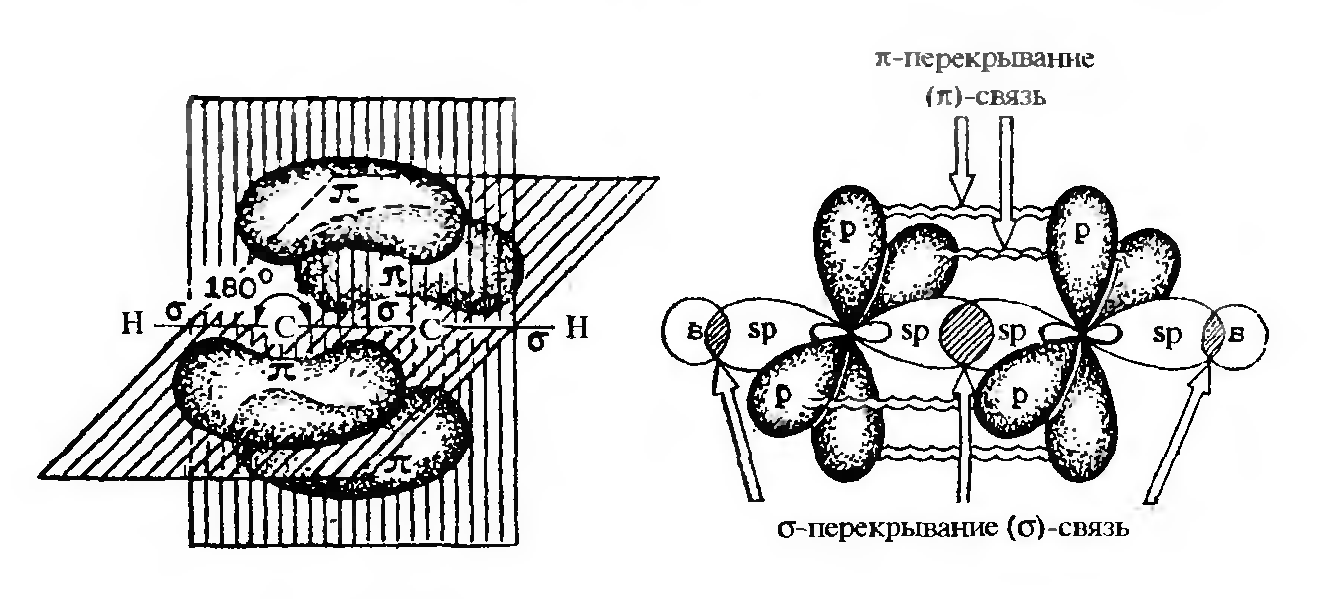
Образование π-связи в молекуле ацетилена
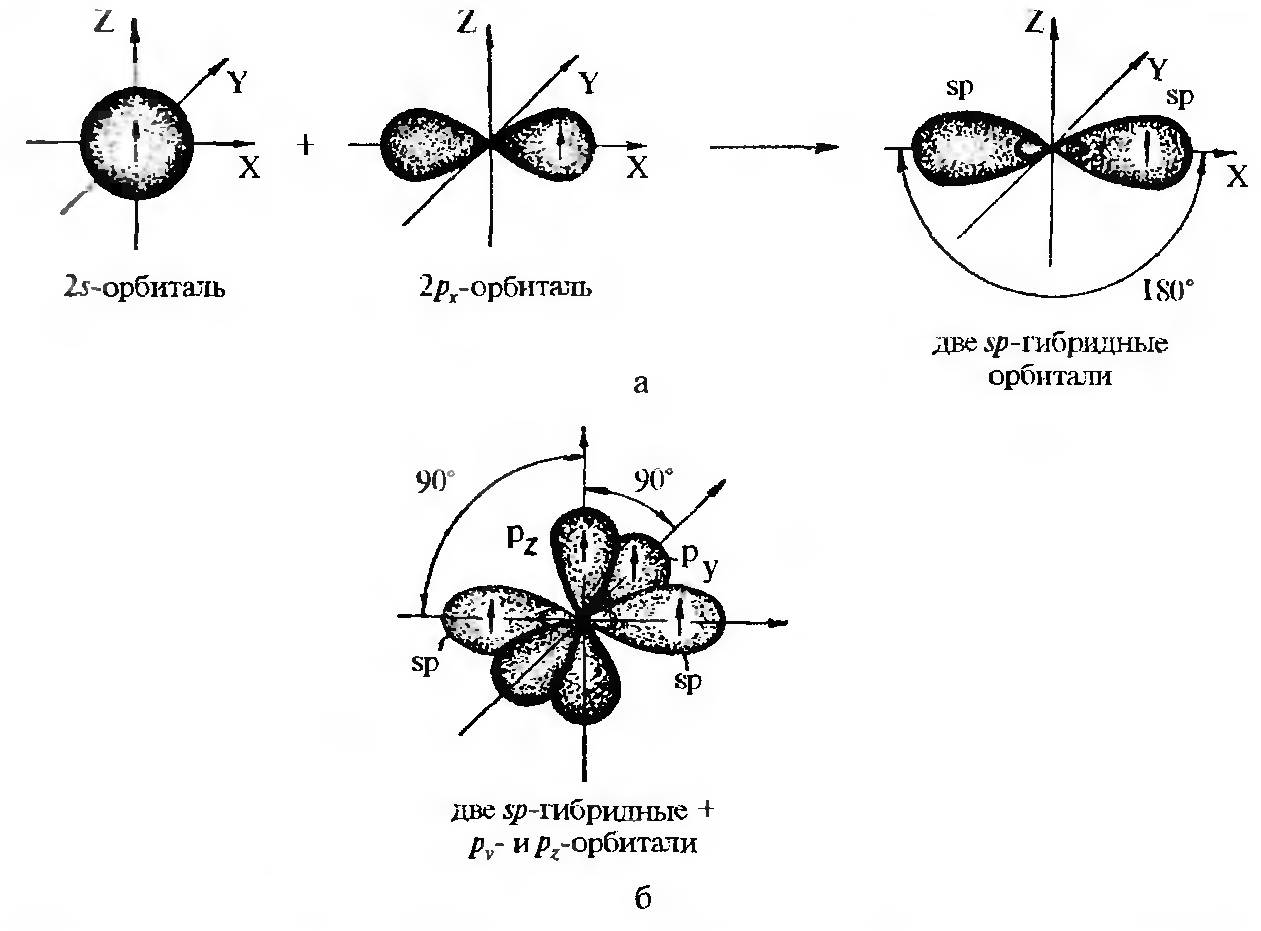
Строение атома углерода в sp-гибридизации:
а – схема образования гибридных sp-орбиталей;
б – взаимное размещение орбиталей при sp-гибридизации
Для описания химической связи с позиций квантовой механики пользуются двумя основными методами: валентных связей (ВС) и молекулярных орбиталей (МО).
Метод валентных связей был предложен в 1927 году В. Гайтлером и Ф. Лондоном. Основные положения метода заключаются в следующем. Химическая связь представлена в виде пары электронов с про- тивоположными спинами. Она образуется в результате перекрывания атомных орбиталей.
При образовании молекулы атомные орбитали остаются без изменений, а пара связывающих электронов локализована между двумя атомами.
Схема
образования ковалентной связи Н—Н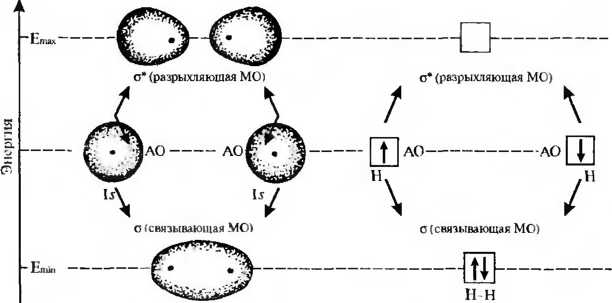
В отличие от метода валентных связей метод молекулярных орбиталей рассматривает молекулу не как совокупность атомов, сохраняющих свою индивидуальность, а как единое целое. Предполагается, что каждый электрон в молекуле движется в суммарном поле, создаваемом остальными электронами и всеми ядрами атомов. Иначе говоря, в молекуле различные АО взаимодействуют между собой с образованием нового типа орбиталей, называемых молекулярными орбиталями (МО).
Перекрывание двух атомных орбиталей приводит к образованию двух молекулярных орбиталей.
Одна из них имеет более низкую энергию, чем исходные АО, и называется связывающей орбиталью, другая обладает более высокой энергией, чем образующая ее АО, и называется разрыхляющей или ан- тисвязывающей орбиталью. Заполнение молекулярных орбиталей электронами происходит аналогично заполнению атомных, то есть по принципу Паули и в соответствии с правилом Гунда. Молекулярная разрыхляюшая орбиталь в основном состоянии остается вакантной. Ее заполнение электронами происходит при возбуждении молекулы, что ведет к разрыхлению связи и распаду молекулы на атомы.
