
Лекция 2. Химическая связь.
Современная теория химической связи базируется на квантовомеханических представлениях о строении молекулы. Впервые электронную теорию химической связи, предложили в 1916 г. немецкий ученый В. Коссель и американский ученый Дж. Н. Льюис. Авторы электронной теории выдвинули идею о том, что химическая связь — результат взаимодействия внешних электронных оболочек атомов. Образуя химическую связь, каждый атом стремится заполнить внешнюю электронную оболочку до конфигурации, присущей инертным газам. При этом он принимает участие в образовании обшей электронной пары, отдает или принимает электроны. Принцип заполнения валентных оболочек до конфигурации инертных газов получил название октетное правило.
ТИПЫ ХИМИЧЕСКИХ СВЯЗЕЙ
Согласно принятой в настоящее время классификации существует несколько типов химической связи: ионная, ковалентная, водородная, металлическая и др. По способу образования химической связи различают две основные: ионную и ковалентную.
ИОННАЯ СВЯЗЬ
Ионная связь — характерна для атомов значительно отличающихся по электроотрицательности. Ионный тип связи характерен для неорганических соединений.
Рассмотрим, как осуществляется связь в хлориде натрия:
![]()
Хлор по сравнению с натрием обладает большей электроотрицательностью, то есть большим сродством к электрону. Вследствие этого электрон переходит с внешней оболочки натрия на внешнюю оболочку хлора, при этом образуются положительный и отрицательный заряды, между которыми действуют силы электростатического притяжения. Ион натрия приобретает электронную конфигурацию неона, а ион хлора — конфигурацию аргона.
Соединения с ионной связью характеризуются относительно большим дипольным моментом, хорошей электропроводимостью, высокими температурами плавления.
Ковалентная связь
Ковалентная связь — основной тип связи в органических соединениях, характеризующийся увеличением электронной плотности между химически связанными атомами в молекуле по сравнению с распределением электронной плотности в свободных атомах.
Ковалентная связь возникает между атомами, имеющими одинаковую или близкую по значению электроотрицательность. Для образования ковалентной связи каждый из атомов предоставляет по одному электрону, при этом образуется общая пара электронов, которая в равной степени принадлежит обоим атомам. На письме ковалентная связь изображается черточкой между атомами.
Классическим примером ковалентной связи является молекула метана:
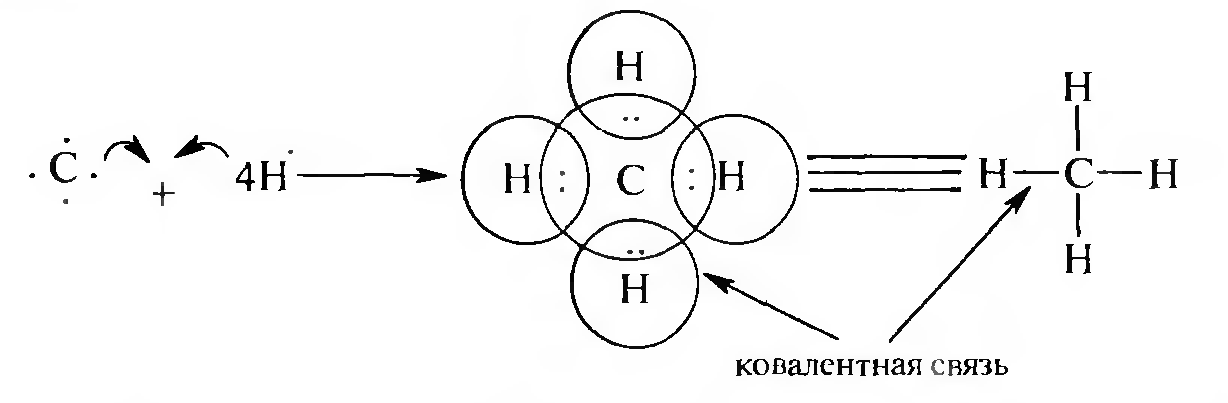
Атом углерода содержит на внешнем электронном уровне четыре валентных электрона и, чтобы доукомплектовать этот слой до октетной конфигурации, он образует четыре общие электронные пары с четырьмя атомами водорода.
В зависимости от электроотрицательности атомов между которыми образовалась ковалентая связь, она может быть полярной или неполярной.
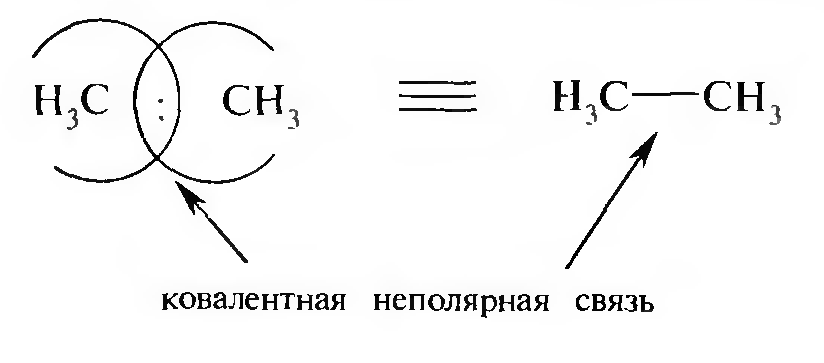
Если электроотрицательность атомов одинакова, то общая электронная пара находится на одинаковом расстоянии от ядра каждого из атомов. Такая связь называется ковалентной неполярной:
При возникновении ковалентной связи между атомами с различной электроотрицательностью общая электронная пара смещается к более электроотрицательному атому. В этом случае образуется ковалентная полярная связь.
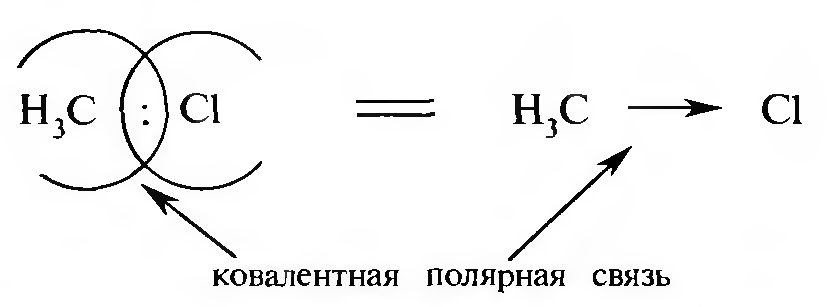
Стрелка в формуле указывает на полярность ковалентной связи. С помощью греческой буквы δ («дельта») обозначают частичные заряды на атомах: δ+ — пониженную, δ- — повышенную электронную плотность.
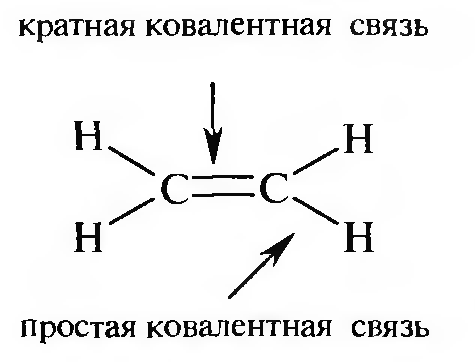
По числу электронных пар, образующих ковалентную связь, различают связи простые — с одной парой электронов и кратные — с двумя или тремя парами.
Основные характеристики ковалентной связи: длина связи (расстояние между центрами атомов в молекуле); энергия связи (энергия, которую необходимо затратить на разрыв связи); полярность связи (неравномерное распределение электронной плотности между атомами, обусловленное различной электроотрицательностью); поляризуемость (легкость, с которой смещается электронная плотность связи к одному из атомов под влиянием внешних факторов); направленность (ковалентная связь, направленная до линии, соединяющей центры атомов).
Атомы некоторых элементов (кислорода, азота, серы, галогенов и др.) расходуют не все внешние электроны для формирования октетной оболочки. Такие электроны называют неподеленные, необобществленные или π-электроны.
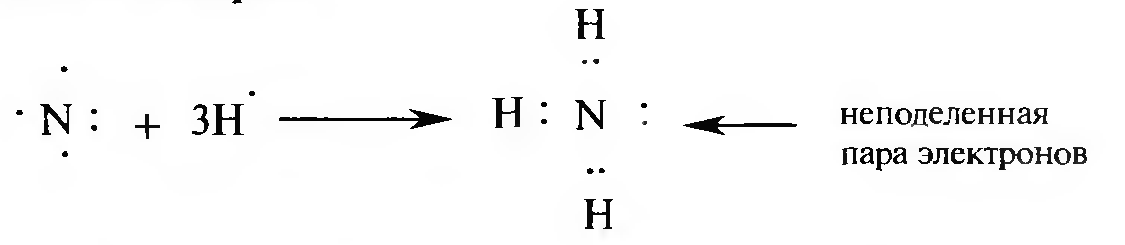
Донорно-акцепторная связь или координационная — разновидность ковалентной связи, которая отличается способом образования.
Донор — атом, который должен иметь пару неподеленных электронов, а акцептором может быть любой атом (в том числе и протон), у которого не хватает до образования октета двух электронов.
Например, образование иона аммония протекает по донорно-ак- цепторному механизму. Ковалентная связь образуется за счет того, что атом азота (донор электронов) отдает неподеленную пару электронов на образование ковалентной связи протону (акцептору электронов):
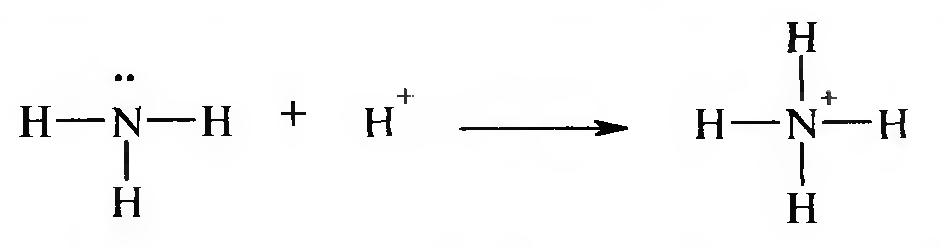
Вновь образовавшаяся связь Н—N ничем не отличается от остальных связей Н—N, которые имелись у аммиака. Такая связь называется еще координационной.
Семиполярная связь — частный случай донорно-акцепторной связи. Она образуется между атомами, один из которых имеет неподеленную пару электронов, а другой содержит на внешнем энергетическом уровне шесть электронов (секстет), то есть имеет вакантную атомную орбиталь.
Рассмотрим образование семиполярной связи в молекуле оксида триметиламина:
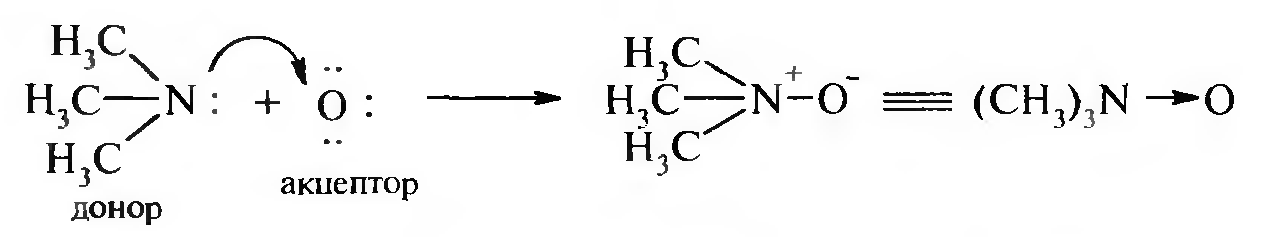
В результате образования связи атом кислорода (акцептор) приобретает отрицательный заряд, а атом азота (донор) — положительный. Такой вид связи обозначают следующим образом:
![]()
Соединения с семиполярной связью не проводят электрический ток, несмотря на наличие наряду с ковалентной связью и ионного взаимодействия.
