
- •Раздел 8
- •8.2. Аналитические реакции и их характеристика
- •8.3. Аналитическая классификация катионов
- •Раздел 9 первая аналитическая группа катионов
- •9.1. Общая характеристика группы
- •9.4. Систематический анализ смеси катионов первой аналитической группы
- •Отделение ионов аммония
- •Определение катионов Натрия и Калия
- •Раздел 10 вторая аналитическая группа катионов
- •10.1. Общая характеристика группы и биологическая роль катионов
- •10.3. Систематический анализ смеси катионов второй аналитической группы
- •1. Осаждение катионов второй аналитической группы
- •2 Исследование осадка
- •Раздел 11 третья аналитическая группа катионов
- •11.1. Общая характеристика группы
- •11.2. Биологическая роль и медицинское применение соединений
- •10. Реакция с групповым реактивом (сульфатной кислотой).
- •11.4. Систематический анализ смеси катионов третьей аналитической группы
- •Осаждение катионов в виде сульфатов
- •Превращение сульфатов катионов III группы в карбонаты
- •Разделение катионов и их определение
- •Раздел 12 четвертая аналитическая группа катионов
- •12.1. Общая характеристика группы
- •12.2. Биологическая роль и значение соединений катионов IV группы для медицины
- •14. Реакция с окислителями или восстановителями.
- •12.4. Систематический анализ смеси катионов четвертой аналитической группы
- •1. Действие группового реактива
- •2 Отделение катионов Алюминия
- •3 Анализ центрифугата
- •Раздел 13 пятая аналитическая группа катионов
- •13.1. Общая характеристика группы
- •13.2. Биологическая роль и медицинское применение соединений
- •13.4. Анализ смеси катионов пятой аналитической группы
- •1. Предыдущие испытания
- •2. Осаждение катионов V группы
- •4. Обнаружение катионов Мангана(іі)
- •Раздел 14 шестая аналитическая группа катионов
- •14.1. Общая характеристика группы
- •14.2. Биологическая роль и значения соединений катионов VI аналитической группы для медицины
- •14.4. Анализ смеси катионов шестой аналитической группы дробним методом
- •14.5. Систематический анализ смеси катионов шестой аналитической группы
- •1. Разделение катионов
- •2. Анализ центрифугата
- •Систематический анализ смеси катионов шестой аналитической группы
- •Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
- •16.1. Первая аналитическая группа анионов
- •16.1.1. Общая характеристика группы
- •16.1.2. Биологическая роль и медицинское применение соединений
- •16.1.3. Качественные реакции анионов so42-, so32-, ро43-, со32-, с2о42-, с4н4o62-, нс6н5o72-
- •Реакции сульфитов-ионов so32-
- •Реакции фосфат-ионов ро43-
- •Реакции карбонат-ионов co32-
- •Реакции оксалат-ионов с2о42-
- •13. Реакция с групповым реактивом ВаС12. Барий хлорид образует с анионами с2о42- белый осадок барий оксалата:
- •Реакции тартрат-ионов с4н4о62-
- •Реакции цитрат-ионов нс6н5о72-
- •16.2. Вторая аналитическая группа анионов
- •16.2.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.2.2. Качественные реакции анионов Сl-, Br-, і-, s2-, с6н5соо- Реакции хлорид-ионов Сl-
- •Реакции бромид-иоиов Вr-
- •Реакции йодид-ионов I-
- •Реакции сульфид-ионов s2-
- •Реакции бензоат-ионов с6н5соо-
- •16,3. Третья аналитическая группа анионов
- •16.3.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.3.2. Качественные реакции анионов no2-, no3-, МnО4-, сн3соо-, с6н4(он)соо- Реакции нитрит-ионов no2-
- •Реакции нитрат-ионов no3-
- •Реакции перманганат-ионов МnО4-
- •Реакции ацетат-ионов сн3соо-
- •Реакции салицилат-ионов с6н4(он)соо-
10.3. Систематический анализ смеси катионов второй аналитической группы
Систематический анализ катионов II аналитической группы выполняют в такой последовательности (см. схему)
Схема анализа смеси катионов второй аналитической группы
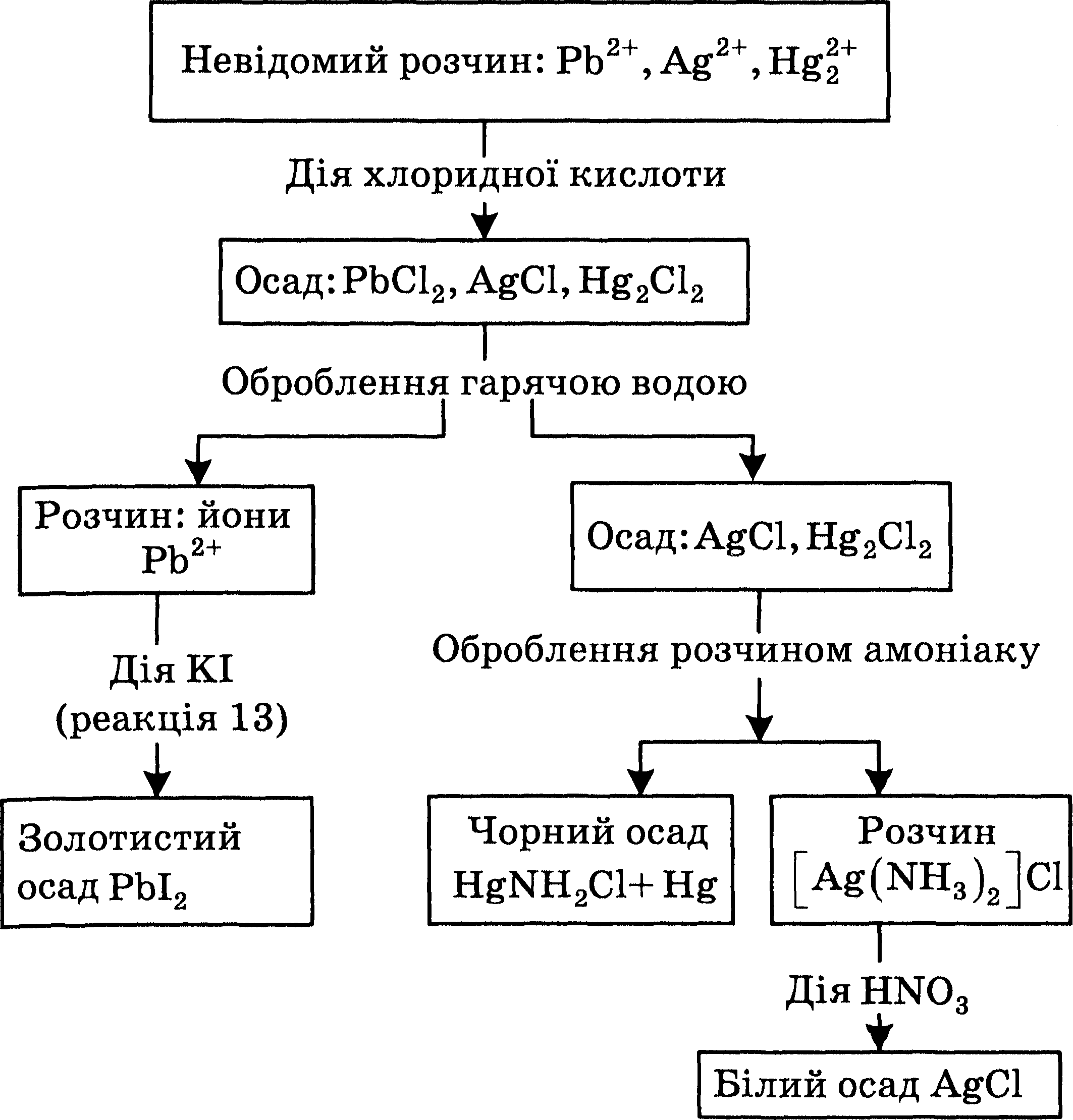
1. Осаждение катионов второй аналитической группы
В коническую пробирку вносят 2-3 мл исследуемого раствора и добавляют раствор хлоридной кислоты НС1 (1:3) до полного выделения осадка. После отстаивания осадка проверяют полноту осаждения (раствор не должен мутнеть после добавления хлоридной кислоты). Осадок, в котором содержатся хлориды аргентума, плюмбума и меркурия(І), отделяют от раствора центрифугуваннием.
2 Исследование осадка
Определение катионов Рb2+. К осадку хлоридов аргентума, плюмбума и меркурия(І) добавляют 2 мл горячей воды, тщательно перемешивают и несколько минут нагревают на водяной бане. Ионы Плюмбума переходят в раствор, в котором их обнаруживают с помощью калий йодида (реакция 13*) или калий хромата (реакция 15*).
Определение ионов Hg22+. К осадку, который остался после обработки водой, добавляют приблизительно 1 мл NH4OH(KOHЦ) и аккуратно перемешивают. Почернение осадка свидетельствует о наличии ионов Hg(I) (см. реакцию 6). Осадок отделяют центрифугированием, а прозрачный раствор переносят в другую пробирку.
Определение ионов Ag+. К нескольким каплям аммиачного раствора, полученного после отделения ионов Нg22+ , добавляют 3-4 капли HNО3(KOHЦ) и перемешивают. Образование белого осадка AgCl (реакция 1*) свидетельствует о наличии в исследуемом растворе ионов Ag+.
Раздел 11 третья аналитическая группа катионов
11.1. Общая характеристика группы
К третьей аналитической группе принадлежат катионы s2-элементов: Са2+, Ва2+, Sr2+. Групповым реактивом является сульфатная кислота H2SО4, которая образовывает с этими катионами не растворимые в кислотах и щелочах сульфаты: CaSО4, BaSО4, SrSО4.
В периодической системе соответствующие химические элементы размещены в ІІА группе, принадлежат к щелочноземельним металлам, по активности они уступают щелочным металлам. Катионы этой аналитической группы характеризуются низкими значениями относительных электроотрицательностей и малыми ионными радиусами.
В окислительно-восстановительных реакциях эти элементы легко отдают по два валентных электрона, образовывая положительно заряженные ионы с электронной структурой инертного газа, например:
+20Са ls22s22p63s23p64s2 =[Ar]4s2-2е→[Ar],
Са - 2е- →Са2+.
Атомы s2-элементов имеют сильные восстановительные свойства (φ°Ва2+/Ва= -2,9 В, φ°Са2+/Са = -2,8 В), т.е. они являются донорами электронов. Они образуют преимущественно ионные соединения, которые хорошо растворяются в воде, например нитраты, ацетаты, хлориды.
К малорастворимым в воде солям относятся сульфаты, карбонаты и фосфаты этих металлов. Сульфаты катионов третьей группы не растворимы в кислотах и щелочах. Для улучшения растворимости их переводят в карбонаты, которые хорошо растворяются в кислотах.
Реакции комплексообразования для s2-элементов малохарактерны. В водных растворах они образовывают неустойчивые аквакомплексы типа [Ме(Н2О)n] , где n — координационное число. Так, ионы Са2+ в водных растворах биологических жидкостей образовывают неустойчивые аквакомплекси с координационным числом 6. Стойкие внутрикомплексные соединения (хелати, см. розд. 5) эти катионы образовывают только с полидентатными лигандами, в частности с трилоном Б (см. разд. 22).
Следует отметить, что при действии на твердый кальций сульфат раствором аммоний сульфата образовывается растворимая комплексная соль по уравнениию
CaSO4(T) + (NH4)2SO4 = (NH4)2[Са(SО4)2].
Эту реакцию используют для отделения йонов Са2+ от других катионов третьей аналитической группы.
