
- •Раздел 8
- •8.2. Аналитические реакции и их характеристика
- •8.3. Аналитическая классификация катионов
- •Раздел 9 первая аналитическая группа катионов
- •9.1. Общая характеристика группы
- •9.4. Систематический анализ смеси катионов первой аналитической группы
- •Отделение ионов аммония
- •Определение катионов Натрия и Калия
- •Раздел 10 вторая аналитическая группа катионов
- •10.1. Общая характеристика группы и биологическая роль катионов
- •10.3. Систематический анализ смеси катионов второй аналитической группы
- •1. Осаждение катионов второй аналитической группы
- •2 Исследование осадка
- •Раздел 11 третья аналитическая группа катионов
- •11.1. Общая характеристика группы
- •11.2. Биологическая роль и медицинское применение соединений
- •10. Реакция с групповым реактивом (сульфатной кислотой).
- •11.4. Систематический анализ смеси катионов третьей аналитической группы
- •Осаждение катионов в виде сульфатов
- •Превращение сульфатов катионов III группы в карбонаты
- •Разделение катионов и их определение
- •Раздел 12 четвертая аналитическая группа катионов
- •12.1. Общая характеристика группы
- •12.2. Биологическая роль и значение соединений катионов IV группы для медицины
- •14. Реакция с окислителями или восстановителями.
- •12.4. Систематический анализ смеси катионов четвертой аналитической группы
- •1. Действие группового реактива
- •2 Отделение катионов Алюминия
- •3 Анализ центрифугата
- •Раздел 13 пятая аналитическая группа катионов
- •13.1. Общая характеристика группы
- •13.2. Биологическая роль и медицинское применение соединений
- •13.4. Анализ смеси катионов пятой аналитической группы
- •1. Предыдущие испытания
- •2. Осаждение катионов V группы
- •4. Обнаружение катионов Мангана(іі)
- •Раздел 14 шестая аналитическая группа катионов
- •14.1. Общая характеристика группы
- •14.2. Биологическая роль и значения соединений катионов VI аналитической группы для медицины
- •14.4. Анализ смеси катионов шестой аналитической группы дробним методом
- •14.5. Систематический анализ смеси катионов шестой аналитической группы
- •1. Разделение катионов
- •2. Анализ центрифугата
- •Систематический анализ смеси катионов шестой аналитической группы
- •Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
- •16.1. Первая аналитическая группа анионов
- •16.1.1. Общая характеристика группы
- •16.1.2. Биологическая роль и медицинское применение соединений
- •16.1.3. Качественные реакции анионов so42-, so32-, ро43-, со32-, с2о42-, с4н4o62-, нс6н5o72-
- •Реакции сульфитов-ионов so32-
- •Реакции фосфат-ионов ро43-
- •Реакции карбонат-ионов co32-
- •Реакции оксалат-ионов с2о42-
- •13. Реакция с групповым реактивом ВаС12. Барий хлорид образует с анионами с2о42- белый осадок барий оксалата:
- •Реакции тартрат-ионов с4н4о62-
- •Реакции цитрат-ионов нс6н5о72-
- •16.2. Вторая аналитическая группа анионов
- •16.2.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.2.2. Качественные реакции анионов Сl-, Br-, і-, s2-, с6н5соо- Реакции хлорид-ионов Сl-
- •Реакции бромид-иоиов Вr-
- •Реакции йодид-ионов I-
- •Реакции сульфид-ионов s2-
- •Реакции бензоат-ионов с6н5соо-
- •16,3. Третья аналитическая группа анионов
- •16.3.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.3.2. Качественные реакции анионов no2-, no3-, МnО4-, сн3соо-, с6н4(он)соо- Реакции нитрит-ионов no2-
- •Реакции нитрат-ионов no3-
- •Реакции перманганат-ионов МnО4-
- •Реакции ацетат-ионов сн3соо-
- •Реакции салицилат-ионов с6н4(он)соо-
9.4. Систематический анализ смеси катионов первой аналитической группы
Систематический анализ катионов основывается на применении одной из аналитических классификаций, в данном случае кислотно-основной. Рассмотрим систематический ход анализа катионов первой аналитической группы, который используют в случаях, когда они содержатся в сложных смесях и в биоматериалах или при наличии ионов аммония, которые препятствуют выявлению катионов К+ и Na+. Ход анализ приведен на схеме.
Систематический анализ смеси катионов первой аналитической группы
Неизвестный раствор :К+, Na+, NH4
Проба на наличие катионов NH4+
(действие реактива Несслера, реакция 8)
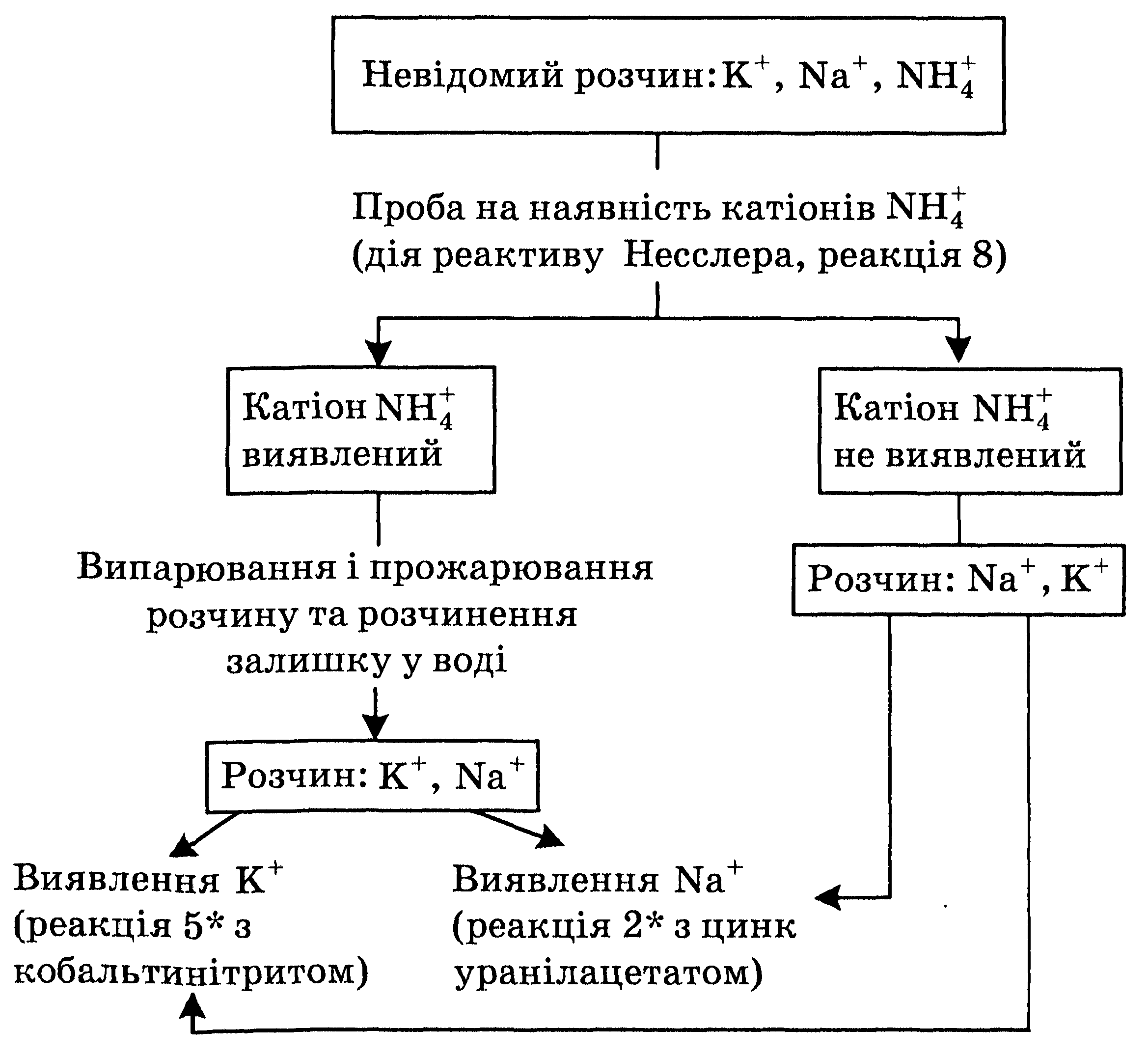
1. Проба на наличие катионов NH4+
Поскольку ионы аммония препятствуют определению ионов К+ и Na+ , в исследуемом растворе проводят пробу на наличие солей аммония. Для их определения отбирают несколько капель исследуемого раствора и добавляют 3-4 капли раствора реактива Несслера. Появление бурого осадка свидетельствует о наличии в растворе солей аммония.
Эту пробу выполняют и другим способом. В пробирку вносят 3-4 капли исследуемого раствора, добавляют 4-5 капель 2М раствора щелочи и нагревают на слабом пламени газовой горелки до кипения. Выделение аммиака свидетельствует о наличии солей аммония. Аммиак можно обнаруживают по запаху или по посинению влажной лакмусовой бумажки.
В случае, если катионы аммония не обнаружены реакциями, описанными в п. 1, то выполняют качественные реакции определения ионов Na+ и К+ (см. п. 3).
Отделение ионов аммония
Если в растворе обнаружены соли аммония, их нужно отделить. Для этого весь исследуемый раствор переливают в фарфоровую чашку, осторожно выпаривают досуха и прокаливают на песчаной бане до полного удаления солей аммония. Для проверки полноты удаления этих солей берут несколько кристаллов сухого остатка, переносят в пробирку, добавляют несколько капель воды и 1-2 капле реактива Несслера. Если наблюдается образование бурого осадка, это свидетельствует о том, что соли аммония полностью не удалены. В таком случае раствор прокаливают ещё раз. После завершения процесса удаления солей аммония остаток охлаждают и растворяют в дистиллированной воде.
Определение катионов Натрия и Калия
В отдельных порциях раствора проводят качественные реакции на наличие ионов Натрия (реакцией 2* с цинк уранилацетатом) и пробу на наличие катионов К+ (реакцией 5* с кобальтинитритом).
Результаты анализа и уравнения реакций, которые в процессе анализа оказались положительными, записывают в протокол и делают вывод о наличии в исследуемом растворе тех или иных катионов первой аналитической группы.
Раздел 10 вторая аналитическая группа катионов
10.1. Общая характеристика группы и биологическая роль катионов
К второй аналитической группе относятся катионы Ag+, Hg22+ и Pb2+. Групповым реактивом является хлоридная кислота, которая образовывает с перечисленными катионами нерастворимые в воде и кислотах хлориды: AgCl, РЬС12 и Hg2Cl2. Катионы II аналитической группы можно выделить из смеси других катионов с помощью хлоридной кислоты.
Хлориды катионов этой аналитической группы характеризуются разной растворимостью в воде. Наибольшую растворимость имеет РЬС12 (11,0 г/л при температуры 20 °С), наименьшую — Hg2Cl2 (2·10-4 г/л). Причем растворимость этих солей неодинаково зависит от температуры. При температуре 100 °С растворимость РЬС12 увеличивается в 3 раза, тогда как растворимость других хлоридов практически не изменяется. Эту закономерность используют в ходе систематического анализа, для того чтобы отделить катионы РЬ2+ от катионов Ag+ и Hg22+.
Аргентум и Меркурий принадлежат к d-элементам IB и ІІВ группы ПСЕ, Плюмбум p-элемент IVA группы. Радиусы атомов элементов побочных подгрупп І и II групп почти вдвое меньше радиусов атомов элементов главных подгрупп. Этим объясняют большие значения их потенциалов ионизации и значительно более слабые восстановительные свойства. В химическом отношении Аргентум и Меркурий являются малоактивными металлами, которые находятся в ряде стандартных электродных потенциалов после Гидрогена.
В связи с наличием в атомах этих элементов свободных атомных орбиталей они способны образовывать комплексные соединения, что и используют для их открытия. Например, для катиона Ag+ характерны соединения как с комплексным катионом, так и с комплексным анионом — [Ag(NH3)2]+, [Ag(CN)2]-, ион Hg22+ легко образовывает КС с комплексным анионом, в частности полигалогениды типа [HgІ4]2-.
Из соединений Аргентума хорошо растворим в воде нитрат AgNО3, который используют для посеребрения разных предметов, изготовление фотоматериалов, а в медицинской практике — как антисептическое средство. Бактерицидные свойства ионов Ag+ используют для обеззараживания питьевой воды, изготовления бактерицидной ваты и марли.
Биологическую роль соединений Меркурия и Плюмбума до конца не выяснена. Доказано, что в малых дозах соединения Меркурия повышают фагоцитарную активность лейкоцитов, влияют на процесс кровообразования. Ионы Плюмбума входят в состав трубчатых костей, накапливаются в печени. В медицине используют каломель — меркурий(І) хлорид Hg2Cl2 как послабливающее и желчегонное средство. Ртуть и растворимые соли Меркурия отравляющие вещества, поскольку блокируют действие многих ферментных систем. Токсичными являются также соединения Плюмбума, которые служат причиной хронические отравлений (сатурнизм). Особо опасны его органические производные, в частности тетраэтилсвинец, который добавляют к разным сортам бензина для улучшения его детонационных свойств.
10.2. Качественные реакции катионов Ag+, Hg22+ и Pb2+
Реакции катионов Аргентуму Ag+
1*. Реакция с групповым реактивом. Хлоридная кислота НС1 и ее растворимые соли (NaCl, КС1 и т.п.) осаживают из растворов солей Аргентума белый творожный осадок AgCl:
Ag+ + Cl- = AgCl↓.
Осадок не растворяется в сильных кислотах, но хорошо растворяется в избытке раствора аммоний гидроксида с образованием бесцветной комплексной соли диаминаргентум хлорида:
AgCl + 2NH3 = [Ag(NH3)2]CI.
При подкислении полученного раствора нитратной кислотой комплексная соль разрушается и снова выпадает белый осадок:
[Ag(NH3)2]CI + 2HNO3 = AgCl↓ +2NH4NO3.
Выполнение. В пробирку вносят 2-3 капли раствора соли Аргентума и добавляют такой же объем хлоридной кислоты. Наблюдают образование белого осадка аргентум хлорида. К раствору с осадком добавляют концентрированный раствор аммиака осадок растворяется. Если к образованному раствору добавить 5-6 капель концентрированной HNO3, то наблюдается выпадение осадка.
Реакция "серебряного зеркала". При наличии восстановителей, например формальдегида, глюкозы и т.п., ионы Аргентума восстанавливаются до металлического серебра по схеме
Ag2О + НСОН → 2Ag + НСООН.
Выполнение. В чистую пробирку вносят 3-5 капель раствора аргентум нитрата и столько же концентрированного раствора NH4OH. Добавляют несколько капель раствора формальдегида и нагревают пробирку на водяной бане. Наблюдают образование на стенках пробирки блестящей пленки металлического серебра.
Реакция с калий йодидом. Соли иодидной кислоты образовывают с ионами Ag+ светло-желтый осадок аргентум йодида, не растворимый в кислотах и в растворе аммиака (в отличие от AgCl):
Ag+ + I =AgI↓.
Выполнение. К 4-5 капель раствора соли Аргентума добавляют равный объем раствора калий йодида. К образованному осадку добавляют избыток раствора натрий тиосульфата и перемешивают. Наблюдают растворение осадка, который объясняется образованием комплексного соединения по уравнению реакции:
AgI(T) + 2Na2S2O3 = Na3[ Ag(S2O3)2] + NaІ.
4. Реакция с калий хроматом. Растворимые соли хроматной кислоты выделяют из растворов солей Аргентума кирпично-красный осадок аргентум хромата, растворимый в нитратной кислоте и в растворе аммоний гидроксида:
2Ag+ + CrO42- = Ag2CrO4↓.
Выполнение. В пробирку вносят 2-3 капли раствора соли Аргентума и добавляют такой же объем калий хромата. Наблюдают образование осадка.
5. Реакция с гидроксидами щелочных металлов. Едкие щелочи осаживают из растворов солей Аргентума бурый осадок аргентум оксида Ag2О по реакции
2Ag+ + 2ОН- = Ag2О ↓ + Н2О.
Выполнение. К 2-3 капель раствора соли Аргентума доливают такой же объем раствора щелочи и наблюдают образование осадка.
Реакции катионов Меркурия(І) Hg2+
Реакция с групповым реактивом. Хлоридная кислота или ее растворимые соли осаживают из растворов солей Hg(I) белый осадок Hg2Cl2 (каломель):
Hg22+ + 2Cl- = Hg2Cl2↓.
Выполнение. К 4-5 капель раствора меркурий(І) нитрата добавляют такое же количество хлоридной кислоты и наблюдают образование осадка. К образованному осадку доливают концентрированный раствор аммиака и наблюдают его почернение, которое объясняется образованием мелкодисперсной металлической ртути:
Hg2Cl2 + 2NH4OH = [Hg2NH2]Cl↓ + NH4C1 + 2H2О;
[Hg2NH2]C1(T) → NH2HgCl↓ + Hg↓.
Реакцию с хлоридами и гидроксидом аммония можно использовать как дробную.
Реакция с аммоний гидроксидом. Раствор аммиака выделяет из солей Hg(I) черный осадок мелкодисперсной металлической ртути. Кроме того, образовывается белый осадок комплексной соли, который маскируется черным цветом металлической ртути:
Hg2(NО3)2 + 2NH4OH = NH2HgNО3↓ + Hg↓ + NH4NО3 + 2Н2О.
Выполнение. К 4-5 капель раствора, который содержит ионы Hg22+, добавляют раствор аммоний гидроксида. Наблюдают образование осадка.
Реакция с гидроксидами щелочных металлов. Едкие щелочи КОН или NaOH выделяют из растворов солей Hg(I) черный осадок соответствующего оксида:
Нg22++2ОН- = Hg2О↓ + Н2О.
Выполнение. К 4-5 капель раствора, который содержит ионы Нg22+, добавляют раствор щелочи. Наблюдают образование осадка.
Реакция с калий йодидом. Соли йодидной кислоты осаживают из растворов солей Hg(I) йодид меркурия(І) темно-зеленого цвета:
Нg22+ + 2I-=Hg2I2↓.
Осадок растворяется в избытке реактива с образованием тетрайодомеркурат(ІІ)-иона и черного осадка металлической ртути:
Hg2I2(T)+2І- = [HgІ4]2- + Hg↓.
Выполнение. К 4-5 капель раствора, который содержит ионы Hg22+, добавляют раствор калий йодида. К образованному осадку доливают избыток реактива и наблюдают образование черного осадка.
10*. Реакция с медью или станум(ІІ) хлоридом. Соли двухвалентного Станума или металлическая медь восстанавливают катионы Hg(I) до свободного металла:
Нg22+ + Sn2+ = Sn4+ + 2Нg↓;
Нg22+ + Cu(t) = Cu2+ + 2Hg↓.
Выполнение. К 4-5 капель раствора соли одновалентного Меркурия добавляют такое же количество раствора станум(ІІ) хлорида. Наблюдают выделение темно-серого или черного осадка. Реакцию удобно выполнять капельным методом. Для этого на фильтровальную бумагу наносят каплю раствора, который содержит ионы Hg(I), и добавляют каплю реактива. На бумаге появляется черное пятно.
Если раствор соли Меркурия(І) нанести на очищенную медную пластинку или бронзовую монету, то через 2-3 минуты они покроются серым налётом амальгамы ртути, который после натирания шерстяной тканью становится блестящим.
Реакции катионов Плюмбуму Рb2+
11. Реакция с групповым реактивом. Хлоридная кислота или ее растворимые соли образовывают с катионами Плюмбума белый осадок плюмбум хлорида РbС12:
Рb2+ + 2Сl- = РbС12↓.
Осадок РbС12 растворяется в горячей воде, который используют в систематическом анализе катионов для отделения его от других хлоридов этой аналитической группы.
Выполнение. В пробирку вносят 2-3 капли раствора соли Плюмбума и добавляют 2 капли хлоридной кислоты. К раствору с осадком доливают 1 мл дистиллированной воды, нагревают смесь на водяной бане и снова охлаждают под струей водопроводной воды. Наблюдают растворение осадка и повторное его образование при охлаждении.
12. Реакция с гидроксидами щелочных металлов. Гидроксиди натрия или калия с катионами РЬ2+ образовывают белый осадок плюмбум гідроксиду Рb(ОН)2:
Рb2+ + 2ОН- = Рb(ОН)2↓.
Образованный осадок имеет амфотерные свойства и поэтому хорошо растворяется как в кислотах, так и в щелочах:
Рb(ОН)2(т) + 2Н+ =Рb2+ + 2Н2O;
Рb(ОН)2(т) + 2OН- =[Рb(ОН)4]2-.
Выполнение. К 4-5 капель раствора соли Плюмбума медленно добавляют раствор щелочи до образования белого осадка. Осадок разделяют на две части. Одну часть исследуют на растворение в нитратной кислоте, другу - в избытке щелочи.
13*. Реакция с калий йодидом. Калий йодид образовывает с солями Плюмбума осадок РЬІ2 желтого цвета. Осадок растворяется в избытке реактива с образованием бесцветного комплексного соединения К2[РЬІ4]:
Рb2+ + 2І- = РbІ2↓;
РbІ2(т) + 2І- = [РbІ4]2-.
Выполнение. К 4-5 капель раствора соли Плюмбума медленно добавляют раствор калий йодида до образования осадка РЬІ2, который растворяется в горячей воде и снова образовывается при охлаждении в виде золотисто-жовтих кристаллов. Если к осадку добавить избыток КІ, он полностью растворится.
14. Реакция с натрий сульфидом. Натрий сульфид при добавлении к раствору солей Плюмбума(ІІ) осаждает плюмбум сульфид черного цвета:
Pb2+ + S2-=PbS↓
Выполнение. К 4-5 капель раствора соли Плюмбума добавляют несколько капель натрий сульфида. Наблюдают образование осадка, который подвергают испытанию на растворимость в воде и кислотах.
Плюмбум сульфид не растворяется в разбавленных минеральных кислотах, едких щелочах, а растворяется только в HNO3, в частности, в разбавленной нитратной кислоте при нагревании реакция происходит по уравнению
ЗPb(T) + 8HNO3 = 3Pb(NO3)2 + 2NO + 3S↓ + 4Н2O.
15*. Реакция с калий хроматом. Калий хромат выделяет из растворов солей РЬ(ІІ) желтый осадок плюмбум хромата:
Рb2+ + СrО42- = РbСrО4↓.
Выполнение. К 4-5 капель растворимой соли Плюмбума добавляют несколько капель раствора ацетатной кислоты и калий хромата. Исследуют растворимость образованного осадка РbСrО4 в щелочах, в которых он растворяется по уравнению:
PbCrО4 + 4OH- =PbО22- + CrО42- + 2H2O.
Кроме того, осадок растворяется в нитратной, но не растворяется в ацетатной кислоте.
