
- •Раздел 8
- •8.2. Аналитические реакции и их характеристика
- •8.3. Аналитическая классификация катионов
- •Раздел 9 первая аналитическая группа катионов
- •9.1. Общая характеристика группы
- •9.4. Систематический анализ смеси катионов первой аналитической группы
- •Отделение ионов аммония
- •Определение катионов Натрия и Калия
- •Раздел 10 вторая аналитическая группа катионов
- •10.1. Общая характеристика группы и биологическая роль катионов
- •10.3. Систематический анализ смеси катионов второй аналитической группы
- •1. Осаждение катионов второй аналитической группы
- •2 Исследование осадка
- •Раздел 11 третья аналитическая группа катионов
- •11.1. Общая характеристика группы
- •11.2. Биологическая роль и медицинское применение соединений
- •10. Реакция с групповым реактивом (сульфатной кислотой).
- •11.4. Систематический анализ смеси катионов третьей аналитической группы
- •Осаждение катионов в виде сульфатов
- •Превращение сульфатов катионов III группы в карбонаты
- •Разделение катионов и их определение
- •Раздел 12 четвертая аналитическая группа катионов
- •12.1. Общая характеристика группы
- •12.2. Биологическая роль и значение соединений катионов IV группы для медицины
- •14. Реакция с окислителями или восстановителями.
- •12.4. Систематический анализ смеси катионов четвертой аналитической группы
- •1. Действие группового реактива
- •2 Отделение катионов Алюминия
- •3 Анализ центрифугата
- •Раздел 13 пятая аналитическая группа катионов
- •13.1. Общая характеристика группы
- •13.2. Биологическая роль и медицинское применение соединений
- •13.4. Анализ смеси катионов пятой аналитической группы
- •1. Предыдущие испытания
- •2. Осаждение катионов V группы
- •4. Обнаружение катионов Мангана(іі)
- •Раздел 14 шестая аналитическая группа катионов
- •14.1. Общая характеристика группы
- •14.2. Биологическая роль и значения соединений катионов VI аналитической группы для медицины
- •14.4. Анализ смеси катионов шестой аналитической группы дробним методом
- •14.5. Систематический анализ смеси катионов шестой аналитической группы
- •1. Разделение катионов
- •2. Анализ центрифугата
- •Систематический анализ смеси катионов шестой аналитической группы
- •Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
- •16.1. Первая аналитическая группа анионов
- •16.1.1. Общая характеристика группы
- •16.1.2. Биологическая роль и медицинское применение соединений
- •16.1.3. Качественные реакции анионов so42-, so32-, ро43-, со32-, с2о42-, с4н4o62-, нс6н5o72-
- •Реакции сульфитов-ионов so32-
- •Реакции фосфат-ионов ро43-
- •Реакции карбонат-ионов co32-
- •Реакции оксалат-ионов с2о42-
- •13. Реакция с групповым реактивом ВаС12. Барий хлорид образует с анионами с2о42- белый осадок барий оксалата:
- •Реакции тартрат-ионов с4н4о62-
- •Реакции цитрат-ионов нс6н5о72-
- •16.2. Вторая аналитическая группа анионов
- •16.2.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.2.2. Качественные реакции анионов Сl-, Br-, і-, s2-, с6н5соо- Реакции хлорид-ионов Сl-
- •Реакции бромид-иоиов Вr-
- •Реакции йодид-ионов I-
- •Реакции сульфид-ионов s2-
- •Реакции бензоат-ионов с6н5соо-
- •16,3. Третья аналитическая группа анионов
- •16.3.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.3.2. Качественные реакции анионов no2-, no3-, МnО4-, сн3соо-, с6н4(он)соо- Реакции нитрит-ионов no2-
- •Реакции нитрат-ионов no3-
- •Реакции перманганат-ионов МnО4-
- •Реакции ацетат-ионов сн3соо-
- •Реакции салицилат-ионов с6н4(он)соо-
9.1. Общая характеристика группы
По кислотно-основной классификации все катионы разделяют на шесть аналитических групп. К первой аналитической группе принадлежат катионы s1 -элементов — Na+, К+, Li+, а также катион аммония NH4+. По всем известным аналитическим классификациям (сульфидной, аммиачно-фосфатной) перечисленные катионы принадлежат к первой аналитической группе, как не имеющие группового реактива.
Аналитическая классификация катионов основывается на химических свойствах соединений и тесно связанная с положением элемента в периодической системе элементов Д. Менделеева (ПСЕ), строением атомов соответствующих элементов и их физико-химическими характеристиками. Химические элементы, катионы которых входят в первую аналитическую группу, размещенные в ІА группе ПСЕ. При образовании катионов они легко отдают по одном электрону, образовывая электронную структуру инертного газа, например:
+11Na 1s22s22р63s1 = [Ne]3s 1-1e → [Ne]3s° ,
Na – e- → Na+.
Отдавая электроны, атомы s1-элементов обладают сильными восстановительными свойствами. Это подтверждается отрицательными значениями окислительно-восстановительных потенциалов в пределах 3,0-2,7 В. Вследствие потери электронов атомы становятся катионами, которые с большинством неметаллов образовывают ионные соединения, которые хорошо растворяются в воде. Катионы первой аналитической группы характеризуются низкими значениями относительных электроотрицательностей и малыми ионными радиусами.
Кислотно-основные свойства оксидов этих элементов четко выраженны, поскольку им соответствуют сильные основания — NaOH, КОН, которые называются щелочами. Аммиак при растворении в воде образовывает гидрат NH3·H2O, который частично превращается в аммоний гидроксид NH4OH — слабое основание с константой диссоциации 1,8 10-5. При взаимодействии NH4OH с кислотами образовываются соли.
Катион аммония NH4 также отнесено к первой аналитической группе катионов, поскольку он образовывает хорошо растворимые в воде соли, как и ионы щелочных металлов. При нагревании эти соли легко раскладываются, а продукты их разложения испаряются, например:
NH4C1 = NH3 + НС1;
NH4NO3 = N2O + 2 2O ;
(NH4)2СO3 = 2 NH3 + СO2 + Н2О;
(NH4)2SO4 = 2NH3 + Н2SO4.
Пользуясь этим свойством, соли аммония можно полностью удалить из смеси других неорганических веществ.
Для ионов Na+ и К+ реакции комплексообразования практически не характерны. В водных растворах они образовывают неустойчивые аквакомплекси наподобные [Na(H2О)n]+, [K(H2О)n]+ , гдe n — координационное число, которое равняется 4, 6 для Na+ и 6, 8 для К+ . Большее значение координационного числа иона К+ связано с его ионным радиусом: радиус иона Na+ равняется 0,098 нм, а К+ — 0,133 нм. Эти отличия особенно сказываются в роли, которую играют ионы Натрия и Калия в биологических системах.
9.2. Биологическая роль и медицинское применение соединений
В организме человека и животных ионы Натрия и Калия содержатся в макроколичествах и потому являются жизненно необходимыми. Массовая доля Натрия в организме составляет 0,15, Калия — 0,35 %. Основная биологическая роль этих ионов состоит в поддержании водно-электролитного баланса, осмотичного давления, кислотности среды биожидкостей. Катионы s1-элементов необходимые для генерирования биопотенциалов в нервной системе и регулирования работы сердечной мышцы. Если катион Na+ является основным внеклеточным, то К+ — внутриклеточным ионом, это предопределяет возникновение биопотенциалов в клетках.
Натрий хлорид (кухонная соль), который постоянно поступает в организм с пищей, является источником хлоридной (соляной) кислоты для образования желудочного сока, а натрий гидрогенкарбонат NaHCO3 — важным компонентом буферной смеси, которая поддерживает кислотно-основной баланс некоторых биожидкостей. Тиосульфат натрия Na2S2О3 применяют при отравлении солями тяжелых металлов. Из препаратов Калия, которые применяют в медицине, следует отметить калий бромид КВr (успокоительное средство), калий ацетат СН3СООК (мочегонный препарат при отеках), калий йодид КІ — для лечения зобу и катаракты и калий оротат — в комплексной терапии сердечных заболеваний.
Поскольку Нітроген входит в состав молекул значительного количества органических соединений — биогенных аминов, белков, нуклеотидов, гемоглобина, витаминов, а конечными продуктами обмена этих веществ является мочевина и мочевая кислота, то определение катионов аммония в биожидкостях имеет большое значение для диагностики и лечения многих заболеваний.
9.3. Качественные реакции катионов Na+, К+, HN4+
Реакции катионов Натрия Na+
1*. Реакция с калий дигидрогенстибиатом KH2SbО4 или с калий гексагидроксостибиатом(V) К[Sb(ОН)6] *. Калий дигидрогенстибиат KH2SbО4 в нейтральной среде образовывает с ионами Натрия белый кристаллический осадок натрий дигідрогенстибіату:
Na+ + H2SbО4- =Na2H2SbО4↓,
а калий гексагидроксостибиат(V) – осадок натрий гексагидроксостибиата(V) по уравнению
Na+ + [Sb(OH)6]- = Na[Sb(ВОН)6]↓
Выполнение. В пробирку вносят 4-5 капель раствора соли Натрия и такой же объем реактива. Реакцию выполняют при охлаждении и потирании стенок пробирки стеклянной палочкой. Исследуемый раствор не должен содержать свободных кислот, поскольку они взаимодействуют с этим реактивом, а также солей аммония. Эту реакцию используют для осаждения ионов Na+ из крови (чувствительность — 50 мкг).
2*. Реакция с цинк уранилацетатом Zn(U02)3 (СН3СОО)8. Цинк уранилацетат в растворе ацетатной кислоты образовывает с ионами Натрия желтый кристаллический осадок за уравнением
Na+ + Zn(U02)3(СН3СОО)8 + СН3СОО- + 9Н2O = NaZn(UO2)3(СН3СОО)9·9Н2O↓.
Реакция является специфической и довольно чувствительной (2,5 мкг), аналогичную реакцию дают ионы Li+.
Выполнение. На предметное стекло наносят несколько капель соли Натрия, выпаривают к сухому остатку и добавляют каплю реактива. Через несколько минут рассматривают образованные кристаллы под микроскопом. Они имеют вид желто-зеленых тетраэдров и октаедров (рис. 9.1).
* Звездочкой обозначены аналитические реакции, рекомендованные Государственной Фармакопеей Украины (ДФУ).
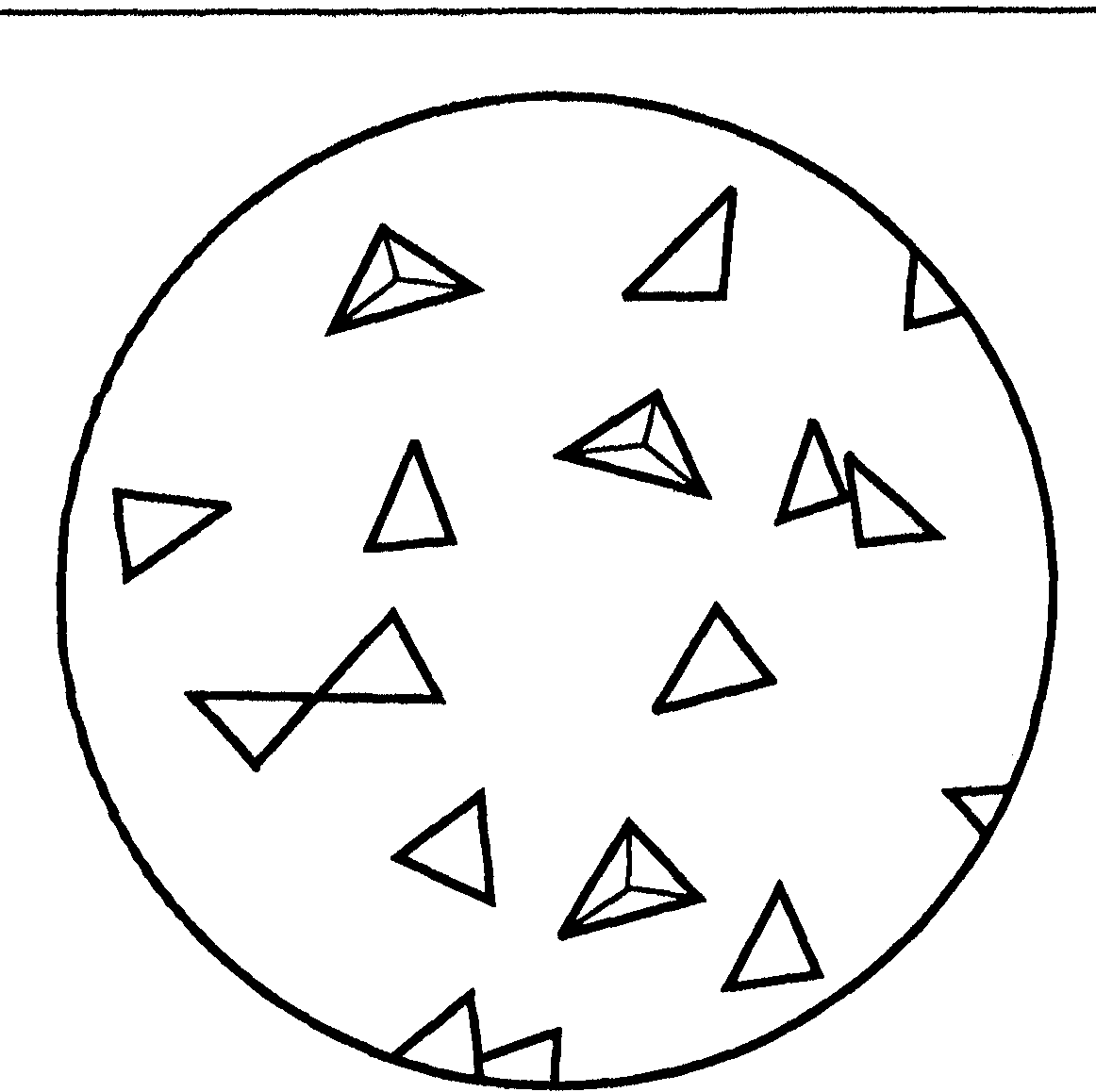
Рис. 9.1. Форма кристаллов натрий-цинк уранилацетату
Для выполнения реакции полумикрометодом берут 4-5 капель раствора соли Натрия, добавляют 5-6 капель раствора реактива и потирают об стенки пробирки стеклянной палочкой при охлаждении раствора в струе воды. Выпадение кристаллического зеленовато-жолтого осадка свидетельствует о наличии ионов Натрия.
6*. Окраска пламени. Соли Натрия окрашивают пламя газовой горелки в желтый цвет. Проба на окраску пламени характеризуется высокой чувствительностью.
Выполнение. Опыт выполняют, внося крупинки соли на металлической проволоке в пламя горелки, или берут на кончик платиновой проволоки каплю раствора соли Натрия, вносят в бесцветное пламя газовой горелки и наблюдают появление желтой окраски, которое должно сохраняться в течение 25-30 с.
Реакции катионов Калия К+
4*. Реакция с натрий гидрогентартратом NaHC4H406. Натрий гидрогентартрат NaHC4H406 образовывает с ионами Калия белый кристаллический осадок калий гидрогентартрата:
К++НС4Н4О- = КНС4Н4О6↓.
Выполнение. В пробирку вносят 4-5 капель раствора соли Калия и столько же раствора реактива. Раствор охлаждают и потирают об внутренние стенки пробирки стеклянной палочкой для ускорения образования осадка. Среда должна быть нейтральной или слабокислотной. Чувствительность реакции — 50 мкг, предельное разбавление 1:1000. Катионы NH4+ препятствуют определению, поэтому их удаляют прокаливанием пробы (см. розд. 9.4, п. 2).
5*. Реакция с натрий кобальтинитритом. Комплексное соединение Na3[Co(NО2)6], которую называют натрий гексанитрокобальтатом(ІІІ), или кобальтинитритом, в нейтральной среде образовывает с ионами Калия желтый кристаллический осадок калий-натрий кобальтинитрита:
2К+ + Na+ + [Co(NО2)6 ]3- = K2Na[Co(NО2)6 ]↓.
Эта реакция характеризуется большей чувствительностью, чем предыдущая. Ее используют в клинических лабораториях для осаждения ионов К+ из сыворотки крови.
Выполнение. Реакцию можно выполнить в пробирке или на пластинке, добавляя к 3-4 капле соли Калия и несколько капель реактива. Если осадок не выпадает сразу, нужно дать смеси немного постоять.
6*. Окраска пламени. Соли Калия при внесении в пламя газовой горелки окрашивают его в фиолетовый цвет.
Выполнение. На кончике платиновой поволоки вносят каплю соли Калия в пламя газовой горелки и наблюдают за окраской пламени. Даже следы соединений Натрия маскируют фиолетовую окраску ионов Калия. Поэтому его окраску нужно наблюдать сквозь синее кобальтовое стекло, которое задерживает желтые лучи Натрия.
Реакции катионов аммония NH4+
7*. Реакция с гидроксидами щелочных металлов. Сильные основания NаОН, КОН при нагревании выделяют из растворов солей аммония газообразный аммиак, который можно определить по характерному запаху или с помощью кислотно-основних индикаторов:
NH4+ + ОН- = NH3 + Н2О.
Реакция со щелочами очень чувствительная (0,01 мкг) и дает возможность определить ионы аммония при наличии других катионов.
Выполнение. В пробирку вносят несколько капель раствора аммония и добавляют 3-4 капли 2М раствора щелочи. К отверстию пробирки подносят смоченную водой красную лакмусовую бумажку и нагревают пробирку. Наблюдают посинение лакмусовой бумажки, поскольку аммиак, который выделяется, соединяясь с водой, образовывает аммоний гидроксид:
NH3 + H2O = NH4OH,
который окрашивает лакмусовая бумажка в синий цвет.
8. Действие реактива Несслера. Реактив Несслера — это смесь комплексной соли Меркурию K2[HgI4] с КОН (см. розд. 14). Он образовывает с солями аммония бурый осадок по уравнению
NH4+ + 2[HgI4]2- + 2ОН- = [Hg2I2NH2]I↓ + 5I- + 2Н2O.
В молекулярном виде это уравнение записывают так:
NH4C1+ 2К2[HgI4] + 2КОН = [Hg2I2NH2]І↓ + 5КІ + КС1+2Н2O.
Структуру образованного комплексного соединения можно изобразить так:
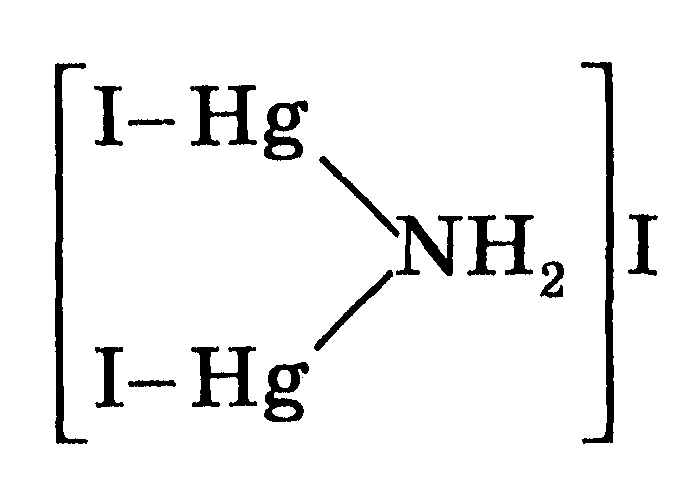
Реакция характеризуется высокой чувствительностью (0,25 мкг), поэтому ее используют для проверки полноты выделения аммиака из реакционной смеси, в биохимическом анализе - для определения остаточного Нитрогена в крови, а в санитарии - для анализа сточных вод, пищевых продуктов и т.п..
Выполнение. К 1-2 капель раствора аммонийной соли добавляют 4 капли реактива Несслера и наблюдают образование бурого осадка. Если содержания солей аммония в пробе незначительно (следовые количества) появляется желтая окраска.
