
- •Раздел 8
- •8.2. Аналитические реакции и их характеристика
- •8.3. Аналитическая классификация катионов
- •Раздел 9 первая аналитическая группа катионов
- •9.1. Общая характеристика группы
- •9.4. Систематический анализ смеси катионов первой аналитической группы
- •Отделение ионов аммония
- •Определение катионов Натрия и Калия
- •Раздел 10 вторая аналитическая группа катионов
- •10.1. Общая характеристика группы и биологическая роль катионов
- •10.3. Систематический анализ смеси катионов второй аналитической группы
- •1. Осаждение катионов второй аналитической группы
- •2 Исследование осадка
- •Раздел 11 третья аналитическая группа катионов
- •11.1. Общая характеристика группы
- •11.2. Биологическая роль и медицинское применение соединений
- •10. Реакция с групповым реактивом (сульфатной кислотой).
- •11.4. Систематический анализ смеси катионов третьей аналитической группы
- •Осаждение катионов в виде сульфатов
- •Превращение сульфатов катионов III группы в карбонаты
- •Разделение катионов и их определение
- •Раздел 12 четвертая аналитическая группа катионов
- •12.1. Общая характеристика группы
- •12.2. Биологическая роль и значение соединений катионов IV группы для медицины
- •14. Реакция с окислителями или восстановителями.
- •12.4. Систематический анализ смеси катионов четвертой аналитической группы
- •1. Действие группового реактива
- •2 Отделение катионов Алюминия
- •3 Анализ центрифугата
- •Раздел 13 пятая аналитическая группа катионов
- •13.1. Общая характеристика группы
- •13.2. Биологическая роль и медицинское применение соединений
- •13.4. Анализ смеси катионов пятой аналитической группы
- •1. Предыдущие испытания
- •2. Осаждение катионов V группы
- •4. Обнаружение катионов Мангана(іі)
- •Раздел 14 шестая аналитическая группа катионов
- •14.1. Общая характеристика группы
- •14.2. Биологическая роль и значения соединений катионов VI аналитической группы для медицины
- •14.4. Анализ смеси катионов шестой аналитической группы дробним методом
- •14.5. Систематический анализ смеси катионов шестой аналитической группы
- •1. Разделение катионов
- •2. Анализ центрифугата
- •Систематический анализ смеси катионов шестой аналитической группы
- •Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
- •16.1. Первая аналитическая группа анионов
- •16.1.1. Общая характеристика группы
- •16.1.2. Биологическая роль и медицинское применение соединений
- •16.1.3. Качественные реакции анионов so42-, so32-, ро43-, со32-, с2о42-, с4н4o62-, нс6н5o72-
- •Реакции сульфитов-ионов so32-
- •Реакции фосфат-ионов ро43-
- •Реакции карбонат-ионов co32-
- •Реакции оксалат-ионов с2о42-
- •13. Реакция с групповым реактивом ВаС12. Барий хлорид образует с анионами с2о42- белый осадок барий оксалата:
- •Реакции тартрат-ионов с4н4о62-
- •Реакции цитрат-ионов нс6н5о72-
- •16.2. Вторая аналитическая группа анионов
- •16.2.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.2.2. Качественные реакции анионов Сl-, Br-, і-, s2-, с6н5соо- Реакции хлорид-ионов Сl-
- •Реакции бромид-иоиов Вr-
- •Реакции йодид-ионов I-
- •Реакции сульфид-ионов s2-
- •Реакции бензоат-ионов с6н5соо-
- •16,3. Третья аналитическая группа анионов
- •16.3.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.3.2. Качественные реакции анионов no2-, no3-, МnО4-, сн3соо-, с6н4(он)соо- Реакции нитрит-ионов no2-
- •Реакции нитрат-ионов no3-
- •Реакции перманганат-ионов МnО4-
- •Реакции ацетат-ионов сн3соо-
- •Реакции салицилат-ионов с6н4(он)соо-
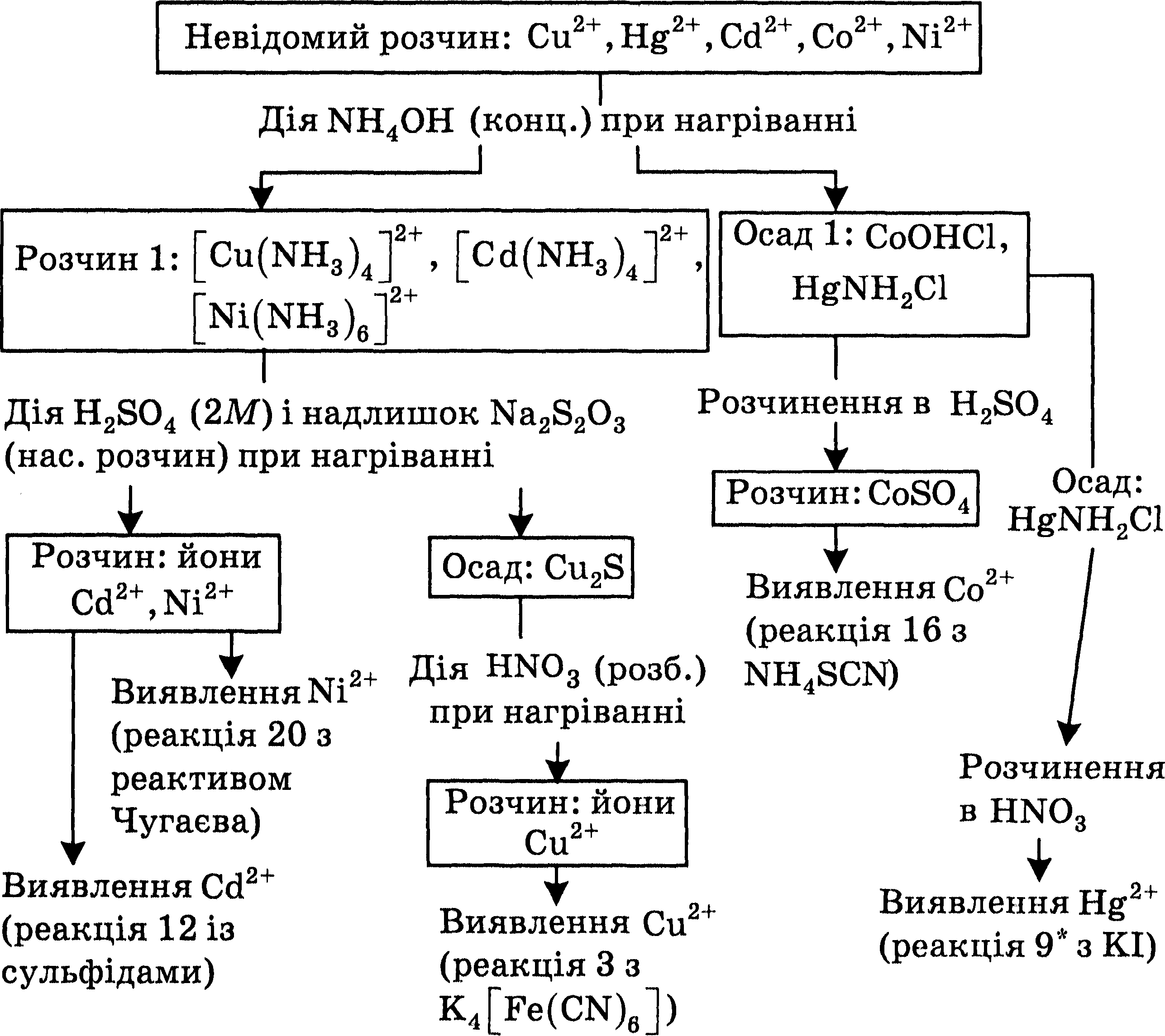
14.4. Анализ смеси катионов шестой аналитической группы дробним методом
Катионы, которые входят в состав шестой аналитической группы, можно обнаружить дробными реакциями в отдельных пробах исследуемого раствора.
Обнаружене катионов Сu2+ проводят с концентрированным раствором аммоний гидроксида по реакцией 1* или с желтой кровяной солью (реакция 3). Если окраска раствора недостаточно характерная, выполняют контрольную реакцию с раствором щелочи и образованный осадок нагревают. При наличии катионов Сu2+ осадок чернеет (см. реакцию 2).
Ионы Hg2+ обнаруживают с помощью реакции 9* с калий йодидом или реакцией 10 со станум(ІІ) хлоридом, Кадмий можно идентифицировать по реакции 14 с дитизоном. Катионы Со2+ легко определить реакцией 16 с аммоний тиоцианатом, a Ni2+ - реакцией 20 с диацетилдиоксимом (реактивом Чугаева).
14.5. Систематический анализ смеси катионов шестой аналитической группы
1. Разделение катионов
К 2-3 мл исследуемого раствора, содержащего катионы шестой группы, добавляют концентрированный раствор аммоний гидроксида до щелочной реакции, смесь перемешивают (см. схему). При этом катионы Купрума, Никеля и Кадмия будут находиться в растворе (1) в виде комплексных аммиакатов, а в осадке (1) будет меркурий амидохлорид и основная соль Кобальта. Осадок отделяют от раствора центрифугуванием.
2. Анализ центрифугата
К полученному после центрифугирования раствору (1) добавляют сульфатную кислоту, избыток насыщенного раствора натрий тиосульфата и смесь нагревают. В осадок выпадает купрум сульфид, который растворяют в нитратной кислоте при нагревании. В полученном растворе определяют ионы Сu2+ с помощью качественной реакции с К4[Fe(CN)6]. Ионы Кадмия обнаруживают в растворе реакцией 12 с сероводородом или сульфидом аммония, а ионы Никеля - реакцией 20 с диацетиглиоксимом.
3. Анализ осадка (1) на содержание катионов Со2+ и Hg2+
К осадку (1) добавляют раствор сульфатной кислоты и перемешивают; основная соль Кобальта СоOHCl растворяется, в полученном растворе определяют ионы Кобальта реакцией 16 с аммоний тиоцианатом.
Не растворенный в H2SО4 меркурий амидохлорид HgNH2Cl переводят в раствор с помощью нитратной кислоты и обнаруживают в нем ионы Hg2+ действием калий йодида (реакция 9*) или станум(ІІ) хлорида (реакция 10).
Систематический анализ смеси катионов шестой аналитической группы
Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
В основу деления анионов на аналитические группы положена разная растворимость в воде солей, которые они образовывают с ионами Бария и Аргентума. По этой классификации все анионы разделяют на три аналитических группы.
К первой группе анионов принадлежат: сульфаты-ионы SO42-, фосфаты-ионы РO43- , карбонаты-ионы СО32-, сульфиты-ионы SO32-, силикат-ионы SiО32-, оксалат-ионы С2O42- , тиосульфат-ионы S2O32-, хромат-ионы СrО42-, тетраборат-ионы В4O72-, тартрат-ионы С4Н4O62-, цитрат-ионы HC6H5O72-. Все перечисленные анионы с катионами Бария образовывают соли, которые плохо растворяются в воде, но растворяются в разбавленных кислотах, за исключением BaSO4. Групповым реактивом является барий хлорид ВаCl2.
Ко второй группе анионов принадлежат: хлориды-ионы Сl-, бромид- ионы Вr- , йодид-ионы I- , сульфид-ионы S2-, тіоціанат-ионы (роданід-іони) SCN-, бензоат-ионы С6Н5СОО- . Все перечисленные анионы с катионами Аргентума образовывают соли, которые плохо растворяются в воде и разбавленной нитратной кислоте. Групповым реактивом является аргентум нитрат AgNO3 в присутствии нитратной кислоты HNО3.
К третьей группе анионов принадлежат: нитрат-ионы NO3-, нитрит-ионы NO2-, ацетат-ионы СН3СОО-, перманганат-ионы МnО4-, салицилат-ионы СбН4(ОН)СОО- которые не образуют труднорастворимых солей с ионами Бария и Аргентума. Эта группа анионов не имеет группового реактива.
В отличие от анализа катионов для обнаружения анионов используют дробний метод анализа с помощью специфических реакций. Групповые реактивы используют не для разделения групп анионов, а для выявления анионов из той или другой группы. Это значительно облегчает и ускоряет анализ, поскольку в случае отрицательной реакции с групповыми реактивами не нужно обнаруживать в исследуемом растворе анионы этой группы.
Внешний вид осадков многих анионов, полученных с солями Бария и Аргентума, одинаков. Поэтому особое внимание обращают на растворимость этих осадков в кислотах или других реактивах. Растворимым в определенной кислоте считают осадок, полученный из 2-3 капель раствора, который растворяется в нескольких каплях разбавленной кислоты без остатка или с незначительным остатком. Однако если при добавлении 10 капель кислоты (или другого реактива) растворение не происходит или не происходит заметного просветления раствора, осадок считают нерастворимым.
