
- •Раздел 8
- •8.2. Аналитические реакции и их характеристика
- •8.3. Аналитическая классификация катионов
- •Раздел 9 первая аналитическая группа катионов
- •9.1. Общая характеристика группы
- •9.4. Систематический анализ смеси катионов первой аналитической группы
- •Отделение ионов аммония
- •Определение катионов Натрия и Калия
- •Раздел 10 вторая аналитическая группа катионов
- •10.1. Общая характеристика группы и биологическая роль катионов
- •10.3. Систематический анализ смеси катионов второй аналитической группы
- •1. Осаждение катионов второй аналитической группы
- •2 Исследование осадка
- •Раздел 11 третья аналитическая группа катионов
- •11.1. Общая характеристика группы
- •11.2. Биологическая роль и медицинское применение соединений
- •10. Реакция с групповым реактивом (сульфатной кислотой).
- •11.4. Систематический анализ смеси катионов третьей аналитической группы
- •Осаждение катионов в виде сульфатов
- •Превращение сульфатов катионов III группы в карбонаты
- •Разделение катионов и их определение
- •Раздел 12 четвертая аналитическая группа катионов
- •12.1. Общая характеристика группы
- •12.2. Биологическая роль и значение соединений катионов IV группы для медицины
- •14. Реакция с окислителями или восстановителями.
- •12.4. Систематический анализ смеси катионов четвертой аналитической группы
- •1. Действие группового реактива
- •2 Отделение катионов Алюминия
- •3 Анализ центрифугата
- •Раздел 13 пятая аналитическая группа катионов
- •13.1. Общая характеристика группы
- •13.2. Биологическая роль и медицинское применение соединений
- •13.4. Анализ смеси катионов пятой аналитической группы
- •1. Предыдущие испытания
- •2. Осаждение катионов V группы
- •4. Обнаружение катионов Мангана(іі)
- •Раздел 14 шестая аналитическая группа катионов
- •14.1. Общая характеристика группы
- •14.2. Биологическая роль и значения соединений катионов VI аналитической группы для медицины
- •14.4. Анализ смеси катионов шестой аналитической группы дробним методом
- •14.5. Систематический анализ смеси катионов шестой аналитической группы
- •1. Разделение катионов
- •2. Анализ центрифугата
- •Систематический анализ смеси катионов шестой аналитической группы
- •Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
- •16.1. Первая аналитическая группа анионов
- •16.1.1. Общая характеристика группы
- •16.1.2. Биологическая роль и медицинское применение соединений
- •16.1.3. Качественные реакции анионов so42-, so32-, ро43-, со32-, с2о42-, с4н4o62-, нс6н5o72-
- •Реакции сульфитов-ионов so32-
- •Реакции фосфат-ионов ро43-
- •Реакции карбонат-ионов co32-
- •Реакции оксалат-ионов с2о42-
- •13. Реакция с групповым реактивом ВаС12. Барий хлорид образует с анионами с2о42- белый осадок барий оксалата:
- •Реакции тартрат-ионов с4н4о62-
- •Реакции цитрат-ионов нс6н5о72-
- •16.2. Вторая аналитическая группа анионов
- •16.2.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.2.2. Качественные реакции анионов Сl-, Br-, і-, s2-, с6н5соо- Реакции хлорид-ионов Сl-
- •Реакции бромид-иоиов Вr-
- •Реакции йодид-ионов I-
- •Реакции сульфид-ионов s2-
- •Реакции бензоат-ионов с6н5соо-
- •16,3. Третья аналитическая группа анионов
- •16.3.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.3.2. Качественные реакции анионов no2-, no3-, МnО4-, сн3соо-, с6н4(он)соо- Реакции нитрит-ионов no2-
- •Реакции нитрат-ионов no3-
- •Реакции перманганат-ионов МnО4-
- •Реакции ацетат-ионов сн3соо-
- •Реакции салицилат-ионов с6н4(он)соо-
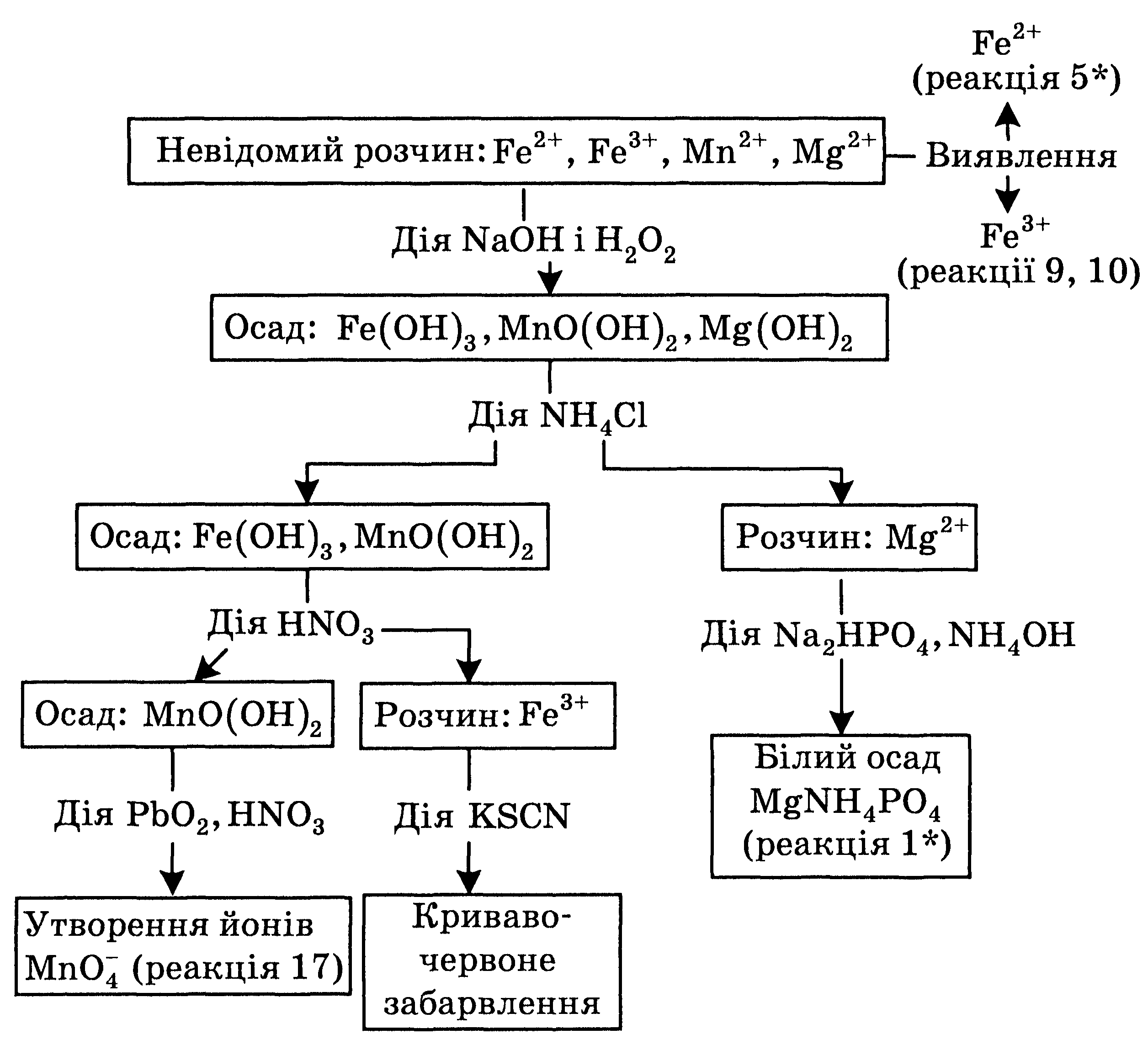
13.4. Анализ смеси катионов пятой аналитической группы
1. Предыдущие испытания
Анализ смеси катионов пятой аналитической группы начинают c определения катионов Fe2 + и Fe3+, поскольку их обнаружению не препятствуют другие катионы. Анализ проводят дробним методом, обнаруживая каждый катион в отдельной порции исследуемого раствора с помощью специфической реакции. Так, для обнаружения катионов Fe2+ используют реакцию 5* с красной кровяной солью, a Fe3+ — реакцию 9 с желтой кровяной солью. Контрольную реакцию на наличие ионов Fe(III) выполняют с калий тиоцианатом (см. реакцию 10*).
2. Осаждение катионов V группы
К 2-3 мл исследуемого раствора добавляют 2М раствор NaOH до щелочной реакции, потом еще 5-6 капель щелочи для создания его излишка. Чтобы окиснити ионы Fe2+ и Мп2+ , добавляют 5-5 капель раствора Н2О2, перемешивают и нагревают смесь на водяной бане до прекращения выделения газа. Осадок, который содержит гидроксиды Ферума(ІІІ), Мангана(ІУ) и Магния, отделяют центрифугированием и промывают горячей водой, к которой добавляют несколько капель раствора аммоний нитрата.
3. Отделение катионов Мn2+ и их определение
К полученному осадку добавляют 5-6 капель 6М раствора аммоний хлорида и смесь перемешивают. Магний гидроксид при этом переходит в раствор, который отделяют центрифугированием. В прозрачном центрифугате определяют ионы Mg2+ по реакцией 1* с натрий гидрогенфосфатом Na2HPО4.
4. Обнаружение катионов Мангана(іі)
Осадок, который остался после отделения Магния, растворяют в 2М растворе нитратной кислоты. При этом ферум(ІІІ) гидроксид переходит в раствор, а в осадке остается соединение Мангана(ІУ), что отвечает формуле МnО(ОН)2.
Если после центрифугирования осадок имеет темно-коричневую окраску, это свидетельствует о наличии катионов Мангану(ІІ). Для подтверждения этого можно выполнить контрольную реакцию 17 с плюмбум(ІУ) оксидом РЬО2.
Систематический анализ смеси катионов пятой аналитической группы
Раздел 14 шестая аналитическая группа катионов
14.1. Общая характеристика группы
К шестой аналитической группе входят двухвалентные катионы: Cu2+ , Cd2+ , Hg2+ , Со2+, Ni2+ . Групповым реактивом является концентрированный раствор аммоний гидроксида NH3·H2О, или NH4OH, который осаждает эти катионы в виде соответствующих гидроксидов (кроме катионов Hg2+ , гидроксид которого неустойчив), растворимых в избтке реактива.
Перечисленные катионы принадлежат к d-элементам. В химических соединениях переходные d-элементы имеют переменную валентность и разные степени окисления: +1, +2 (Сu и Hg ), +2, +3 (Co), +2, +4 (Ni). Они легко вступают в реакции комплексообразования, образовывая катионные и анионные комплексы, это объясняется наличием в атомах этих элементов незавершенной валентной d-орбитали.
При растворении в воде солей Cu(II), Ni(II), Со(ІІ) образовываются катионные аквакомплекси: [Сu(Н2О)6]2+ — голубого, [Ni(H2О)6]2+ — ярко-зеленого, [Со(Н2О)6]2+ — ярко-розового цвета. При действии на них концентрированным раствором аммоний гидроксида сначала образовываются основные соли MeОНAn, которые растворяются в избытке реактива с образованием аммиакатов: [Cu(NH3)4]2+ -синего, [Ni(NH3)4]2+ — фиолетового и [Co(NH3)4]2+ — желтого цвета.
Ионы Hg2+ осаждаются раствором аммоний гидроксида в виде амидных производных наподобие HgNH2Cl, которые растворяются в избытке реактива с образованием комплексного соединения [Hg(NH3)4]Cl2.
Известны также анионные комплексы этих катионов, в частности галогенидные [MeCl4]2-, [MeI4]2-,цианидные [Ме(CN)4]2-, роданидные [Me(SCN)4]2- и др.
В окислительно-восстановительных реакциях ионы Сu2+ и Hg2+ с высшей степенью окисления присоединяют электроны, обнаруживая окислительные свойства, например:
2 HgCl2 + Sn2+ = Hg2Cl2↓ + Sn4+ + 2 Cl-;
2 Cu2+ + 4 I- =2 CuI + І2;
Cu2+ + Zn = Cu + Zn2+.
Ионы Co(II) сильные восстановители. Они легко окисляются на воздухе, превращаясь в соединения Кобальта(III), например:
4 [Co(NH3)6]2+ + О2 + 2 Н2О = 4 [Co(NH3)6]3+ + 4 ОН-.
Под действием оснований на катионы Cu(II), Cd(II), Ni(II), Со(ІІ) образуются гидроксиды, которые отвечают формуле Ме(ОН)2, которые принадлежат к слабым основаниям. Ионы Hg2+ при взаимодействии со щелочами образуют оксид Hg, поскольку меркурий гидроксид в растворах не существует.
