
- •Раздел 8
- •8.2. Аналитические реакции и их характеристика
- •8.3. Аналитическая классификация катионов
- •Раздел 9 первая аналитическая группа катионов
- •9.1. Общая характеристика группы
- •9.4. Систематический анализ смеси катионов первой аналитической группы
- •Отделение ионов аммония
- •Определение катионов Натрия и Калия
- •Раздел 10 вторая аналитическая группа катионов
- •10.1. Общая характеристика группы и биологическая роль катионов
- •10.3. Систематический анализ смеси катионов второй аналитической группы
- •1. Осаждение катионов второй аналитической группы
- •2 Исследование осадка
- •Раздел 11 третья аналитическая группа катионов
- •11.1. Общая характеристика группы
- •11.2. Биологическая роль и медицинское применение соединений
- •10. Реакция с групповым реактивом (сульфатной кислотой).
- •11.4. Систематический анализ смеси катионов третьей аналитической группы
- •Осаждение катионов в виде сульфатов
- •Превращение сульфатов катионов III группы в карбонаты
- •Разделение катионов и их определение
- •Раздел 12 четвертая аналитическая группа катионов
- •12.1. Общая характеристика группы
- •12.2. Биологическая роль и значение соединений катионов IV группы для медицины
- •14. Реакция с окислителями или восстановителями.
- •12.4. Систематический анализ смеси катионов четвертой аналитической группы
- •1. Действие группового реактива
- •2 Отделение катионов Алюминия
- •3 Анализ центрифугата
- •Раздел 13 пятая аналитическая группа катионов
- •13.1. Общая характеристика группы
- •13.2. Биологическая роль и медицинское применение соединений
- •13.4. Анализ смеси катионов пятой аналитической группы
- •1. Предыдущие испытания
- •2. Осаждение катионов V группы
- •4. Обнаружение катионов Мангана(іі)
- •Раздел 14 шестая аналитическая группа катионов
- •14.1. Общая характеристика группы
- •14.2. Биологическая роль и значения соединений катионов VI аналитической группы для медицины
- •14.4. Анализ смеси катионов шестой аналитической группы дробним методом
- •14.5. Систематический анализ смеси катионов шестой аналитической группы
- •1. Разделение катионов
- •2. Анализ центрифугата
- •Систематический анализ смеси катионов шестой аналитической группы
- •Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
- •16.1. Первая аналитическая группа анионов
- •16.1.1. Общая характеристика группы
- •16.1.2. Биологическая роль и медицинское применение соединений
- •16.1.3. Качественные реакции анионов so42-, so32-, ро43-, со32-, с2о42-, с4н4o62-, нс6н5o72-
- •Реакции сульфитов-ионов so32-
- •Реакции фосфат-ионов ро43-
- •Реакции карбонат-ионов co32-
- •Реакции оксалат-ионов с2о42-
- •13. Реакция с групповым реактивом ВаС12. Барий хлорид образует с анионами с2о42- белый осадок барий оксалата:
- •Реакции тартрат-ионов с4н4о62-
- •Реакции цитрат-ионов нс6н5о72-
- •16.2. Вторая аналитическая группа анионов
- •16.2.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.2.2. Качественные реакции анионов Сl-, Br-, і-, s2-, с6н5соо- Реакции хлорид-ионов Сl-
- •Реакции бромид-иоиов Вr-
- •Реакции йодид-ионов I-
- •Реакции сульфид-ионов s2-
- •Реакции бензоат-ионов с6н5соо-
- •16,3. Третья аналитическая группа анионов
- •16.3.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.3.2. Качественные реакции анионов no2-, no3-, МnО4-, сн3соо-, с6н4(он)соо- Реакции нитрит-ионов no2-
- •Реакции нитрат-ионов no3-
- •Реакции перманганат-ионов МnО4-
- •Реакции ацетат-ионов сн3соо-
- •Реакции салицилат-ионов с6н4(он)соо-
13.2. Биологическая роль и медицинское применение соединений
Ферум(ІІ)- и Ферум(ІІІ)-ионы имеют особенно большое значение для жизнедеятельности организма человека и животных. Общее содержимое Ферума в организме 4-5 г, причем 60-70 % общей массы этого элемента содержится в эритроцитах и нервных клетках. Ионы Ферума, которые входят в состав биосистем, разделяют на гемовые и негемовые.
Гемовые ионы Ферума (гемовое железо* - Такое название не отвечает современному названию химического элемента, но еще используется в медицинской литературе) - это ионы Fe(II), которые входят в состав порфиринових комплексов, а негемовые - остальные соединения: феритина, гемосидерина, лактоферина, ферум - сульфуросодержащих белков (ФСБ) и др.
К гемосодержащим белкам принадлежат гемоглобин (Нb) и миоглобин. Гемоглобин входит в состав еритроцитов крови и обеспечивает связывание кислорода и перенос его от легких к тканям всех органов, а миоглобин сохраняет запасы кислорода в мышцах.
Ферум входит также в состав цитохромов, которые выполняют роль переносчиков электронов в цепи дыхания. По структуре они напоминают гемм, но отличаются строением боковых цепей порфиринового цикла и белковой части макромолекул. В процессах перенесения электронов принимают участие и ферумсульфуросодержащие белки.
Важными биологическими соединениями, которые содержат Ферум, являются ферменты каталаза и пероксидаза. Каталаза защищает клетки от токсичного действия гидроген пероксида, а пероксидаза катализирует процессы окисления пероксидом разных органических биосубстратов.
Учитывая большое значение ионов Fe(II) и Fe(III) для организма человека, суточная потребность в нем представляет 10-15 мг. В случае недостатка соединений Ферума в организме развиваются заболевания крови, так называемые ферумдефицитные (железодефицитные - термин устаревший) анемии, вследствие которых уменьшается как общее количество эритроцитов, так и содержание в них гемоглобина. Для лечения таких заболеваний используют ферум(ІІ) сульфат FeSO4·7H20, лактат (СН3СН(OН)СОО)2Fe·3H2O или аскорбинат (C6H8O6·FeO) FeSO4·4H2O , а в последнее время применяют современные препараты, которые содержат Ферум, — фероплекс, фероцерон, ферумградумет, фенюльс, ферум-лек и др. В случае хронической интоксикации соединениями Ферума возникает болезнь под названием сидероз.
К важным биоэлементам, принадлежащим к группе микроэлементов, относится Манган. Он содержится в организме в виде катионных форм (Мn2+ , Мn3+ , Мn4+), которые в окислительно-восстановительных процессах переходят из одной степени окисления в другую. Ионы Мангана необходимы для роста и образование костей, сохранения репродуктивной функции организма. Они принимают участие в метаболизме глюкозы и липидов, а также в процессе активирования некоторых ферментов (аргиназы, фосфатаз и т.п.). Содержимое Мангана в организме человека составляет близко 12 мг.
Манган преимущественно входит в состав ферментных систем, которые ускоряют окислительно-восстановительные процессы внутриклеточного обмена веществ, в частности аминопептидазы. Ферменты, которые содержат Манган, катализируют сложные процессы клеточного дыхания, усиливают обмен углеводов и жиров, способствут синтезу витамина С и обмена витаминов группы В і Е. В случае недостатка Мангана в организме поднимается фосфорно-кальциевый обмен, который приводит к возникновению рахита, как и при недостатке витамина D. Соединения двухвалентного Мангана используют в медицинской практике при различных заболеваниях: в комплексах с поливитаминами — при невритах, а вместе с соединениями Кобальта и Купрума — при заболеваниях кроветворных органов. Манган(ІІ) сульфат и хлорид (MnSO4 + МnС12) входят как минеральные добавки в состав поливитаминов.
Калий перманганат КМnO4 является сильным окислителем, поэтому его используют в количественном анализе для определения восстановителей (см. п. 20.1). Благодаря противомикробным свойствам его применяют в виде разбавленных растворов как антисептическое средство для промывания ран, а также желудка в случае отравлений.
Соединения Магния содержатся во внутриклеточных жидкостях, костях скелета и эмали зубов. В водных растворах биологических жидкостей ионы Mg2+ при участии молекул воды образовывают комплексные соединения наподобие [Mg(H2О)6]2+. С аминокислотами, ЕДТА и порфиринами ионы Магния образовывают сложные хелатные комплексы, в которых донорами электронов выступают атомы Оксигена или Нитрогена.
В биосистемах ионы Mg2+ находятся в виде гидратированных ионов и сложных комплексов с нуклеиновими кислотами. Например, в составе комплекса с АТФ Магний выполняет роль активатора процессов синтеза и гидролиза этого биологически важного соединения.
В зависимости от концентрации в организме Магний может ускорять или тормозить процесс передачи импульсов по нервным волокнам. Он также влияет на дыхательные центры и действует успокаивающе на нервную систему. Катионы Mg2+ входят в состав хелатного комплекса — хлорофилла, который по своей структурой напоминает гемм гемоглобина крови. Однако в молекуле хлорофилла центральным ионом является Магний, а гемоглобина -
Ферум(ІІ).
13.3. Качественные реакции катионов Mg2+, Fe2+, Fe3+, Mn2+
Реакции катионов Магния Мg2+
1*Реакция с натрий гидрогенфосфатом. Натрий гидрогенфосфат Na2HPО4 в присутствии аммоний гидроксида и аммоний хлорида образует с ионами Магния белый кристаллический осадок двойной соли магний-аммоний фосфата:
Mg2+ + NH4OH + НРО42- = MgNH4PО4↓ + H2О.
Соль NH4C1 добавляют для того, чтобы при действии NH4OH предотвратить образование малорастворимого осадка Mg(OH)2.
Эта реакция довольно чувствительная (10 мкг), ее используют для определения ионов Mg2+ в крови.
Выполнение. В пробирку вносят 2-3 капли соли Магния, добавляют 2 капли раствора аммоний гидроксида и раствора аммоний хлорида до полного растворения осадка Mg(OH)2. К смеси добавляют при перемешивании раствор Na2HPО4. Подвергают испытанию на растворение осадка в минеральных и ацетатной кислотах, в которых он хорошо растворяется.
2. Реакция с гидроксидами щелочных металлов. Сильные щелочи осаждают из растворов солей Магния белый аморфный осадок магний гидроксида:
Mg2+ + 2 ОН- = Mg(OH)2↓.
Эту реакцию можно использовать для отделения ионов Mg2+ от ионов К+ и Na+ , поскольку гидроксиды щелочных металлов хорошо растворяются в воде.
Выполнение. В пробирку вносят 2-3 капли соли Магния и столько же раствора щелочи. Наблюдают образование осадка, который растворяется в минеральных кислотах и солях аммония (см. уравнение реакции в п. 13.1).
3. Реакция с аммоний гидроксидом. Раствор аммоний гидроксида образует с ионами Магния белый осадок магний гидроксида:
Mg2+ + 2 NH4OH ↔ Mg(OH)2↓ + 2NH4+.
Этот процесс является обратимым, поэтому при наличии в растворе солей аммония равновесие смещается влево и осадок Mg(OH)2 может не образовываться.
Выполнение. В две пробирки вносят по 2-3 капли соли Магния. В первую доливают немного аммоний хлорида и в обе пробирки вносят по несколько капель раствора NH4OH. Убеждаются в том, что аммоний гидроксид при наличии солей аммония не осаждает катионы Mg2+.
4. Реакция с оксихинолином. Этот органический реагент образовывает с солями Магния желто-зеленый кристаллический осадок магний оксихинолята Mg(Ox)2 по схеме
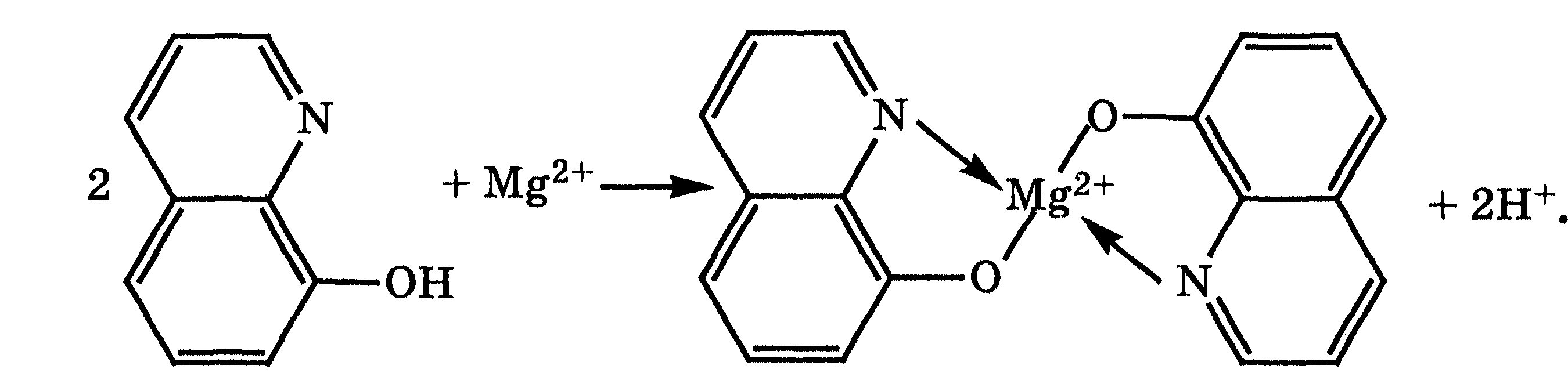
Эта реакция характеризуется высокой чувствительностью (0,25 мкг), однако для обнаружения катионов Магния ее можно использовать только после отделения ионов Са2+, Ва2+ и Sr2+, с которыми оксихинолин также образует окрашенные комплексные соединения.
Выполнение. К 2-3 капели соли Магния добавляют по две капли NH4OH и NH4C1 и столько же спиртового раствора 8-оксихинолина. Наблюдают образование осадка.
Реакции катионов Ферума(ІІ) Fe2+
5*. Реакция с красной кровяной солью. Калий гексацианоферат(ІІІ) K3[Fe(CN)6] (красная кровяная соль) образует с ионами Fe2+ темно-синий осадок, который получил название "турнбулевой сини".
Реакция происходит в две стадии. Сначала K3[Fe(CN)6] окисляет ионы Fe2+ до Fe3+ по схеме
Fe2+ + [Fе(CN)6]3- = Fe3+ + [Fe(CN)6]4-,
а потом образованные ионы Fe3+ соединяются с анионом гексацианоферата(ІІ), образовывая нерастворимое комплексное соединение по уравнению
Fe3+ + К+ + [Fe+2(CN)6]4- = KFe+3[Fe+2(CN)6] ↓.
По составу это соединение идентично берлинской лазури (см. реакцию 9*).
Приведенная качественная реакция характеризуется высокой чувствительностью (0,05 мкг), ее выполняют в кислотной среде.
Выполнение. К 3-4 капель соли двухвалентного Ферума добавляют 2-3 капли хлоридной кислоты (для приостановления гидролиза соли) и 2-3 капли реактива. К образованному темно-синему осадку добавляют немного раствора щелочи и наблюдают изменение окраски, связанное с разрушением комплекса и образованием ферум(ІІ) гидроксида.
6. Реакция с аммоний сульфидом. Аммоний сульфид (NH4)S образовывает с солями Fe(II) черный осадок ферум(ІІ) сульфида:
Fe2+ + S2~ = FeS↓.
Осадок растворяется в разбавленных минеральных кислотах.
Выполнение. К 3-4 капели соли Ферума(ІІ) добавляют 2-3 капли раствора реактива. Приливают немного хлоридной кислоты и наблюдают растворение осадка.
7. Реакция с групповым реактивом. Гидроксиды щелочных металлов NaOH, КОН образовывают с ионами Fe(II) серо-зеленый осадок ферум(ІІ) гидроксида:
Fe2+ + 2 ОH- =Fe(OH)2↓.
Образованный осадок на воздухе окисляется и постепенно превращается в бурый осадок Fe(OH)3:
4 Fe(ОН )2 + О2 + 2 Н2О = 4 Fe(ОН )3 ↓.
Осадок Fe(OH)3 растворяется в кислотах и не растворяется в избытке щелочи.
Выполнение. К 3-4 капель соли Ферума(ІІ) добавляют такое количество раствора натрий гидроксида. Часть полученного осадка отливают в другую пробирку, перемешивают и наблюдают за изменением окраски. Ко второй части осадка приливают немного хлоридной кислоты и наблюдают его растворение.
8. Реакция с окислителями. При взаимодействии ионов Ферума(ІІ) с сильными окислителями, например КМnО4 или І2, в кислотной среде происходит обесцвечивание растворов калий перманганата и йода по уравнениями
5 Fe2+ + МnО4- + 8 Н+ = 5 Fe3+ + Мn2+ + 4 Н2О;
2 FeSO4 + I2 + H2SO4 = Fe2(SO4)3 + 2 HI.
Выполнение. К 2-3 капелzv соли Феруму(ІІІ) добавляют парe капель 2М раствора H2SO4 и 4-5 капель раствора калий перманганата или йода и наблюдают обесцвечивание растворов.
Реакции катионов Феруму(ІІІ) Fе3+
9*. Реакция с желтой кровяной солью. Калий гексацианоферат(ІІ) K4[Fe(CN)6] (желтая кровяная соль) в слабо кислой среде образует темно-синий осадок берлинской лазури — калий ферум(ІІІ) гексацианоферата(ІІ):
Fe3+ + K+ + [Fe(CN)6]4- = KFe[Fe(CN)6]↓.
Выполнению этой реакции препятствуют окислители, которые также взаимодействуют с этим реактивом.
Выполнение. К 3-4 капелям соли Ферума(ІІІ) добавляют 2-3 капли хлоридной кислоты и 3-4 капли реактива. Наблюдают образование осадка берлинской лазури, которая разлагается под действием щелочей с образованием Fe(OH)3 темно-бурой окраски.
10*. Реакция с калий тиоцианатом. Калий тиоцианат (роданид) KSCN (или аммоний тиоцианат NH4SCN) при взаимодействии с ионами Fe3+ в кислой среде образовывает ферум(ІІІ) тиоцианат кроваво-красного цвета:
Fe3+ + 3SCN- =Fe(SCN)3.
Реакция специфическая и высокочувствительная (0,25 мкг).
Выполнение. К 3-4 капелям соли Ферума(ІІІ) добавляют 2-3 капли хлоридной кислоты и 5-6 капель калий или аммоний роданида. Наблюдают окраску раствора.
11. Реакция с групповым реактивом. Гидроксиды щелочных металлов NaOH , КОН образовывают с ионами Fe(III) бурый осадок ферум(ІІІ) гидроксида:
Fe3+ + 3 ОН- = Fe(ОН )3 ↓.
Осадок Fe(OH)3 хорошо растворяется в минеральных кислотах:
Fe(ОН)3(т) +З Н+ = Fe3+ + 3 Н2О,
однако при обычных условиях не растворяется в избытке реактива.
Выполнение. К 3-4 капелям соли Ферума(ІІІ) добавляют такой же объем щелочи. Наблюдают образование осадка. Добавляют к нему немного хлоридной кислоты и наблюдают растворение осадка.
12. Реакция с аммоний сульфидом. Аммоний сульфид (NH4)S с солями Fe(III) образует черный осадок ферум(ІІІ) сульфида:
2 Fe3+ + 3 S2- = Fe2S3 ↓.
Осадок растворяется в разбавленных минеральных кислотах. Например, в хлоридной кислоте процесс растворения описывают таким ионно-молекулярным уравнением:
Fe2S3 + 4 H+ =2Fe2+ + S↓+ 2 H2S↑.
Выполнение. К 3-4 капелям соли Ферума(ІІІ) добавляют 2-3 капли раствора аммоний сульфида. Приливают немного хлоридной кислоты, наблюдают растворение осадка.
13. Реакция с калий йодидом. Калий йодид восстанавливает ионы Ферума(ІІІ) до ионов Ферума(ІІ) с выделением свободного йода, вследствие чего раствор приобретает бурую окраску:
2 Fe3+ + 2 I- = 2 Fe2+ + I2.
Выполнение. К 4-5 капелям соли Ферума(ІІІ) добавляют такое же количество раствора калий йодида и наблюдают окраску раствора. Если в пробирку долить 0,5 мл бензола или хлороформа и смесь хорошо взболтать, то органический растворитель окрасится в фиолетовый цвет.
14*. Реакция с салициловой кислотой. Салициловая кислота С6Н4 (ОН)СООН в присутствии аммиака или сульфосалициловой кислота С6Н3(ОH)(SО3ОH)CООH в кислой среде образовывают с ионами Fe3+ соответственно комплексное соединение Fe[C6H4(О)(СОО)]3 желтого или соединение Fe[C6H3(SО3H)(О)(CОО)]3 красно-фиолетового цвета. Чувствительность этой реакции 5-10 мкг.
Выполнение. К 2-3 капелям соли Ферума(ІІІ) добавляют несколько капель раствора аммоний гидроксида и столько же раствора салициловой кислоты. Если добавляется сульфосалициловая кислота, то предварительно к раствору добавляют 2-3 капли хлоридной кислоты. Наблюдают окрашивание раствора соответственно в желтый или красно-фиолетовый цвет.
Реакции катионов Мангану(ІІ) Мn2+
15. Действие группового реактива. Сильные щелочи осаживают из водных растворов солей Мангана(ІІ) белый осадок его гидроксида Мn(ОН)2. Манган гидроксид неустойчив и на воздухе окисляется до МnО(ОН)2 бурого цвета:
Мn2+ + 2 OH- =Мn(ОН)2↓;
2Мn(ОН)2 + O2 + 2 Н2O →2 Мn(OН)4 = 2МnО(ОН)2↓+ 2 Н2O.
Выполнение. К 2-3 капелzv раствора соли двухвалентного Мангана добавляют столько же реактива. Наблюдают образование осадка и изменение его окраски при стоянии.
16. Реакция с аммоний сульфидом. Аммоний сульфид при взаимодействии с катионами Мп2+ образовывает малорозчинний манган сульфид телесного цвета:
Мn2+ + S2- = MnS↓.
Осадок растворяется в минеральных кислотах и темнеет на воздухе вследствие окисления:
MnS + О2 + 2 H2О = Mn(ОH)4 + S.
Выполнение. К 2-3 капелям раствора соли Мангана(ІІ) добавляют столько же реактива. Наблюдают образование осадка и его потемнение при стоянии (см. п. 15).
17. Реакция с сильными окислителями. В результате действия сильных окислителей (плюмбум(ІУ) оксида РbO2, сурика Рb3O4 или аммоний персульфата (NH4)2S2O8) катионы Мn2+ превращаются в анионы МпO4-, которые имеют характерную фиолетовую окраску. Окисление Мn2+ с помощью РbO2 происходит по такому ионно-молекулярному уравнению:
2 Мn2+ + 5 РbO2 + 4 Н+ = 2 Mn04- + 5 Pb2+ + 2 Н2O
Мn2+ + 4 Н2O – 5 е- → МnO4- + 8 Н+ ·2
РbO2+ 4 Н+ + 2 е- → Рb2+ + 2 Н2O ·5
Реакцию проводят при нагревании в концентрированной нитратной кислоте. Она специфическая и дает возможность определить ионы Мn2+ при наличии некоторых других катионов.
Выполнение. В пробирку вносят на кончике шпателя немного плюмбум(ІУ) оксида или сурика, добавляют 1 мл концентрированной нитратной кислоты и одну каплю соли Мангана (нитрата или сульфата, но не хлорида МnС12). Раствор осторожно кипятят несколько минут, добавляют дистиллированной воды и перемешивают. После отстаивания смеси наблюдают появление фиолетовой или красно-фиолетовой окраски. В случае значительного избытка солей Мангана(ІІ) эта реакция не дает положительного эффекта, поскольку вместо перманганатной кислоты НМn04 образовывается бурый осадок МnО(ОН)2.
