
- •Раздел 8
- •8.2. Аналитические реакции и их характеристика
- •8.3. Аналитическая классификация катионов
- •Раздел 9 первая аналитическая группа катионов
- •9.1. Общая характеристика группы
- •9.4. Систематический анализ смеси катионов первой аналитической группы
- •Отделение ионов аммония
- •Определение катионов Натрия и Калия
- •Раздел 10 вторая аналитическая группа катионов
- •10.1. Общая характеристика группы и биологическая роль катионов
- •10.3. Систематический анализ смеси катионов второй аналитической группы
- •1. Осаждение катионов второй аналитической группы
- •2 Исследование осадка
- •Раздел 11 третья аналитическая группа катионов
- •11.1. Общая характеристика группы
- •11.2. Биологическая роль и медицинское применение соединений
- •10. Реакция с групповым реактивом (сульфатной кислотой).
- •11.4. Систематический анализ смеси катионов третьей аналитической группы
- •Осаждение катионов в виде сульфатов
- •Превращение сульфатов катионов III группы в карбонаты
- •Разделение катионов и их определение
- •Раздел 12 четвертая аналитическая группа катионов
- •12.1. Общая характеристика группы
- •12.2. Биологическая роль и значение соединений катионов IV группы для медицины
- •14. Реакция с окислителями или восстановителями.
- •12.4. Систематический анализ смеси катионов четвертой аналитической группы
- •1. Действие группового реактива
- •2 Отделение катионов Алюминия
- •3 Анализ центрифугата
- •Раздел 13 пятая аналитическая группа катионов
- •13.1. Общая характеристика группы
- •13.2. Биологическая роль и медицинское применение соединений
- •13.4. Анализ смеси катионов пятой аналитической группы
- •1. Предыдущие испытания
- •2. Осаждение катионов V группы
- •4. Обнаружение катионов Мангана(іі)
- •Раздел 14 шестая аналитическая группа катионов
- •14.1. Общая характеристика группы
- •14.2. Биологическая роль и значения соединений катионов VI аналитической группы для медицины
- •14.4. Анализ смеси катионов шестой аналитической группы дробним методом
- •14.5. Систематический анализ смеси катионов шестой аналитической группы
- •1. Разделение катионов
- •2. Анализ центрифугата
- •Систематический анализ смеси катионов шестой аналитической группы
- •Раздел 1 6 качественные реакции анионов. Анализ неизвестного вещества и содержимого их некоторых примесей
- •16.1. Первая аналитическая группа анионов
- •16.1.1. Общая характеристика группы
- •16.1.2. Биологическая роль и медицинское применение соединений
- •16.1.3. Качественные реакции анионов so42-, so32-, ро43-, со32-, с2о42-, с4н4o62-, нс6н5o72-
- •Реакции сульфитов-ионов so32-
- •Реакции фосфат-ионов ро43-
- •Реакции карбонат-ионов co32-
- •Реакции оксалат-ионов с2о42-
- •13. Реакция с групповым реактивом ВаС12. Барий хлорид образует с анионами с2о42- белый осадок барий оксалата:
- •Реакции тартрат-ионов с4н4о62-
- •Реакции цитрат-ионов нс6н5о72-
- •16.2. Вторая аналитическая группа анионов
- •16.2.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.2.2. Качественные реакции анионов Сl-, Br-, і-, s2-, с6н5соо- Реакции хлорид-ионов Сl-
- •Реакции бромид-иоиов Вr-
- •Реакции йодид-ионов I-
- •Реакции сульфид-ионов s2-
- •Реакции бензоат-ионов с6н5соо-
- •16,3. Третья аналитическая группа анионов
- •16.3.1. Общая характеристика группы, биологическая роль и медицинское применение соединений
- •16.3.2. Качественные реакции анионов no2-, no3-, МnО4-, сн3соо-, с6н4(он)соо- Реакции нитрит-ионов no2-
- •Реакции нитрат-ионов no3-
- •Реакции перманганат-ионов МnО4-
- •Реакции ацетат-ионов сн3соо-
- •Реакции салицилат-ионов с6н4(он)соо-
12.2. Биологическая роль и значение соединений катионов IV группы для медицины
Цинк и Хром принадлежат к биогенным элементам, биологическая роль Алюминия изучена недостаточно. Цинк - один из наиболее распространенных микроэлементов, его содержание в организме составляет приблизительно 1,4-2,3 г. По своим физико-химическим характеристиками Цинк отличается от переходных биометаллов. Он имеет меньший ионный радиус и больший потенциал ионизации. В соединениях проявляет степень окисления +2 и характеризуется высокой способностью к координации с аминными и сульфгидрильными группами, что и реализуется в биосистемах во время образования разных металлоферментов. Цинк входит в состав активных центров многих ферментов.
Например, важным ферментом, который содержит Цинк, является карбоксипептидаза - гідролитический энзим, который ускоряет реакцию расщепления белков до аминокислот, из которых в клетках синтезируются новые белки. Другим ферментом, который содержит ионы Zn2+ , является карбоангидраза, функция которой связана с процессом дыхания.
Биологическая роль Цинка в значительной мере связана с функционированием желез внутренней секреции, в которых он концентрируется. Кроме того, ионы Цинка существенным образом влияют на способность инсулина снижать уровень глюкозы в крови. Он также способствует заживлению ран, благодаря чему цинковые мази издавна применяют в дерматологии.
Хром — необходимый элемент для функционирования многочисленных биосистем. Он влияет на обмен углеводов, липидов и нуклеиновых кислот, активирует действие инсулина, входит в состав ферментов трипсина и трансферина. Улучшая общий обмен веществ, Хром замедляет процессы старения организма. В медицинской практике используют препарат под названием "Хром пиколинат" для лечения сахарного диабета. Кроме того, соединения Хрома входят в состав некоторых комплексных витаминных препаратов.
Из всех микроэлементов ион Сr(ІІІ) является наименее отравляющим, однако соединения шестивалентного хрома (хроматы и дихроматы) токсичны.
Алюминий относят к незаменимым микроэлементам (общая массовая доля равна 10-5 %). Он поступает в организм с продуктами питания и частично с водой, суточная потребность в нем 45-50 мг. Этот катион содействует развитию и регенерации эпителиальной, соединительной и костной тканей, принимает участие в обмене фосфоросодержащих соединений. При повышенном содержании в организме соединений Алюминия наблюдаются значительные нарушения равновесия реакций, связанных с энергообменом.
Соединения Алюминия имеют кровоостанавливающие, противовоспалительное и антацидные свойства, благодаря чему их издавна используют в медицине. Например, алюминий гидроксид А1(ОН)3 применяют при повышенной кислотности желудочного сока как в чистом виде, так и в смеси с магний оксидом (алмагель) или в смеси с Mg(OH)2 (маалокс). В виде паст, мазей, присыпок калий-алюминий сульфата додекагидрат KA1(SО4)2·12Н2О (алюмокалиевые квасцы) используют в случае воспалительных заболеваний слизистых оболочек и кожи. Препарат алюгастрин NaAl(ОH)2CО3 назначают при язвенной болезни желудка.
Арсен в организме человека содержится в следових количествах, накапливается в печени, почках, селезенке, эритроцитах. В малых дозах его соединения улучшают процесс кровообразования, положительно влияют на окислительно-восстановительные процессы и нуклеиновый обмен. Тем не менее в больших дозах Арсен и его соединения токсичны. Они ингибуют ферменты, которые содержат функциональные группы -SH.
Издавна соединения Арсена применяли как медицинские препараты, в частности арсенфениламин (сальварсан) для лечения сифилиса. Оксид Арсена(ІІІ) As2О3 широко используют в стоматологии для некротизации пульпы, а соли арсенитной и арсенатной кислот KAsО2 и Na2HAsО4 применяют в терапии для общего укрепления организма.
12.3. Качественные реакции катионов Zn2+, Сr3+, А13+, As3+, As5+
Реакции катионов Цинка Zn2+
1*. Реакция с сульфидом натрия или аммония. Натрий сульфид (или аммоний сульфид) осаждают из растворов солей Цинка белый осадок Zn , который растворяется в хлоридной, но не растворяется в ацетатной кислоте:
Zn2+ + S2-=ZnS↓;
Zn(T) + 2 НС1 = ZnCl2 + H2S↑.
Выполнение. К 4-5 капель раствора соли Цинка добавляют такое же количество раствора сульфида натрия или аммония. Наблюдают образование осадка, который делят на две части. К одной добавляют хлоридную, ко второй - ацетатную кислоту и делают вывод о растворимости Zn в кислотах.
2*. Реакция с желтой кровяной солью. Калий гексацианоферат(ІІ) K4[Fe(CN)6] (желтая кровяная соль) при наличии солей Цинка образовывает белый осадок калий-цинк гексацианоферрата(ІІ):
3 Zn2+ + 2K4[Fe(CN)6] = K2Zn3[Fe(CN)6]2↓+ 6 К+.
Эта реакция специфическая, дает возможность отличить ионы Zn2+ от А13+ , причем ионы Сr3+ не влияют на ход реакции.
Выполнение. К 4-5 капель раствора соли Цинка добавляют такое же количество реактива, перемешивают и нагревают смесь до кипения. Наблюдают образование осадка, не растворимого в разбавленной хлоридной кислоте.
3. Реакция с групповым реактивом. Гидроксиды щелочных металлов осаживают из растворов солей Цинка белый осадок цинк гидроксида, который хорошо растворяется в избытке реактива, поскольку Zn(OH)2 является типичным амфотерным основанием:
Zn2+ + 2 ОH- =Zn(OH)2↓;
Zn(ОН)2(т) + 2 ОН- = [Zn(ОН)4]2-.
Выполнение. К 4-5 капель раствора соли Цинка медленно (каплями) добавляют раствор щелочи до образования осадка. Образованный осадок делят на две части и исследуют его растворимость в избытке реактива и в хлоридной кислоте.
Реакция с дитизоном. Дифенилтиокарбазон (дитизон) образует с ионами Zn2+ в растворе хлороформа окрашенную внутрикомплексную соль — дитизонат цинка:
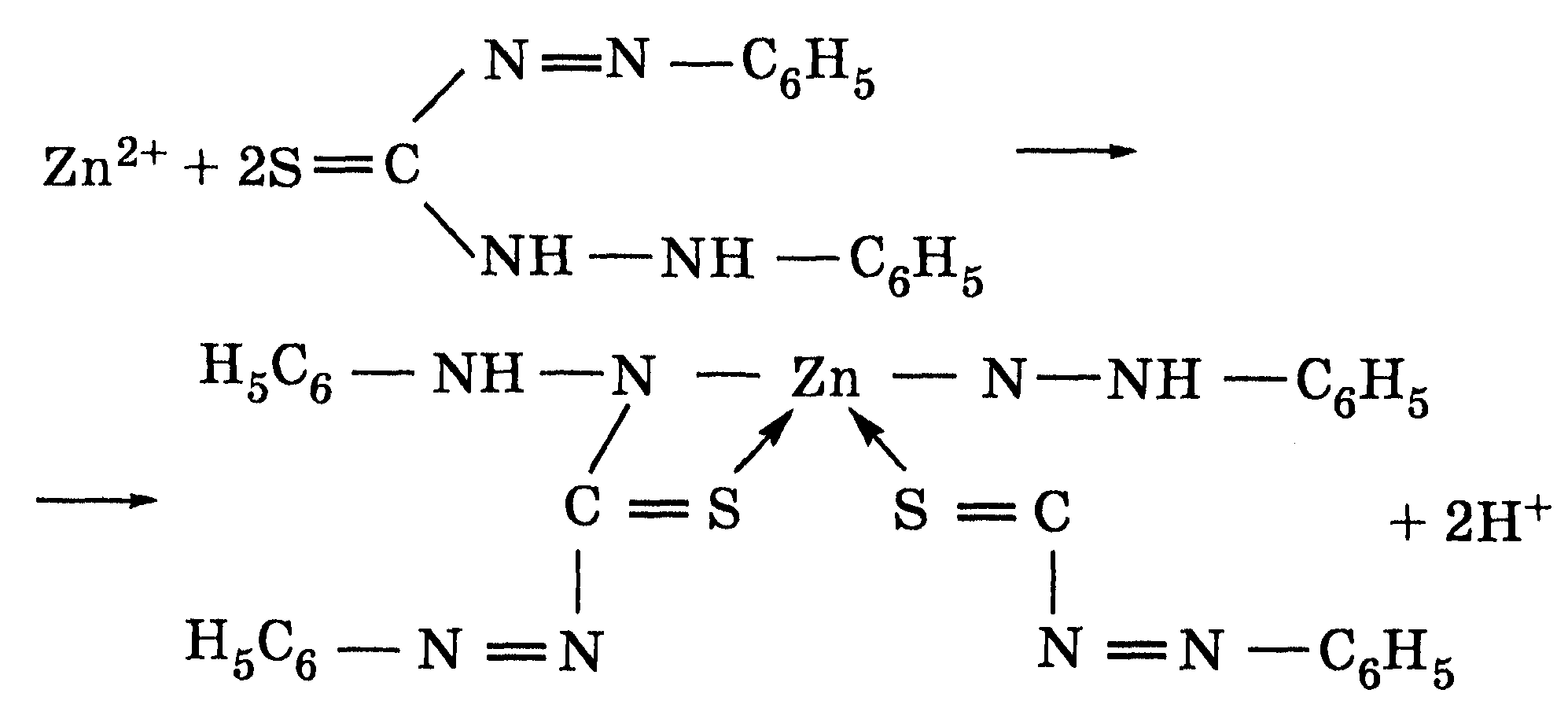
Реакция характеризуется высокой чувствительностью (0,025 мкг).
Выполнение. К 4-5 капель раствора соли Цинка добавляют несколько капель хлороформного раствора дитизона и наблюдают окрашивание хлороформного слоя в малиновокрасный цвет.
Реакции катионов Хрома Сr3+
Реакция с групповым реактивом. Едкие щелочи NaOH , КОН осаживают ионы Сr3+ в виде гидроксида серозеленого цвета, который имеет амфотерные свойства:
Сr3+ + З ОН- =Сr(ОН)3↓;
Cr(OH)3(T) +3 ОH- =[Сr(ОН)6]3-;
Сr(ОН)3(т) + З Н+ = Сr3+ + 3 Н2О.
Выполнение. К 4-5 капель раствора соли Хрома(ІІІ) медленно добавляют раствор щелочи до образования осадка. Образованный осадок делят на две части и исследуют его растворимость в избытке реактива и в хлоридной кислоте.
Реакция с аммоний сульфидом. Аммоний сульфид (NH4)2S при взаимодействии с солями Хрома(ІІІ) осаждает гидроксид хрома(ІІІ) Сr(ОН)3 серо-зеленого цвета. При этом выделяется сероводород:
2 Cr3+ + 3 S2-+6 H2ОБ = 2 Cr(ОH)3↓ + H2S↑.
Выполнение. К 4-5 капель раствора соли Хрома(ІІІ) добавляют 5-6 капель раствора аммоний сульфида и немного нагревают. Наблюдают образование осадка Сг(ОН)3.
Реакция с сильными окислителями. Сильные окислители (Н2О2, KMnО4, (NH4)2S2О8, С12) в щелочной среде окисляют ионы Сr3+ до хромат-ионов СrО42- желтого цвета, а в кислой среде — до дихромат-ионов Cr2O72- оранжевого цвета.
Окислительно-восстановительные реакции описываются такими ионными уравнениями:
2 СrО2 + З Н2О2 + 2 ОН- = 2 СrО42-+4 Н2O
СrО22- + 4 ОН- – Зе- → СrО42- + 2 Н2О ·2
Н2О2 + 2е- → 2 ОН- ·3
10 Cr3+ + 6 MnО 4- +11 H2O = 5 Cr2O72- + 6 Mn2+ + 22H+
2 Cr3+ + 7 H2O – 6e- → Cr2O72- + 14 H+ · ·5
МnО4- + 8 H+ + 5e- → Mn2+ + 4 H2O · ·6
Выполнение реакции с гидроген пероксидом Н2O2. В пробирку вносят 2-3 капле раствора соли Хрома(ІІІ) и добавляют 4-5 капель раствора щелочи [до растворению осадка Cr(OH)3], 3-4 капли раствора Н2O2 и немного нагревают. Наблюдают переход окраски из зеленого в желтый.
Если образованный раствор подкислить сульфатной кислотой, то гидроген пероксид окислит хромат-ионы до пероксида СrО5 синего цвета:
СrО42- + 2Н2O2 + 2Н+ = Сr5 + З Н2O.
При добавлении к этому раствору эфира и перемешивании смеси эфирный слой окрашивается в синий цвет.
Выполнение реакции с калий перманганатом КМп04. В фарфоровую чашку вносят 5-6 капель раствора соли Хрома(ІІІ), несколько капель 1М раствора H2SO4 и 1 мл раствора КMnO4. Смесь кипятят до переходу малиновой окраски в оранжеву После охлаждения к смеси добавляют 2-3 капле Н2O2, 0,5 мл эфира и перемешивают. Наблюдают окрашиване эфирного слоя в синий цвет, которое объясняется образованием пероксида хрома СгО5 по уравнению
Сr2O72- + 4 Н2O2 + 2 Н+ =2 СrО5 + 5 Н2O.
Реакция образования пероксида хрома является высокочувствительной (2,5 мкг) и специфической.
Реакции катионов Алюминия А13+
8. Реакция с раствором аммиака. Водный раствор аммоний гидроксида осаждают из растворов солей Алюминия белый аморфный осадок алюминий гидроксида:
Al3+ + 3 NH4OH = Al(OH)3↓+ 3 NH4+.
Алюминий гидроксид А1(ОН)3 имеет амфотерные свойства, так как, полученный осадок легко растворяется в кислотах и щелочах:
А1(ОН)3(т) +З Н+ = А13+ + З Н2O;
A1(OH)3(T) +OH- = [Al(ОН)4]-.
Выполнение. К 3-4 капель раствора соли Алюминия добавляют 5-6 капель раствора аммоний гидроксида. Образованный осадок делят на две части; к одной части добавляют хлоридную кислоту, ко второй - раствор щелочи. Наблюдают растворение осадка в обеих пробирках.
9. Реакция с групповым реактивом. Едкие щелочи КОН и NaOH осаждают из растворов солей Алюминия белый аморфный осадок алюминий гидроксида:
А13+ + З ОН- = А1(ОН)3.
Образованный осадок растворяется в кислотах и щелочах (см. реакцию 8).
Выполнение. К 3-4 капель раствора соли Алюминия медленно добавляют раствор щелочи до образования осадка. Исследуют его растворимость в кислотах и щелочах.
10*. Реакция с кобальт(ІІ) нитратом. Кобальт нитрат при прокаливании с солями Алюминия образует кобальт алюминат синего цвета, который называют "тенаровою синькой":
2 A12(SO4)3 + 2 Co(N03)2 = 2 Сo(АlО2)2 + 4 NO2↑ + O2↑+ 6 SO3↑.
Выполнение. В фарфоровую чашку вносят 3-4 капли раствора соли Алюминия, добавляют такое же количество раствора кобальт нитрата. Смесь выпаривают и прокаливают до выделения газов. Наблюдают образование кобальт алюмината синего цвета.
11. Реакция с ализарином. Органический реактив — 1,2-диоксиантрахинон (ализарин) образовывает с алюминий гидроксидом внутрикомплексное соединение ярко-красного цвета, которое называют "алюминиевым лаком".
Чувствительность этой реакции - 0,5 мкг, ее выполняют капельным методом.
Выполнение. Несколько капель раствора соли Алюминия наносят на полоску фильтровальной бумаги, которую в течение 2-3 минут держат над концентрированным раствором NH4OH [для образования А1(ОН)3 по реакции 8]. Потом добавляют несколько капель спиртового раствора ализарина и снова держат полоску над парами аммиака. Появление красной окраски на фиолетовом фоне подтверждает наличие в исследуемом растворе ионов А13+ . Уравнение реакции записывают так:

Реакции катионов Арсена As3+ и As5+
12. Реакция с сульфидами. В сильно кислотной среде сульфиды при взаимодействии с солями Арсена образовывают желтые осадки As2S3 или As2S5:
2 As3+ + З S2- = As2S3↓;
2 As5+ + 5 S2- = As2S5↓.
Арсен(ІІІ) сульфид не растворим в концентрированной НС1, он растворяется в растворах натрий сульфида или аммиака с образованием тиосолей:
As2S3(t) + 3 Na2S = 2 Na3AsО3;
As2S3(т) + 6 NH3 + 3 H2О = (NH4)3AsS3 + (NH4)3AsО3.
Осадок As2S5 также растворяется в избытке раствора натрий сульфида, образовывая растворимую в воде тиосоль по уравнению
As2S5(т) + 3 Na2S = 2 Na3AsS4.
Выполнение. К 4-5 капель раствора, который содержит соли Арсена(III) или Арсена(V), добавляют 2-3 капле 2М раствора хлоридной кислоты и пропускают через раствор сероводород (барботируют). Наблюдают образование желтого осадка.
13. Реакция с аргентум нитратом. Раствор AgNО3 образовывает с солями Арсению(III) желтый осадок аргентум арсенита Ag3AsО3, а с солями Арсена(V) — шоколадно-коричневый осадок аргентум арсената Ag3As4:
AsО33- + 3Ag+ = Ag3AsО3↓;
AsО43- + 3Ag+ = Ag3AsО4↓.
Эта качественная реакция дает возможность различить соединения Арсению разной валентности.
Выполнение. К 4-5 капель раствора соли арсенитной Na3AsО3 или арсенатной Na3AsО4 кислоты добавляют такое же количество раствора реактива и наблюдают образование осадков, которые отличаются по цвету.
