
- •Предисловие
- •1.Общие требования безопасности.
- •2.Требования безопасности в аварийных ситуациях.
- •Основная литература для студентов
- •Дополнительная литература
- •Лабораторные работы
- •Лабораторная работа № 1 Тема: «Реакции ионного обмена»
- •Основные (гидгоксиды металлов) - на катионы металлов гидроксид анионов например:
- •Ход работы
- •Лабораторная работа № 2. Тема: «Гидролиз солей». «Испытание растворов солей индикаторами».
- •2.Научиться составлять молекулярные, и сокращенные ионные уравнения реакции.
- •II. Ход работы.
- •Лабораторная работа №3. Тема: Общие свойства металлов.
- •II.Теоретическая часть:
- •III. Контрольное задание.
- •Лабораторная работа № 4
- •Ход работы
- •Лабораторная работа № 5
- •Углеводородов и их переработка.
- •Ход работы
- •1.Теоретическая часть:
- •Правила
- •По названию записать формулы: а) 2,2 –диметил– бутан; б)2,3,4- триметил - пентан; в) 2- метил-3-этил-гексан
- •II. Практическая часть:
- •Лабораторная работа №6 Тема: «Химические свойства спиртов, фенола, альдегидов».
- •Теоретическая часть.
- •Ход работы.
- •Теоретическая часть.
- •Ход работы
- •I.Получение уксусной кислоты
- •II.Изучение свойств уксусной кислоты
- •Лабораторная работа № 8 Тема: «Химические свойства углеводов»
- •Теоретическая часть:
- •Ход работы:
- •I.Свойства глюкозы.
- •II. Свойства крахмала.
- •III.Свойства сахарозы.
- •Контрольное задание.
- •Лабораторная работа № 9 Тема: «Свойства белков»
- •Теоретическая часть
По названию записать формулы: а) 2,2 –диметил– бутан; б)2,3,4- триметил - пентан; в) 2- метил-3-этил-гексан
II. Практическая часть:
- построить изомеры C6H5-гексана и дать название
- написать формулы соединений
2-хлор-2-метил-пентан
2,4 дибром-2-метил-3этил гексан
2,3 дииод 2- метил пентан
2 – метил-3,3 дихлор- 4- этил 5-пропил-октан
1,3- дибром-бутан
2-этил-3-бром-4-хлор-гексан
-по коллекциям изучить продукты переработки нефти, составить схему получения продуктов.
перегонки нефти
крекинга нефти
- написать уравнения, с помощью которых можно осуществить превращение
C3H8
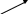
C6H14C6H12
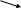

изогексан С6H6
Что делали? |
Что наблюдали? |
Выводы и уравнения реакций |
|
|
|
Лабораторная работа №6 Тема: «Химические свойства спиртов, фенола, альдегидов».
Цели: 1. Повторить строение и свойства кислородосодержащих органических веществ: спиртов, фенолов и альдегидов
2.Научиться проводить качественные реакции на спирты, фенолы и альдегиды.
Оборудование: спиртовка, спички, медная проволока, этиловый спирт, глицерин, фенол, метаналь, сульфат меди (CuSO4), хлорид железа(III), гидроксид натрия (NaOH), пробирки, штатив.
Теоретическая часть.
Спирты и фенолы являются гидроксильными производными, содержащими гидроксильную группу OH-. Атомы водорода гидроксильных групп в спиртах проявляют определенную подвижность. Подобно воде, спирты реагируют со щелочными металлами, которые замещают водород гидроксильных групп с образованием алкоголятов (фенолятов). В реакции со щелочными металлами спирты в известной мере проявляют кислотные свойства, но в меньшей мере, чем вода. Практически спирты представляют собой нейтральные вещества: они не дают ни кислой, ни щелочной реакции на лакмус, не проводят электрический ток. Кислотные свойства фенолов выражены в большей степени, чем у спиртов. Под влиянием бензольного кольца водород гидроксила в фенолах более подвижен, чем в спиртах и они обладают большими, чем спирты кислотными свойствами (поэтому простейший фенол и был назван карболовой кислотой).
R-C-R
O
// O
Для альдегидов R-C и кетонов O- характерно присутствие в молекуле
\
Н
функциональной карбонильной группы C=O. Альдегиды легко окисляются, Действие окислителей в молекулах альдегидов направлено на водород, стоящий у карбонильной группы. В молекулах кетонов при карбонильной группе водорода нет, поэтому они не окисляются слабыми окислителями средней силы.
Ход работы.
Качественные реакции на спирты.
Опыт1 Окисление этилового спирта.
Прокалите в пламени спиртовки медную проволоку до образования на ее поверхности черного налета оксида меди (II)- (CuО). Затем быстро опустите проволоку в пробирку с этиловым спиртом. Что наблюдаете? Какой
ощущается запах? Составьте уравнение реакции окисления этилового спирта.
Опыт 2 Получение глицерата меди (II) (качественная реакция на многоатомные спирты).
В пробирку налейте 1-2 мл, сульфата меди (CuSO4) и добавите 10% раствор гидроксида натрия (NaOH) до образования гидроксида меди- (Cu(OH)2). К полученному осадку прибавьте немного глицерина и перемешайте. Что наблюдаете? Напишите уравнение реакций. Какие свойства проявляет глицерин?
Опыт 3. Качественная реакция на фенол.
В пробирку с фенолом добавьте 2-3 капли 2% раствора хлорида железа(III). Какое проявляется окрашивание? Характерно ли такое окрашивание для спиртов?
.Опыт 4.Окисление формальдегида II.
Получите осадок гидроксида меди (II) , добавьте метаналя, нагрейте до появления красного осадка- оксида меди (I)
Результаты работы оформить в виде таблицы:
Что делали |
Что наблюдали |
Выводы и уравнения реакций |
|
|
|
Контрольное задание.
Составьте уравнения реакций по схеме:
Пропан пропен1 пропанол пропанальпропионовая кислота
Лабораторная работа №7
Тема: «Получение и изучение свойств карбоновых кислот»
Цели: 1.Изучить свойства карбоновых кислот на примере уксусной кислоты, определить общие кислотные свойства и ее особенности.
2.Познакомиться с лабораторным способом получения уксусной кислоты.
Оборудование: Уксусная кислота, раствор NaOH, лакмус, стружки магния, мел, спички, пробирки, штатив.
