
- •Самостоятельное изучение курса «физическая химия»
- •Самарский государственный технический университет Самара 2013
- •1. Цели и задачи учебной дисциплины и ее место в учебном процессе
- •Цели и задачи изучения дисциплины
- •1.2. Краткая характеристика дисциплины и её место в учебном процессе
- •1.3. Связь с предшествующими дисциплинами
- •1.4. Связь с последующими дисциплинами
- •2. Методические указания для студентов самостоятельно изучающих курс «Физическая химия»
- •3. Программа курса «Физическая химия»
- •Раздел 1. Химическая термодинамика
- •Тема 1.1. Первый закон термодинамики
- •Тема 1.2. Второй закон термодинамики
- •1.2.2. Термодинамические характеристические функции. Определение термодинамической возможности самопроизвольного протекания химической реакции в стандартных условиях.
- •2.2.2. Коллигативные свойства разбавленных растворов.
- •Тема 4.1. Электропроводность растворов электролитов
- •Тема 4.2. Электродный потенциал, эдс
- •Тема 4.3. Электролиз
- •4. Учебно-методические материалы по дисциплине
- •4.1. Основная литература
- •4.2. Дополнительная литература
- •5. Примерный перечень вопросов к экзамену по всему курсу
- •6. Примеры решения контрольных задач
- •Задача № 2
- •Задача № 3
- •Задача № 4
- •56 Г/моль.
- •1 Моль/л.
- •0,94 Моль/1кг р-ля.
- •Задача № 5
- •0,9 Кмоль,
- •0,3 Кмоль,
- •Задача № 6
- •Задача № 7
- •Самостоятельное изучение курса «Физическая химия»
- •443100, Г. Самара, ул.Молодогвардейская, 244. Главный корпус
- •443100, Г. Самара, ул. Молодогвардейская, 244. Корпус №8
Задача № 7
По значениям константы скорости реакции при двух температурах определить:
1) энергию активации (аналитическим и графическим способами);
2) константу скорости при температуре Т3 (аналитическим и графическим способами);
3) температурный коэффициент γ скорости реакции;
4) количество вещества, израсходованное за время t, если начальные концентрации равны С0
Принять, что порядок реакции и молекулярность совпадают.
Решение:
Для решения задачи необходимо изучить материал, изложенный в разделе 3, тема 3.1, 3.2.
Решим задачу для реакции
СН3СООС2Н5
+ NaOH
![]() CH3COONa
+ C2H5OH
CH3COONa
+ C2H5OH
при следующих условиях:
Т1, К |
k1, л/(моль•мин) |
Т2, К |
k2, л/(моль•мин) |
Т3, К |
t, мин |
с0, моль/л |
282,6 |
2,307 |
318,1 |
21,65 |
343,2 |
15 |
0,95 |
Найдем значение энергии активации Еа для химической реакции аналитическим и графическим способами.
Аналитический способ (по формуле) заключается в расчете Еа по формуле Аррениуса:
![]()
где k1 и k2 – константы скорости реакции при температурах Т1 и Т2 соответственно; Еа – энергия активации химической реакции, Дж/моль; R – универсальная газовая постоянная (8,314 Дж/(К·моль)).
Следовательно, энергия активации равна:
![]()
![]()
Графический способ (по графику)заключается в определении k по графику зависимости lgk = f(1/T).
По уравнению Аррениуса для этой зависимости
![]()
или
![]()
В координатах «lgk-1/T» графиком этой функциональной зависимости является прямая линия, тангенс угла наклона которой к положительному направлению оси абсцисс равен
![]()
Откуда
![]()
Т.к.
![]()
то![]()
Для определения Еа графическим способом рассчитаем:
lgk1
= lg2,307
= 0,36305;
![]() ,
,
lgk2
= lg21,65
= 1,33546;
![]() .
.
и
построим график в координатах «![]() »:
»:
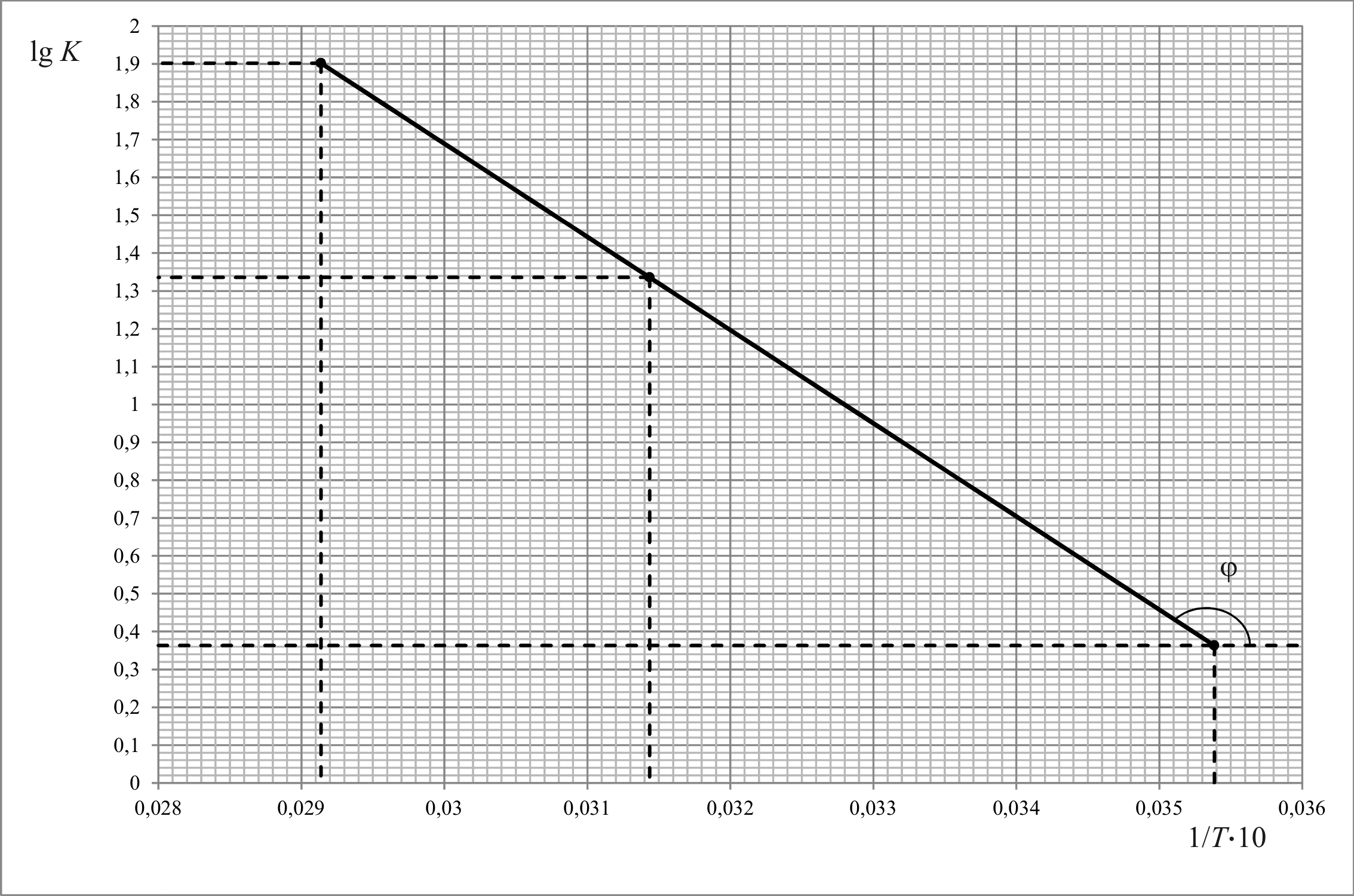
Определяем по графику:
![]()
Еа = 2,3·R·tgφ = 2,3·8,314·2462,4 = 47087 Дж ∕ моль
Найдем константу скорости реакции k3 для температуры Т3 = 343,2 К аналитическим и графическим способами.
Аналитический способ заключается в расчете k по формуле. Поскольку логарифм отношения равен сумме логарифмов, то
![]()
![]()
k3 = 101,9 =80,5.
Графический способ заключается в определении k по графику зависимости lgk = f(1/T).
Определяем
по графику для
![]()
lgk3 = 1,9,
k3 = 101,9 = 80,5.
Найдем температурный коэффициент реакции, используя уравнение Вант – Гоффа:

![]()
9,38 = γ3,55
lg9,38 = 3,55 lgγ
lgγ = 0,274
γ = 100,274 = 1,88.
Найдем количество вещества, израсходованное за время
(τ) 15 мин, если начальная концентрация равна с0 = 0,95 моль/л.
Реакция омыления этилацетата является реакцией 2-го порядка. Для таких реакции кинетическое уравнение имеет вид:
![]()
Подставим в уравнение k2 = 21,65, с0 = 0,95 моль/л и τ = 15 мин
![]() ,
,
откуда х = 0,947 моль.
Ответ: Еа = 47087 Дж ∕моль; k3 = 80,5;γ = 1,88; n = 0,947 моль.
СОДЕРЖАНИЕ
|
|
1. Цели и задачи дисциплины, ее место в учебном процессе…………………. |
3 |
2. Методические указания для студентов самостоятельно изучающих курс «Физическая химия»…….................................................................................. |
5 |
3. Программа курса «Физическая химия»……………………………………… |
9 |
4. Учебно-методические материалы по дисциплине 4.1. Основная литература……………………………………………………. 4.2. Дополнительная литература…………………………………………….. |
11 11 |
по курсу…………………………………………………………………………… |
15
|
|
17 |
