
- •Предмет физической химии, её основные разделы.
- •Основные понятия химической термодинамики
- •Внутренняя энергия, теплота и работа
- •Первый закон термодинамики. Связь тепловых эффектов qP(∆h)и qV(∆u)
- •Закон Гесса и его применение
- •Теплота образования химических соединений из
- •Теплота сгорания (∆h0сг). Использование величин ∆h0сг для вычисления тепловых эффектов реакций
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгофа)
- •Второй закон термодинамики. Энтропия. Объединенное уравнение I и II законов для обратимых процессов
- •Вычисление ∆s в различных процессах (фазовые превращения, нагревание, расширение (сжатие) идеального газа)
- •Постулат Планка. Абсолютное значение энтропии. Вычисление ∆s в химической реакции
- •Термодинамические характеристические функции
- •Определение термодинамической возможности самопроизвольного протекания химической реакции в стандартных условиях
- •Критерии возможности самопроизвольного протекания процесса
- •Константа равновесия химической реакции и способы выражения константы равновесия
- •Уравнение изотермы химической реакции, его применение
- •Зависимость константы равновесия химической реакции от температуры (уравнение изобары (изохоры) химической реакции)
- •Влияние давления на равновесие химической реакции (уравнение Планка)
- •Расчет константы равновесия по термодинамическим данным. Метод Темкина-Шварцмана
- •Расчет состава равновесной смеси
- •Равновесие при агрегатных и полиморфных превращениях (уравнение Клаузиуса-Клапейрона). Диаграммы состояния вещества
- •Понятие о физико-химическом анализе. Принципы непрерывности и соответствия Курнакова
- •Правило фаз Гиббса и его применение
- •Термический анализ. Построение диаграмм плавкости (диаграмм состояния)
- •Растворимость газов в жидкостях. Влияние на растворимость давления, температуры, растворенных веществ
- •Закон распределения. Экстрагирование
- •Экстракция
- •Совершенные растворы. Состав пара над совершенным раствором
- •Законы Коновалова о составах равновесных жидкости и пара
- •Диаграммы «давление-состав» и «температура кипения-состав»
- •Дробная (фракционная) перегонка. Ректификация
- •Системы ограниченно растворимых в друг друге жидкостей
- •Взаимно нерастворимые жидкости. Перегонка с водяным паром
- •Скорость, молекулярность и порядок химической реакции
- •Необратимые реакции I, II и III порядков
- •Методы определения порядка химической реакции
- •Сложные реакции. Кинетическое изучение сложных реакций
- •Влияние температуры на скорость химической
- •Теории химической кинетики
- •Кинетика гетерогенных реакций. Кинетическая и диффузионная область протекания реакции
- •Катализ: определение, классификация,
- •38. Гомогенный катализ.
- •39. Автокатализ.
- •40. Гетерогенный катализ
Определение термодинамической возможности самопроизвольного протекания химической реакции в стандартных условиях
Термодинамика устанавливает, что для любых систем, существует некоторый критерий, определяющий возможность и направление самопроизвольных процессов и момент установления равновесия. Такими критериями являются характеристические функции.
Для изолированных систем такой функцией является энтропия S.
В химической технологии изолированные системы практически не встречаются. Часто процесс приводят при постоянстве объема и температуры (в изохорно-изотермических условиях) или при постоянном давлении и постоянной температуре (в изобарно-изотермических условиях). Характеристическими функциями в этом случае являются энергия Гельмгольца и энергия Гиббса. Убыль ∆F (или∆G) характеризует при этих условиях способность системы совершать полезную работу. По мере протекания процесса и приближения системы к состоянию равновесия ее «работоспособность» уменьшается.
Таким образом, мы имеем несколько критериев возможности самопроизвольного протекания процесса (табл.).
Критерии возможности самопроизвольного протекания процесса
Функция |
S |
F |
G |
Определение |
|
F = U-TS |
G = H-TS |
Чем измеряется изменение функции |
|
l)-∆F = Amax 2) ∆F=∆U-T∆S |
l)- ∆G = A´max 2) ∆G = ∆H-T∆S |
Ограничения |
изолированная система |
T=const V = const |
T = const p = const |
Критерий возможности самопроизвольного процесса |
∆S>0 |
∆F < 0 |
∆G < 0 |
Условия равновесия |
максимум S dS = 0 |
минимум F dF = 0 |
минимум G dG = 0 |
Константа равновесия химической реакции и способы выражения константы равновесия
Состояние системы, которое не изменяется во времени и ничем не поддерживается, называется равновесным.
При протекании химических реакций при определенных внешних уловиях наступает такой момент, когда число молекул веществ, составлящих систему, перестает изменяться и остается постоянным при неизменных внешних условиях. Такое состояние называется химическим равновесием.
Рассмотрим при заданных условиях какую-либо систему, в которой происходят как прямая, так и обратная реакции, где скорость прямой peaкции равна скорости обратной (Wпр = Wобр):
аА + вВ ↔ dD + rR
Пусть все участвующие в реакции вещества находятся в газообразном состоянии, каждое из которых характеризуется своим равновесным давлением рА, рВ, pD, рR. В условиях равновесия dG = 0, тогда для полного дифференциала энергии Гиббса имеем
![]()
При Т= const и р = const
![]()
Подставим значения химических потенциалов веществ, образующих в систему, в последнее уравнение:
dμD + rμR – aμA – bμB =0
Учитывая, что μi = μi ° + RTlnp, подставляем значения химических потенциалов всех реагирующих веществ в последнее уравнение, отсюда
![]()
сгруппировав члены равенства, имеем
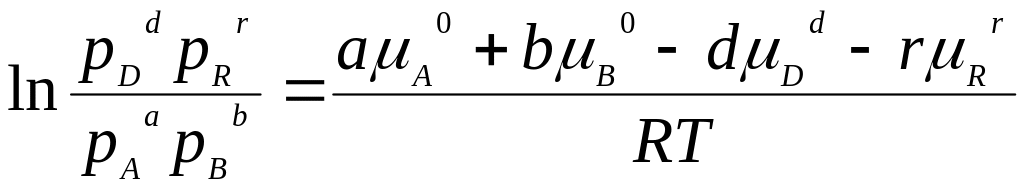
В правой части этого уравнения стоит величина, зависящая только от температуры и давления. Поскольку процесс идет в изобарно-изотермических условиях, эта величина будет постоянной. Обозначим ee lnКр,, тогда
 →
→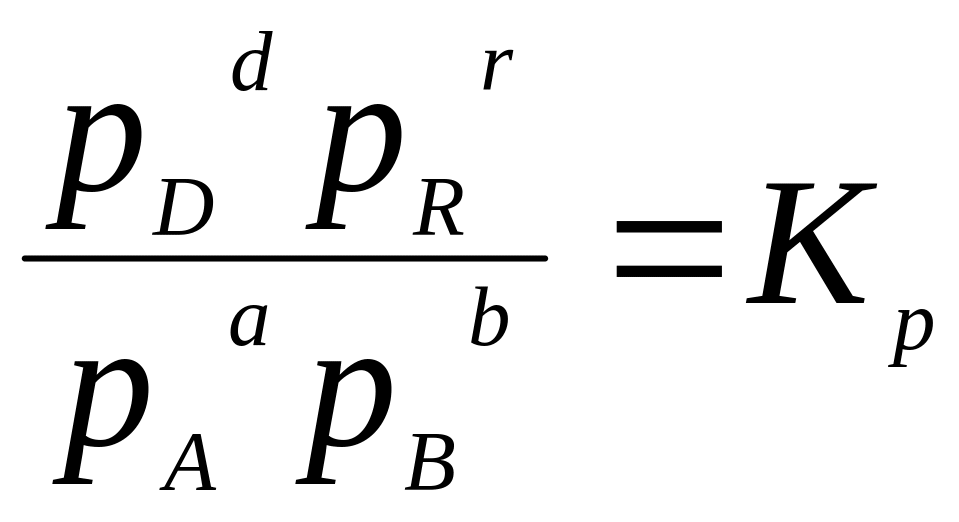
где Кр - константой равновесия химической реакции протекающей между газообразными веществами.
Если химический потенциал выразить через концентрацию
μi = μi0 + RTlnсi, то, проделав аналогичные операции, получим

Константы Кр, и Кc определяют выход химической реакции. Под выходом понимают долю исходного вещества, превратившегося в конечный продукт. Если Кр >>1 или Кc >>1, то в данной системе велик выход продуктов реакции.
Уравнения для Кр и Кc называют законом действующих масс (ЗДМ), выведенным на основе термодинамики. Для газов из уравнения Менделеева-Клапейрона:
piVi= niRT; pi(ni/Vi)RT=ciRT.
Подставив последнее выражение в уравнение ЗДМ для Кр, получим уравнение взаимосвязи Кр и Кc
Kp=Kc(RT)∆n,
где ∆n – изменение количества вещества (в моль) в реакции.
При ∆n = 0
H2
+Cl2
↔ 2HCl, Кр=Кc
или


При ∆n < 0
2СО + О2↔2СО2,
Кр<
Кс
или
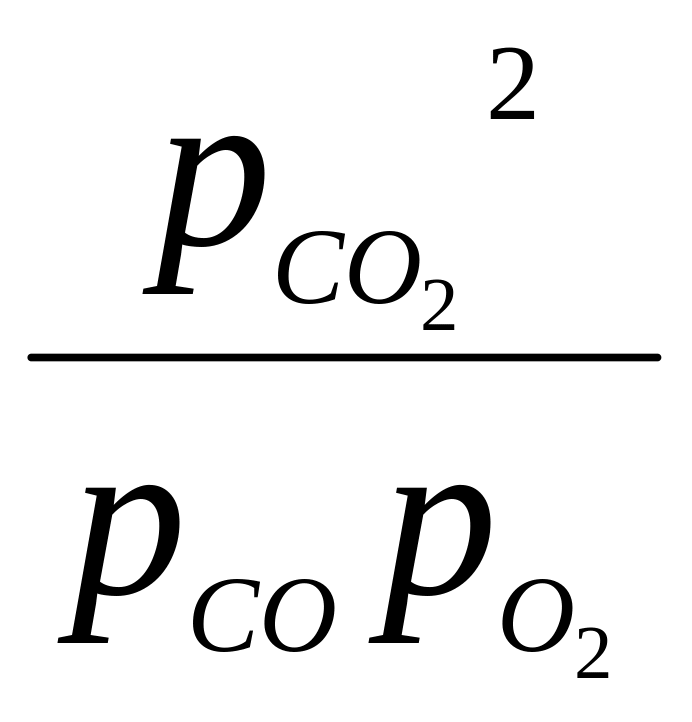 <
<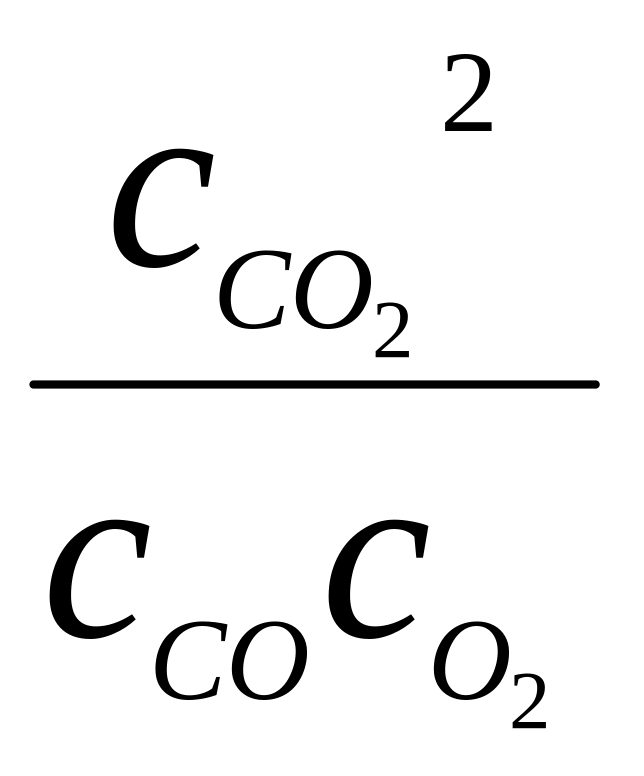
При ∆n >0
2NH3
↔ 3Н2
+ N2,
Kp
> Кс
или
 <
<
Для реальных растворов используют константу равновесия Ka, рассчитываемую через активности:

Активность а – это концентрация реального раствора, которая учитывает размеры и взаимодействия частиц реагирующих веществ.
![]() ,
,
где
![]() - коэффициент активности. Значение
для разных веществ при разных концентрациях
их растворов приведены в аналитических
и физико-химических справочниках.
- коэффициент активности. Значение
для разных веществ при разных концентрациях
их растворов приведены в аналитических
и физико-химических справочниках.
Для учёта взаимодействия частиц реального газа используют коэффициент фугетивности φ, а вместо давлений величину фугетивности f = φp.
Поэтому равновесие
в реальных газах характеризует константой
![]() .
.
 .
.
Приведенные уравнения для расчета Кр, Кc, КN, Кa и Кf справедливы для гомогенных систем.
При выводе ЗДМ мы рассматривали гомогенные системы, в которых все компоненты находятся в газообразном состояние или в растворе. Реакции, в которых реагенты находятся в разных фазах называются гетерогенными. Ограничимся рассмотрением наиболее простых гетерогенных равновесий, в которых каждое вещество содержится системе в виде самостоятельной фазы, т.е. не образует жидких или твердь растворов.
Пусть в реакции аА + bВ = dD + rR вещество D находится в кристаллическом состоянии, тогда аналогично предыдущему получим:
где рD — давление насыщенного компонента D, являющееся постоянно величиной.
Включая рD в константу Кр, получаем

