
- •Предмет физической химии, её основные разделы.
- •Основные понятия химической термодинамики
- •Внутренняя энергия, теплота и работа
- •Первый закон термодинамики. Связь тепловых эффектов qP(∆h)и qV(∆u)
- •Закон Гесса и его применение
- •Теплота образования химических соединений из
- •Теплота сгорания (∆h0сг). Использование величин ∆h0сг для вычисления тепловых эффектов реакций
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгофа)
- •Второй закон термодинамики. Энтропия. Объединенное уравнение I и II законов для обратимых процессов
- •Вычисление ∆s в различных процессах (фазовые превращения, нагревание, расширение (сжатие) идеального газа)
- •Постулат Планка. Абсолютное значение энтропии. Вычисление ∆s в химической реакции
- •Термодинамические характеристические функции
- •Определение термодинамической возможности самопроизвольного протекания химической реакции в стандартных условиях
- •Критерии возможности самопроизвольного протекания процесса
- •Константа равновесия химической реакции и способы выражения константы равновесия
- •Уравнение изотермы химической реакции, его применение
- •Зависимость константы равновесия химической реакции от температуры (уравнение изобары (изохоры) химической реакции)
- •Влияние давления на равновесие химической реакции (уравнение Планка)
- •Расчет константы равновесия по термодинамическим данным. Метод Темкина-Шварцмана
- •Расчет состава равновесной смеси
- •Равновесие при агрегатных и полиморфных превращениях (уравнение Клаузиуса-Клапейрона). Диаграммы состояния вещества
- •Понятие о физико-химическом анализе. Принципы непрерывности и соответствия Курнакова
- •Правило фаз Гиббса и его применение
- •Термический анализ. Построение диаграмм плавкости (диаграмм состояния)
- •Растворимость газов в жидкостях. Влияние на растворимость давления, температуры, растворенных веществ
- •Закон распределения. Экстрагирование
- •Экстракция
- •Совершенные растворы. Состав пара над совершенным раствором
- •Законы Коновалова о составах равновесных жидкости и пара
- •Диаграммы «давление-состав» и «температура кипения-состав»
- •Дробная (фракционная) перегонка. Ректификация
- •Системы ограниченно растворимых в друг друге жидкостей
- •Взаимно нерастворимые жидкости. Перегонка с водяным паром
- •Скорость, молекулярность и порядок химической реакции
- •Необратимые реакции I, II и III порядков
- •Методы определения порядка химической реакции
- •Сложные реакции. Кинетическое изучение сложных реакций
- •Влияние температуры на скорость химической
- •Теории химической кинетики
- •Кинетика гетерогенных реакций. Кинетическая и диффузионная область протекания реакции
- •Катализ: определение, классификация,
- •38. Гомогенный катализ.
- •39. Автокатализ.
- •40. Гетерогенный катализ
Термический анализ. Построение диаграмм плавкости (диаграмм состояния)
Одним из наиболее распространенных видов физико-химического анализа является термический, который представляет собой совокупность экспериментальных методов определения температуры, при которой в равновесной системе изменяется число фаз. Термический анализ основан на наблюдении кривых охлаждения.
Кривые охлаждения – это графики зависимости изменения температуры от времени в данной системе. Если при охлаждении системы не происходит никаких фазовых превращений, то температура равномерно уменьшается. Если в системе происходит какое-либо превращение, сопровождающееся тепловым эффектом, то непрерывность хода кривой нарушается (рис. 1а).

Рис. 1. Кривые охлаждения (а) и диаграмма состояния системы с эвтектикой (б): L - расплав; L+A - расплав + первичные кристаллы A: L+B - расплав + первичные кристаллы В; A+E(A+B) - кристаллы А + твердая эвтектика; В+Е(А+В) - кристаллы В + твердая эвтектика: Е- эвтектика.
На основании кривых охлаждения строят диаграмму состояния в координатах «температура - состав», по которой судят о наличии тех или других фаз, их числе, температуре кристаллизации смеси определенного состава и т.п. (см. рис. 1б).
Для изучения равновесия между жидкой и твердой фазами системы применяют диаграммы состояния, называемые диаграммами плавкости. Они выражают зависимость температуры плавления смеси от ее состава. Диаграммы плавкости представляют собой совокупность линий, плоскостей и точек, отражающих химические процессы, происходящие в системе при изменении температуры или состава, отвечающих равновесию, таких как образование и распад химических соединений, появление и (или) исчезновение твердых или жидких растворов и т.п.
На диаграмме линия температуры, выше которой компоненты системы находятся только в жидком состоянии, называется линией ликвидуса (от лат. liquor - жидкость), а линия ниже которой компоненты смеси находятся только в твердом состоянии – линией солидуса (от лат. solid - твердый). Точки на диаграмме состояния, отражающие равновесное состояние системы, при данных температуре и составе называют фигуративными. Исследование диаграмм плавкости проводят с помощью нод (или коннод), т. е. горизонтальных прямых, отвечающих постоянной температуре, соединяющих фигуративные точки двух находящихся в равновесии фаз. Особыми точками диаграмм плавкости являются точка эвтектики (т. Е) и точка перитектики (т. С). Обе точки отвечают состоянию двухкомпонетной системы, когда в равновесии одновременно находятся две твердые фазы и одна жидкая - их расплав. Однако процессы при охлаждении трехфазной системы существенно отличаются. В эвтектической точке одновременно выпадают две твердые фазы, а в перетектической одна выпадает, а другая растворяется, переставая существовать.
Растворимость газов в жидкостях. Влияние на растворимость давления, температуры, растворенных веществ
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов концентрация электролитов).
Наибольшее влияние на растворимость газов в жидкостях оказывает природа веществ. Так, в 1 литре воды при t = 18 °С и P = 1 атм. растворяется 0.017 л. азота, 748.8 л. аммиака или 427.8 л. хлороводорода. Аномально высокая растворимость газов в жидкостях обычно обусловливается их специфическим взаимодействием с растворителем – образованием химического соединения (для аммиака) или диссоциацией в растворе на ионы (для хлороводорода). Газы, молекулы которых неполярны, растворяются, как правило, лучше в неполярных жидкостях – и наоборот. Зависимость растворимости газов от давления выражается законом Генри – Дальтона:
Растворимость газа в жидкости прямо пропорциональна его давлению над жидкостью.
![]()
Здесь С – концентрация раствора газа в жидкости, k – коэффициент пропорциональности, зависящий от природы газа. Закон Генри – Дальтона справедлив только для разбавленных растворов при малых давлениях, когда газы можно считать идеальными. Газы, способные к специфическому взаимодействию с растворителем, данному закону не подчиняются.
Растворимость газов в жидкостях существенно зависит от температуры; количественно данная зависимость определяется уравнением Клапейрона – Клаузиуса (здесь X – мольная доля газа в растворе, λ – тепловой эффект растворения 1 моля газа в его насыщенном растворе):
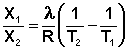
Как правило, при растворении газа в жидкости выделяется теплота (λ < 0), поэтому с повышением температуры растворимость уменьшается. Растворимость газов в жидкости сильно зависит от концентрации других растворенных веществ. Зависимость растворимости газов от концентрации электролитов в жидкости выражается формулой Сеченова (X и Xo – растворимость газа в чистом растворителе и растворе электролита с концентрацией C):
![]()
