
- •По основності кислоти діляться на:
- •Насичені моно карбонові кислоти
- •Номенклатура і ізомерія
- •Фізичні властивості
- •Хімічні властивості
- •І. Реакції з розривом зв’язку о – н
- •Іі. Реакції з розривом зв’язку с – о
- •Ііі. Реакції з розривом зв'язків с – н
- •Особливості будови і властивості мурашиної кислоти
- •Реакція «срібного дзеркала»
- •Реакція с гідроксидом міді (іі)
- •Способи добування насичених монокарбонових кислот і. Загальні способи добування
- •Іі. Способи добування найважливіших кислот
- •Застосування найважливіших моно карбонових кислот
 -
це похідні ВВ, що містять функціональну
карбоксильну групу –
СООН.
-
це похідні ВВ, що містять функціональну
карбоксильну групу –
СООН.
Карбоксильна група (карбоксил) – це складна функціональна група, що складається із карбонільної та гідроксильної груп:

 О
О
С
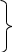 карбоніл
карбоніл
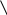
+ карбоксил
 ОН
гідроксил
ОН
гідроксил
Загальна формула карбонових кислот:


 О
О
 R
– С
де m
– число
карбоксильних груп,
R
– С
де m
– число
карбоксильних груп,
ОН m, які визначають основність кислоти.
По основності кислоти діляться на:
Одноосновні (моно карбонові), m = 1
Двохосновні (дикарбонові), m = 2
Трьохосновні (трикарбонові), m = 3 і т.д.
Прикладами дикарбонових кислот являються:
ОН О Щавлева к-та |
НООС – (СН2)3 – СООН
Глутарова к-та |
СООН
О О – фталева к-та |
В залежності від будови ВВ радикала R карбонові кислоти діляться:
-насичені
-ненасичені
-ароматичні.
Насичені моно карбонові кислоти
 О
О
 СnН2n+1С
, n ≥ 0
СnН2n+1С
, n ≥ 0
ОН
Деякі представники гомологічного ряду насичених моно карбонових кислот
n
|
Формула кислоти |
Назва кислоти
За міжнародною тривіальна номенклатурою |
Назва кислот- ного залишку R - СОО- |
Продукти в яких міститься кислота |
0 |
Н – СООН |
Метанова Мурашина |
Форміат |
Виділення мурах |
1 |
СН3 –СООН |
Етанова Оцтова |
Ацетат |
Продукти окис-нення багатьох речовин |
2 |
СН3 – СН2 – СООН |
Пропанова Пропіонова |
Пропіонат |
Деревна смола |
3 |
СН3 – (СН2)2 –СООН |
Бутанова Масляна |
Бутират |
Вершкове масло |
4 |
СН3 – (СН2)3 –СООН |
Пентанова Валеріанова |
Валериат |
Валеріана(трава) |
5 |
СН3 – (СН2)4 –СООН |
Гексанова Капронова |
Капронат |
Вершкове масло Нафта |
9 |
СН3 – (СН2)8 –СООН |
Деканова Капрінова |
Капрінат |
Кокосове масло |
* 15 |
СН3 – (СН2)14 -СООН |
Гексадеканова Пальмітино- ва |
Пальмітат |
Жири |
* 17 |
СН3 – (СН2)16 - СООН |
Октадеканова Стеаринова |
Стеарат |
Жири |
Кислоти, що містять більше 10 атомів Карбону, називають
ВИЩИМИ КАРБОНОВИМИ КИСЛОТАМИ
Номенклатура і ізомерія
За міжнародною замісниковою номенклатурою назва кислоти походить від назви відповідного (з тим же числом атомів Карбону) вуглеводня з додаванням закінчення – ова і слова кислота.
Нумерація ланцюга завжди почигається з атома «С» карбоксильної групи, тому в назвах кислот положення групи – СООН не вказують.
Н
 априклад:
О
априклад:
О
7 6 5 4 3 2 1
 СН3
– СН2
– СН2
– СН – СН2
– СН – С
СН3
– СН2
– СН2
– СН – СН2
– СН – С
ОН
С2Н5 СН3
2 Метил 4 етил гептанові кислота
В межах даного класу можлива тільки ізомерія вуглецевого ланцюга. Перші три члена гомологічного ряду ізомерів не мають.
Монокарбонові кислоти ізомерні складним ефірам карбонових кислот:
С2Н4О2

 О
О
О
О
СН3 – С Н – С

 ОН
О – СН3
ОН
О – СН3
Оцтова к-та Метилформіат (складний ефір)
Електронна будова
 σ-
σ-
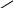
 σ+
О
σ+
О

 R
– С ..
σ+
R
– С ..
σ+
 О
Н
О
Н
..
Карбоксильна група містить високо поляризовану карбонільну групу >С = О. Атом «С» карбонільної групи, маючи частковий позитивний заряд, відтягує на себе електрони зв’язку С – О. Неподілена пара електронів атома Оксигену гідроксильної групи взаємодіє з електронами π –зв’язку карбонільної групи. Це призводить до більшого відтягування електронів від атома «Н» гідроксильної групи і збільшення полярності зв’язку О – Н в порівнянні зі спиртами.
Кислоти на відміну від спиртів дисоціюють з утворенням катіонів Н+.


 О
О С
С С
С ОН
ОН


 СООН
СООН