
- •Гидролиз
- •Сильные электролиты.
- •Электрохимия
- •Гальванические элементы.
- •Лабораторная работа № 2 Гальванические элементы.
- •Коррозия металлов
- •Влияние водородного показателя на скорость коррозии.
- •Способы защиты металлов от коррозии.
- •Лабораторная работа №3 Коррозия металлов
- •Электролиз
- •Второй закон Фарадея.
- •Правила написания уравнений электролиза для водных растворов.
Диссоциация воды. Водородный показатель.
Вода является очень слабым электролитом. (Электролит – вещество, раствор или расплав которого проводит электрический ток). Вода диссоциирует (распадается) на составляющие ее ионы:
H2O ↔ Н+ + ОН-
Ионное произведение воды КW =[ Н+] · [ОН-] = 10 -14 =const (в квадратных скобках условно указана молярная концентрация ионов моль/л). На практике применяют водородный показатель для определения среды. Водородный показатель – отрицательный десятичный логарифм молярной концентрации ионов водорода: рН= - lg [ Н+] и находится в пределах 0<рН<14
Ионы в растворе |
среда |
рН |
[ Н+] > [ОН-] |
Кислая |
рН< 7 |
[ Н+] = [ОН-]=10-7моль/л |
Нейтральная |
рН= - lg [ Н+] = - lg10-7 = - ( - 7) = 7 |
[ОН-] >[ Н+] |
Щелочная |
pH > 7 |
где |
рН |
где |
рН |
желудок |
1-2 |
Дождь |
5,5-6,5 |
кишечник |
8,5 - 9 |
Водопроводная вода |
6-6,5-7 |
кожа |
5,5 -6 |
Морская вода |
8-8,5 |
кровь |
7,35-7,45 |
Почва |
4-10 |
Гидролиз
Взаимодействие ионов соли с ионами воды, при котором происходит изменение водородного показателя рН, называется гидролизом. Это обратимая реакция.
Если при растворении соли рН не меняется (остается рН=7), то гидролиз не происходит.
Наличие в соли слабого иона обуславливает гидролиз - именно слабый ион присоединяет к себе противоположно заряженный ион воды, образуя при этом новую частицу (с зарядом или без него), а оставшийся ион воды организует среду: Н+ - кислую, ОН− - щелочную.
Сильные электролиты.
Сильные кислоты |
Сильные основания |
HCl ↔ Н+ + Cl− |
NaOH↔Na+ + ОН− |
H2SO4 ↔ 2 Н+ + SO42− |
KOH↔ K+ + ОН− |
HNO3 ↔ Н+ + NO3− |
|
Если в таблице частицы нет, то это будет слабая частица (слабый ион).
Соль состоит из катиона (положительно ион) и аниона (отрицательно ион):
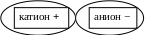
Ме+n К.О.-n (кислотный остаток)
Возможны 4 комбинации соли:
сильный + и сильный −
сильный + и слабый −
слабый + и сильный −
слабый + и слабый −
Рассмотрим реакции с такими вариациями ионов:
1.NaCl + H2O гидролиза нет, так как нет слабой частицы в соли, и не меняется рН (равен 7)

силь+силь
реакция нейтральная, и идет диссоциация на ионы: NaCl + H2O ↔ Na++ Cl−+ H2O
2. гидролиз соды (технической)
N
 a2CO3
+ H2O
↔
a2CO3
+ H2O
↔
сильн+слаб
C



 O32−+
Н+ОН- ↔ Н+CO32−
− + ОН- среда щелочная,
рН>7 , нужно далее написать в молекулярном
виде
O32−+
Н+ОН- ↔ Н+CO32−
− + ОН- среда щелочная,
рН>7 , нужно далее написать в молекулярном
виде



N a2CO3 + H2O ↔ Na+ Н+CO32− О + Na+ОН- О
3. Гидролиз сульфата цинка
Z nSO4 + H2O ↔
слаб+сильн
Zn+2 + Н+ОН- ↔ Zn+2ОН- + + Н+ среда кислая, рН<7, нужно далее написать в молекулярном виде


2ZnSO4 +2H2O ↔ ( Zn+2ОН- )+2 SO42- О + Н2+ SO42- О
4. гидролиз карбоната алюминия идет до конца, так как соль составлены из двух слабых частиц.
Al2(СO3)3 + 6H2O ↔ 2Al(OH)3 + 3H2CO3
Электрохимия
Если пластину металла поместить в раствор его соли, то на границе твердой и жидкой фаз образуется двойной электрический слой, величину которого оценивают значением электродного потенциала φ. Для многих металлов электродные потенциалы определены с помощью водородного электрода, потенциал которого принят равным нулю φ=0. Данные электродных потенциалов представлены в таблице №3 Приложения в методике 4/23/2 «Рабочая программа и задание для контрольной работы».
ОТКРЫТЬ ТАБЛИЦУ. Электродные потенциалы со знаком «минус» относятся к тем металлам, которые вытесняют водород из кислот. В заголовке таблицы – «Стандартные электродные потенциалы» соответствуют потенциалам, определенных в стандартных условиях: температура t =250C (Т = 298 К), давление Р = 1 атм, концентрация раствора, в который погружен электрод С = 1 моль/л. φ0 --- ст. усл.
Ч ем
меньше электродный потенциал φ, тем
активнее металл, тем большим восстановителем
он является.
ем
меньше электродный потенциал φ, тем
активнее металл, тем большим восстановителем
он является.
Пример. Какой металл более активный цинк или алюминий? Ответ: Алюминий, так как его потенциал (по таблице №3) меньше, чем у цинка.
