
- •Путь от руды к железу, чугуну и стали
- •1. Восстановление оксидов железа с получением твердого, прямовосстановленного (губчатого) железа с последующим переплавом его в сталь.
- •2. Восстановление оксидов железа с получением жидкого чугуна [доменный процесс, процесс Корекс (Соrех)] с последующим переделом жидкого или твердого чугуна в сталь.
- •Металлургия железа
- •Процесс мидрекс
- •2. Процесс хил
- •Глава 5. Металлургия чугуна
- •5.1. Устройство доменной печи
- •Профиль печи
- •Фундамент печи
- •Горны доменной печи
- •Кожух, футеровка, охлаждение
- •Колошниковое устройство
- •Загрузка шихты в доменную печь
- •2. Устройство доменного цеха
Lecture # 3
Путь от руды к железу, чугуну и стали
Как уже было сказано, главными соединениями железных руд являются оксиды железа. Они смешаны с пустой породой. После обогащения, получения концентрата и его окускования агломерат, окатыши и скрап становятся исходными продуктами для получения железа (железной губки), чугуна и стали. Для этого необходимо отнять кислород у оксидов железа. Отъем кислорода из оксида называют восстановлением. Восстановление металлов -это химическая реакция, состоящая в присоединении электронов ионом металла:
![]()
Восстановительные реакции протекают одновременно с окислительными, при которых элементы - восстановители (В) отдают электроны (окисляются):
![]()
В общем виде процесс выражают уравнением:
![]()
где G° - изменение энергии Гиббса реакции при стандартных условиях.
Восстановителем выступает элемент или соединение, обладающее большим химическим сродством к кислороду, чем оксид металла. Мерой химического сродства к кислороду служит изменение стандартной энергии Гиббса реакции окисления:
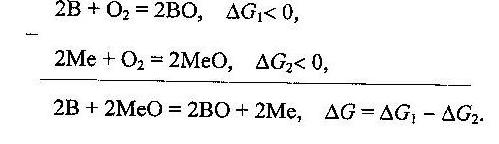
Если G1< G2, G< 0, то вещество В может выступать восстановителем оксида металла МеО.
В металлургической практике в качестве восстановителей В используют специально приготовленный восстановительный газ, состоящий из СО и Н2, или углерод, или металлы (Si, Аl и др.).
Процессы восстановления с участием газов называют газовыми, с участием углерода - углетермическими (карботермичеcкими), а с участием металлов - металлотермическими (соответственно силикотермическими и алюмотермическими).
Железо в зависимости от валентности может образовывать три оксида: Fе2Оз (высший оксид), Fе3О4 (средний оксид) и FеО (низший оксид); последний может существовать только при температуре > 570 °С. По теории академика А. А. Байкова, восстановление оксидов железа протекает ступенчато: от высших к низшим. При температуре более 570 °С восстановление проходит стадии: Fе2О3 -> Fе3О4 -> FеО->Fе. При температуре менее 570 °С имеют место следующие стадии: Fе2О3 -> Fе3О4 -> Fе.
Восстановление оксидов железа с участием газов СО и Н2 называют косвенным, а с участием твердого углерода - прямым.
Реакции косвенного восстановления:
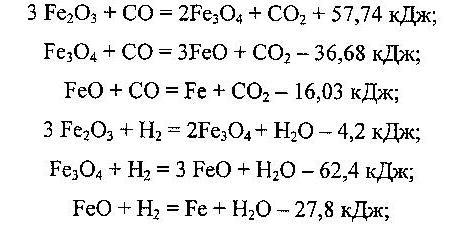
Реакция прямого восстановления:
![]()
Цель восстановления железорудных материалов - получение прямовосстановленного железа (губчатого железа и металлизованных окатышей) или чугуна как предварительной ступени производства стали.
У зависимости от цены на кокс, уголь, природный газ, чугун, скрап, электроэнергию и наличия исходных материалов выбирают тот или иной способ производства стали.
Идеальный способ получения стали - это непосредственное получение стали необходимых состава и свойств из руды. Однако технически сегодня это невозможно.
В настоящее время существует два пути получения стали из руды:
1. Восстановление оксидов железа с получением твердого, прямовосстановленного (губчатого) железа с последующим переплавом его в сталь.
Передел твердого прямовосстановленного (губчатого) железа в сталь ведут в дуговых электропечах.
