
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.т.н. Ю.Перелыгин
«____»______________ 2013 г.
ТЕКСТ ЛЕКЦИИ № 7
по дисциплине «Химия»
по специальности 200100 «Приборостроение
Тема № 4. Растворы. Дисперсные системы
Занятие №1. Растворы неэлектролитов
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2013 г., протокол №_____
г. Пенза
Содержание
Введение
1. Общие сведения о растворах.
2. Способы выражения концентраций растворов.
3. Физическая теория растворов.
4. Диффузия. Осмос. Осмотическое давление.
5. Понижение давления насыщенного пара. Первый закон Рауля.
6. Замерзание и кипение растворов. Следствие из закона Рауля.
Заключение.
Литература:
1. Коровин Н.В. Общая химия. Учебник. – М.: Высшая школа, 1998. – с. 204 - 210.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
Цель занятия:
Знать: 1. Способы выражения концентраций растворов (молярная, моляльная, массовая доля, мольная доля, молярная концентрация эквивалента).
2. Механизм процесса растворения. Современная теория растворов. Сольваты. Гидраты.
3. Идеальные растворы и их свойства. Осмотическое давление растворов, закон Вант-Гоффа.
4. Закон Рауля и следствие из него. Криоскопия и эбулиоскопия.
Ознакомиться: с растворимостью твердых, жидких, газообразных веществ, законом Генри-Дальтона; с тепловым эффектом растворения и зависимостью растворимости от температуры.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы на примерах применения растворов в технике.
4.Рассмотреть учебные вопросы с применением кадров презентации.
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
Введение
Очень многие химические реакции, в том числе технические и жизненно важные, протекают в жидких растворах. Так как на равновесие и кинетику этих реакций оказывает влияние растворитель, то процессы в растворах имеют свои особенности.
1. Общие сведения о растворах
Раствором называется термодинамически устойчивая система гомогенного состава, состоящая из двух или большего числа компонентов.
Компонентами раствора являются растворитель и растворенные вещества.
Растворителем считается тот компонент, агрегатное состояние которого не изменяется.
Например, в одном литре воды можно растворить два килограмма сахара, но все равно растворителем при этом считается вода, а не сахар, так как образующийся раствор – жидкий.
Если растворитель и растворенное вещество находятся в одном агрегатном состоянии, растворителем считают тот компонент, которого больше.
Тем
не менее, профессиональные химики
считают растворителем воду, независимо
от того, в каком количестве она содержится
в растворе. Например, медицинский спирт
содержит 96 (точнее, 95,5
(точнее, 95,5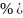 этилового спирта и 4
воды. Химик скажет, что в этом случае
растворителем является вода, а медицинский
работник назовет растворителем спирт.
этилового спирта и 4
воды. Химик скажет, что в этом случае
растворителем является вода, а медицинский
работник назовет растворителем спирт.
Количественный состав раствора определяется его концентрацией.
2. Способы выражения концентраций раствора
Способ выражения концентрации
|
Математическое выражение |
Расчетная формула |
1. Процентная концентрация или массовая доля Обозначается
|
|
|
2. Молярная концентрация или молярность Обозначается
Примеры. 1M H2SO4 – одномолярный раствор серной кислоты; 0,1М – децимолярный р-р; 0,01М – сантимолярный; 0.001М - миллимолярный |
Если
Молярная концентрация показывает, сколько молей растворенного вещества содержится в одном литре раствора |
|
3. Нормальная концентрация или нормальность Обозначается
Пример. 1н. NaOH – однонормальный раствор гидроксида натрия; 0,1н. – децинормальный р-р; 0,01н. – сантинормальный; 0.001н. - миллинормальный |
Если
= 1 л,
Нормальная концентрация показывает, сколько молей эквивалентов растворенного вещест-ва содержится в одном литре раствора |
|
4. Молярная (мольная) доля Обозначается x или N |
|
|
5. Моляльная концентрация или моляльность. Обозначается
|
Если
Моляльная концентрация показывает, сколько молей растворенного вещества приходится на один литр раствори-теля |
|
Задача 1. К 8 л воды добавили 2 л этилового спирта плотностью 0,8 г/мл. Рассчитать моляльную концентрацию раствора.
Решение. Расчет ведем по формуле:

1) ⇒
⇒


2)
M(
3)
m( = 8000 г (так как
= 8000 г (так как
 ).
).
4)
m
=
 = 4,35 моль/1000 г
= 4,35 моль/1000 г
 .
.




 .
.
 = 1 л,
= 1 л,



 .
.

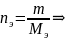


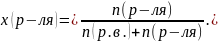




 = 1 кг,
= 1 кг,

