
- •Введение
- •1.Классификация химических реакций
- •2.Степень окисления элементов
- •2.1. Определение степени окисления
- •2.2. Элементы с постоянной степенью окисления
- •2.3. Элементы с переменной степенью окисления
- •2.4. Степень окисления с.О. Не всегда совпадает с валентностьюВ
- •2.5. Степень окисления может выражаться дробным числом:
- •3. Окислительно-восстановительные реакции
- •4. Окислительно-восстановительные свойства элемента в зависимости от степени окисления
- •5. Изменение окислительно-восстановительных свойств элементов (простых веществ) в периодической системе
- •6. Важнейшие окислители и восстановители
- •8. Классификация окислительно-восстановительных рекаций
- •8.1. Реакции межмолекулярного окисления-восстановления:
- •8.2. Реакции внутримолекулярного окисления-восстановления:
- •9. Влияние среды на направление овр
- •Заключение
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.т.н. Ю.Перелыгин
«____»______________ 2012 г.
ТЕКСТ ЛЕКЦИИ № 10
по дисциплине «Химия»
по специальности 200100 «Приборостроение»
Тема № 6. Окислительно-восстановительные реакции. Основы электрохимии
Занятие № 1. Окислительно-восстановительные реакции
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2012 г., протокол №_____
г. Пенза
Содержание
Введение
1. Классификация химических реакций.
2. Степень окисления химических элементов.
3. Процессы окисления и восстановления. Окислитель и восстановитель.
4. Окислительно-восстановительные свойства элемента в зависимости от степени окисления.
5. Изменение окислительно-восстановительных свойств элементов в периодической системе.
6. Важнейшие окислители и восстановители.
7. Составление уравнений ОВР методом электронного баланса.
8. Классификация ОВР.
9. Влияние среды на направление ОВР.
Заключение
Литература:
Коровин Н.В. Общая химия. Учебник. – М.: Высшая школа, 1998. – с. 251 - 260.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
2. Оборудование и реактивы для демонстрации опытов «Химический вулкан» и «Выведение пятен от иодной настойки».
Цель занятия:
Знать: 1. Степень окисления. Связь между степенями окисления элемента и его положением в периодической системе.
2. Окислительно-восстановительная двойственность. Вещества, способные проявлять свойства и окислителей, и восстановителей.
3. Окислительно-восстановительные реакции (ОВР). Типы окислительно-восстановительных реакций. Влияние среды на направление протекания ОВР.
Уметь: составлять уравнения ОВР методом электронного баланса.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы.
4.Рассмотреть учебные вопросы с применением кадров презентации и использованием демонстрационных опытов.
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
Введение
Окислительно-восстановительные реакции, сопровождающиеся перемещением электронов от одних частиц к другим, играют важную роль в природе и технике. В качестве примеров окислительно-восстановительных процессов, протекающих в природных биологических системах, можно привести реакцию фотосинтеза у растений и процессы дыхания у животных и человека. Процессы горения топлива, протекающие в топках котлов тепловых электростанций и в двигателях внутреннего сгорания ракет, являются примерами технически важных окислительно-восстановительных реакций. Не будет преувеличением утверждать, что не существует такой области техники, где не были бы задействованы окислительно-восстановительные процессы, и знание основных закономерностей протекания этих процессов является необходимым для будущего инженера.
1.Классификация химических реакций
Химическая реакция – это взаимодействие реальных частиц (молекул, ионов, атомов), которое приводит к изменению их физико-химических свойств без изменения природы химических элементов.
В ходе химической реакции одни вещества (исходные, реагенты) превращаются в другие (продукты реакции).
Реакции неорганической химии классифицируются по признаку изменения числа реагентов и продуктов. Согласно этой классификации различают:
1) реакции разложения, в которых из одного исходного вещества образуется несколько продуктов реакции.
Пример.

2) реакции соединения, в которых из нескольких реагентов образуется один продукт.
Пример.
 ;
;
3) реакции замещения – реакции, в которых часть сложного вещества замещается простым веществом.
Пример
.
4) реакции обмена – реакции, в которых реагенты обмениваются своими составными частями.
Пример.
Если в обмене участвуют протоны и гидроксильные группы, то такие реакции называют кислотно-основными или реакциями нейтрализации.
Одна и та же реакция может относиться одновременно к разным типам, в зависимости от признака, по которому проводят классификацию.
В отдельный класс выделяют окислительно-восстановительные реакции, сопровождающиеся переносом электронов и приводящие к изменению степеней окисления атомов, входящих в состав реагентов.

2.Степень окисления элементов
2.1. Определение степени окисления
В таблице (см ниже) представлены схемы образования хлора, хлороводорода и хлорида натрия.

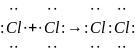
 КНС
КНС


 КПС
КПС

 ИС
ИС
Каковы заряды атомов водорода, хлора и натрия в этих соединениях?
В молекуле хлора, состоящей из одинаковых атомов, электронная пара в равной степени принадлежит обоим атомам. Следовательно, и заряд атомов в молекуле остается таким же, как и был, то есть равным нулю.
В кристалле хлорида натрия также происходит завершение электронного слоя у атома хлора, но здесь недостающий электрон атом хлора полностью оттягивает на себя. Образуется ион хлора с зарядом -1 (заряд иона натрия+1)
Сложнее обстоит дело с молекулой хлороводорода. Общая электронная пара здесь лишь частично оттянута от атома водорода к атому хлора, и точный заряд атома хлора без специальных исследований предсказать невозможно. Но мы можем вычислить условный заряд атома хлора, предположив, что атом хлора полностью присоединил к себе электрон от атома водорода. Вот этот условный заряд элемента, вычисленный, исходя из предположения, что соединение состоит из ионов, и называется степенью окисления.
Степень окисления (с.о.) элемента – это условный заряд, который приобрел бы атом, если бы электроны, участвующие в образовании химической связи, были бы полностью смещены к более электроотрицательному атому.
Значение степени окисления определяется числом электронов, смещенных от атома данного элемента (положительная с.о.) к атому другого элемента (отрицательная с.о.).
