
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.т.н. Ю.Перелыгин
«____»______________ 2013 г.
ТЕКСТ ЛЕКЦИИ № 6
по дисциплине «Химия»
по специальности «
Тема № 6. Растворы. Дисперсные системы
Занятие №1. Гидролиз солей
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2013 г., протокол №_____
г. Пенза
Содержание
Введение
1.Произведение растворимости.
2.Диссоциация воды. Водородный показатель.
3. Гидролиз солей.
4. Количественные характеристики гидролиза.
Литература:
Коровин Н. В. Общая химия: Учеб. для технических направ. и спец. вузов. – М.: Высш. школа, 1998. – с. 224 - 238.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
2. Химические стаканы на 100 мл (9 шт.), капельницы с растворами индикаторов: лакмоида (или лакмуса), метилового оранжевого, фенолфталеина; растворы соляной кислоты, гидроксида натрия, дистиллированная вода.
Цель занятия:
Знать: 1.Гидролиз солей.
2. Константу и степень гидролиза.
Ознакомиться: с применением гидролиза.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы.
4.Рассмотреть учебные вопросы с применением кадров презентации и использованием демонстрационного опыта «Свойства индикаторов».
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
Введение
В предыдущей лекции мы говорили о том, что в случае реакций нейтрализации, в которых участвуют слабые кислоты и основания, реакции протекают не до конца. Значит, при этом в той или иной степени протекает и обратная реакция: взаимодействие соли с водой, - приводящая к образованию кислоты и основания. Этот процесс называется гидролизом соли. Для понимания процессов, протекающих при гидролизе необходимо предварительно рассмотреть диссоциацию воды.
2. Ионное произведение воды. Водородный показатель
Вода, хоть и в незначительной степени, но все же диссоциирует на ионы. Процесс диссоциации воды протекает в две стадии:
I H2O ⇄ H+ + OH− Эндометрический процесс
II H+ + H2O → H3O+ Экзотермический процесс
Последний процесс называется самоионизацией или автопротолизом воды, а ион H3O+, образующийся в результате автопротолиза, называют ионом гидроксония.
Реакцию воды обычно записывают в более простом виде:
Н2О ⇄ Н+ + ОН−.
Запишем для уравнения диссоциации воды константу диссоциации:

[
где
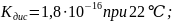
[ – молярная концентрация воды, которая
показывает, сколько молей воды содержится
в одном литре воды и рассчитывается по
формуле
– молярная концентрация воды, которая
показывает, сколько молей воды содержится
в одном литре воды и рассчитывается по
формуле
[
Пусть имеется 1л воды; масса одного литра воды составляет 1000г; молярная масса воды - 18 г/моль.

Окончательно
получим:
 =
=

Величина
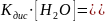 называется ионным произведением воды
и обозначается
называется ионным произведением воды
и обозначается

При
 (1)
(1)
Как
и всякая константа равновесия,
 не зависит от концентраций ионов H+
и OH−
в растворе. Так, например, если в воду
добавить кислоты, концентрация ионов
водорода резко возрастет. Тогда за счет
подавления диссоциации воды равновесие
процесса Н2О
⇄
Н+
+ ОН−
сместится влево и концентрация ионов
OH−
а растворе уменьшится. Ионное же
произведение воды останется по-прежнему
неизменным.
не зависит от концентраций ионов H+
и OH−
в растворе. Так, например, если в воду
добавить кислоты, концентрация ионов
водорода резко возрастет. Тогда за счет
подавления диссоциации воды равновесие
процесса Н2О
⇄
Н+
+ ОН−
сместится влево и концентрация ионов
OH−
а растворе уменьшится. Ионное же
произведение воды останется по-прежнему
неизменным.
Пример
.Если
 ,
чему равна концентрация гидроксид-ионов
в растворе?
,
чему равна концентрация гидроксид-ионов
в растворе?

Концентрации как ионов водорода, так и гидроксид-ионов могут изменяться на много порядков, что осложняет работу с этими числами. Поэтому, чтобы описать кислотность раствора, вместо того, чтобы говорить о молярной концентрации ионов водорода, мы, как правило, используем более удобный масштаб водородного показателя pH. pH раствора определяется как отрицательный десятичный логарифм концентрации иона водорода (в моль/л).

Водородный
показатель

 +
+
Гидроксидный
показатель
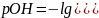
Пример .Если , чему равна концентрация гидроксид-ионов в растворе?
Если = , среда нейтральная, = 7.
Этот вывод нетрудно сделать, рассмотрев следующие преобразования:
=
= =
=
 ⇒
⇒
Если
,
среда
кислая, 7.
7.
Вывод получаем в результате преобразований:
=
⇒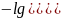
Если
,
среда
щелочная,
 7.
7.
Преобразования аналогичны предыдущим:
= ⇒
Пример
.Если
,
чему равны
и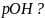
5 + 9 = 14
Измеряют рН с помощью специальных приборов – рН-метров, либо с помощью индикаторов.
Открытие индикаторов приписывают английскому химику и физику Роберту Бойлю, жившему в семнадцатом веке. Как то Бойль приготовил водный настой лакмусового лишайника. Затем склянка, в которой он хранил настой, понадобилась для хлороводородной кислоты. Вылив настой, Бойль залил в склянку кислоту и с удивлением обнаружил, что кислота стала красной. Тогда он добавил несколько капель настоя к водному раствору гидроксида натрия и увидел, что раствор стал синим. Так был открыт первый кислотно-основный индикатор, названный лакмусом. Впоследствии Бойль, а затем и другие исследователи стали пользоваться бумажками, пропитанными настоем лакмусового лишайника и затем высушенными. Лакмусовые бумажки становились синими в щелочном растворе и красными – в кислом.
Но лакмус – не единственное растение, которое изменяет свой цвет в кислой и щелочной средах. Точно также ведет себя большинство растений, которые имеют фиолетовый или красный цвет. Так, например, краснокочанная капуста при подкислении уксусом изменяет цвет с фиолетового на ярко-красный, а при подщелачивании нашатырным спиртом приобретает сине-зеленую окраску, которая со временем переходит в желтую. В качестве индикаторов можно использовать и чернику, и черносмородиновое варенье, и виноградный сок. Однако, полученные окрашенные растворы очень неустойчивы, поэтому в лабораториях вместо растительных индикаторов используют синтетические, растворы которых могут сохранять свою окраску гораздо дольше.
Важнейшие индикаторы
Название индикатора |
Окраска индикатора в различных средах |
||
В кислой |
В нейтральной |
В щелочной |
|
Лакмус |
Красный |
Фиолетовый |
Синий |
Метилоранж |
Красный |
Оранжевый |
Желтый |
Фенолфталеин |
Бесцветный |
Бесцветный |
Малиновый |
