- •Процессы окисления
- •Характеристика процессов окисления Определение и классификация реакций окисления
- •Окислительные агенты и техника безопасности в процессах окисления Окислительные агенты
- •Молекулярный кислород
- •Азотная кислота
- •Пероксидные соединения
- •Техника безопасности процессов окисления
- •Энергетическая характеристика реакций окисления
- •Радикально-цепное окисление
- •Кинетика и катализ реакции радикально-цепного окисления
- •2Roo молекулярные продукты
- •2Rсоoo молекулярные продукты
- •Селективность окисления
- •Реакторы процессов жидкофазного окисления
- •Окисление углеводородов в гидропероксиды. Синтез фенола и ацетона
- •Получение гидропероксидов
- •Кислотное разложение гидропероксидов
- •Окисление парафинов
- •Окисление низших парафинов в газовой фазе
- •Окисление н-парафинов в спирты
- •Окисление парафинов в карбоновые кислоты
- •Окисление парафинов с4с8
- •Окисление твердого парафина в сжк
- •Окисление нафтенов и их производных
- •Циклоалканы и дикарбоновые кислоты
- •Окисление нафтенов в спирты и кетоны
- •Каталитическое окисление
- •Термическое окисление циклоалканов в присутствии борной кислоты
- •Получение дикарбоновых кислот
- •Окисление метилбензолов в ароматические кислоты
- •Производство диметилтерефталата
- •Одностадийное окисление метилбензолов в растворе уксусной кислоты
- •Окисление насыщенных альдегидов и кислот Окисление альдегидов
- •Синтез уксусной кислоты
- •Совместный синтез уксусной кислоты и уксусного ангидрида
- •Гетерогенно-каталитическое окисление углеводородов и их производных
- •Теоретические основы процесса Гетерогенные катализаторы окисления и механизм реакций
- •Кинетика и селективность гетерогенно-каталитического окисления
- •Реакторы процессов гетерогенно-каталитического окисления
- •Окисление олефинов по насыщенному атому углерода
- •Окисление пропилена в акролеин
- •Получение акриловой кислоты
- •Окислительный аммонолиз углеводородов
- •Синтез синильной кислоты
- •Окислительный аммонолиз олефинов
- •Окислительный аммонолиз метилбензолов
- •Синтез фталевого и малеинового ангидридов
- •Производство фталевого ангидрида
- •Производство малеинового ангидрида
- •Производство этиленоксида
- •Окисление этилена воздухом
- •Окисление этилена кислородом
- •Окисление олефинов в присутствии металлокомплексных катализаторов
- •Эпоксидирование ненасыщенных соединений
- •Эпоксидирование гидропероксидами
- •Технология совместного синтеза пропиленоксида и стирола
- •Окисление и окислительное сочетание олефинов при катализе комплексами металлов Синтез карбонильных соединений
- •Производство ацетальдегида из этилена
- •Синтез винилацетата из этилена (метод ацетоокисления)
- •Литература
- •Содержание
Окисление углеводородов в гидропероксиды. Синтез фенола и ацетона
Гидропероксиды применяются как промежуточные продукты (например, в производстве фенола и ацетона), инициаторы полимеризации, в процессах эпоксидирования олефинов:
ООН

C6H5CH(CH3)2
C6H5C(CH3)2
![]() C6H5OH
+ CH3COCH3
C6H5OH
+ CH3COCH3

RH
ROOH
![]() ROH + CH3CHCH2O
ROH + CH3CHCH2O
Получение гидропероксидов
В промышленности в наиболее крупных масштабах получают гидропероксид изопропилбензола (кумола), в менее значительных – гидропероксиды мета- и пара-цимола (изопропилтолуола) и мета- и пара-диизопропилбензола для их последующего превращения в фенол, мета- и пара-крезол, резорцин, гидрохинон. Для эпоксидирования олефинов используют, главным образом, гидропероксиды этилбензола и изобутана. Все они являются относительно стабильными веществами. При получении концентрированных гидропероксидов (80-95 %) требуются специальные меры безопасности: отсутствие перегревов и катализаторов разложения – металлов переменной валентности и их солей, кислот.
При окислении углеводородов гидропероксды образуются по радикально-цепному механизму. Ингибиторы (фенол, олефины, серосодержащие соединения) сильно тормозят процесс, поэтому исходные углеводороды должны быть тщательно очищены от нежелательных примесей.
Изопропилбензол, полученный алкилированием в присутствии твердого фосфорно-кислого катализатора, не пригоден для окисления. Для уменьшения индукционного периода добавляют в исходное сырье гидропероксид. Соли металлов переменной валентности разлагают гидропероксиды, однако в отдельных случаях их небольшие добавки ускоряют реакцию. Такой же эффект оказывает медь, даже если она присутствует в составе металла, идущего на изготовление аппаратуры.
При получении гидропероксидов всегда образуются побочные продукты: спирты, кетоны, диметилфенилкарбинол, ацетофенон, моно- и дигидропероксиды.
Повышению селективности способствует снижение температуры и степени конверсии, параметры поддерживают на оптимальном уровне, зависящем от экономических факторов. Температура составляет 100-1500С, полезно снижать ее по мере накопления гидропероксида, чтобы замедлить его разложение. Степень конверсии составляет от 30 до 10 %.
Для получения алкилароматических гидропероксидов используют реакторы тарельчатого типа (рис.1, г) или каскад окислительных колонн (рис.1, в). Окисление ведут воздухом при давлении 0,3-0,5 МПа для изопропилбензола и 5-8 МПа – для изобутана (в последнем случае давление необходимо для поддержания смеси в жидком состоянии).
Полученный раствор гидропероксида и побочных продуктов в исходном углеводороде обычно “укрепляют” или концентрируют путем отгонки углеводорода.
Кислотное разложение гидропероксидов
Гидропероксиды способны к распаду под влиянием кислотных и щелочных катализаторов. В присутствии уже небольшого количества сильной кислоты (например, 0,1 % H2SO4) гидропероксиды распадаются с образованием фенолов и карбонильных соединений. Получается небольшое количество смол сложного строения. При повышении концентрации кислоты и температуры становится возможным превращение ацетофенона и ацетона в окись мезитила:
2 СН3СОСН3
СН3СОСН3![]() СН3СОСН2С(СН3)2
СН3СОСН=С(СН3)2
СН3СОСН2С(СН3)2
СН3СОСН=С(СН3)2
окись мезитила
ОН
Разложение гидропероксидов характеризуется высокой скоростью: практически полное превращение, в присутствии 0,050,1 %-ной серной кислоты при температуре 50600С, достигается за 23 минуты. Реакция тормозится водой и ускоряется образующимся фенолом.
Ввиду высокой скорости процесса при его промышленной реализации очень важен эффективный отвод большого количества выделяющегося тепла (Q=2080 кДж/кг). Для этой цели применяют разбавители, которыми являются продукты реакции или ацетон.
Для проведения реакции применяют проточно-циркуляционные установки (рис.2, а), когда выделяющееся тепло снимают в трубчатом реакторе за счет охлаждения его водой. Реакционную смесь на выходе из реактора частично отводят на дальнейщую переработку, но основное количество направляют на рециркуляцию: добавляют кислоту, катализатор и в насосе смешивают с исходным гидропероксидом. При такой системе время контакта лимитируется теплоотводом и является завышенным, рециркуляция ведет к повышенному выходу побочных веществ (на 1 т фенола получается 100-150 кг отходов).
Другой способ состоит в проведении реакции в растворе ацетона и отводе тепла за счет его испарения. Ацетон конденсируют в обратном холодильнике и возвращают в реактор, который можно секционировать поперечными перегородками. Это, наряду с уменьшением концентрации фенола в растворе и времени контакта, снижает выход побочных продуктов.

Рис.2. Реакционные узлы для кислотного разложения гидропер-оксидов:
а – проточно-циркуляционная установка; б – установка с отводом тепла за счет испарения ацетона.
Кислотным разложением гидропероксидов получают:
фенол (С6Н5ОН) – промежуточный продукт в производстве красителей, лекарственных и взрывчатых веществ;
гидрохинон, резорцин – применяют для получения легко отверждаемых фенолальдегидных полимеров, ингибиторов;
-нафтол – используется в производстве красителей:
ацетон – является прекрасным растворителем.
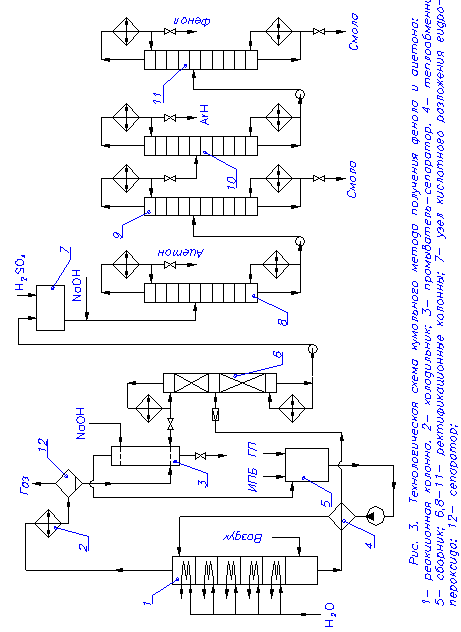
Технологическая схема кумольного метода получения фенола и ацетона представлена на рис.3.