
- •Процессы окисления
- •Характеристика процессов окисления Определение и классификация реакций окисления
- •Окислительные агенты и техника безопасности в процессах окисления Окислительные агенты
- •Молекулярный кислород
- •Азотная кислота
- •Пероксидные соединения
- •Техника безопасности процессов окисления
- •Энергетическая характеристика реакций окисления
- •Радикально-цепное окисление
- •Кинетика и катализ реакции радикально-цепного окисления
- •2Roo молекулярные продукты
- •2Rсоoo молекулярные продукты
- •Селективность окисления
- •Реакторы процессов жидкофазного окисления
- •Окисление углеводородов в гидропероксиды. Синтез фенола и ацетона
- •Получение гидропероксидов
- •Кислотное разложение гидропероксидов
- •Окисление парафинов
- •Окисление низших парафинов в газовой фазе
- •Окисление н-парафинов в спирты
- •Окисление парафинов в карбоновые кислоты
- •Окисление парафинов с4с8
- •Окисление твердого парафина в сжк
- •Окисление нафтенов и их производных
- •Циклоалканы и дикарбоновые кислоты
- •Окисление нафтенов в спирты и кетоны
- •Каталитическое окисление
- •Термическое окисление циклоалканов в присутствии борной кислоты
- •Получение дикарбоновых кислот
- •Окисление метилбензолов в ароматические кислоты
- •Производство диметилтерефталата
- •Одностадийное окисление метилбензолов в растворе уксусной кислоты
- •Окисление насыщенных альдегидов и кислот Окисление альдегидов
- •Синтез уксусной кислоты
- •Совместный синтез уксусной кислоты и уксусного ангидрида
- •Гетерогенно-каталитическое окисление углеводородов и их производных
- •Теоретические основы процесса Гетерогенные катализаторы окисления и механизм реакций
- •Кинетика и селективность гетерогенно-каталитического окисления
- •Реакторы процессов гетерогенно-каталитического окисления
- •Окисление олефинов по насыщенному атому углерода
- •Окисление пропилена в акролеин
- •Получение акриловой кислоты
- •Окислительный аммонолиз углеводородов
- •Синтез синильной кислоты
- •Окислительный аммонолиз олефинов
- •Окислительный аммонолиз метилбензолов
- •Синтез фталевого и малеинового ангидридов
- •Производство фталевого ангидрида
- •Производство малеинового ангидрида
- •Производство этиленоксида
- •Окисление этилена воздухом
- •Окисление этилена кислородом
- •Окисление олефинов в присутствии металлокомплексных катализаторов
- •Эпоксидирование ненасыщенных соединений
- •Эпоксидирование гидропероксидами
- •Технология совместного синтеза пропиленоксида и стирола
- •Окисление и окислительное сочетание олефинов при катализе комплексами металлов Синтез карбонильных соединений
- •Производство ацетальдегида из этилена
- •Синтез винилацетата из этилена (метод ацетоокисления)
- •Литература
- •Содержание
Гетерогенно-каталитическое окисление углеводородов и их производных
Гетерогенно-каталитическое окисление приобрело большое значение при осуществлении ряда процессов, которые нельзя успешно реализовать при помощи радикально-цепных реакций окисления. Среди них важнейшими являются следующие:
Окисление олефинов и их производных по насыщенному атому углерода с сохранением двойной связи:
СН2=СН-СН3 + О2 СН2=СНСНО + Н2О
Окислительный аммонолиз парафинов и других углеводородов с получением нитрилов:
RCH3 + NH3 + 1,5O2 RCN + 3Н2О
Окисление ароматических и других углеводородов с образованием внутренних ангидридов ди- или тетракарбоновых кислот:
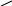 СО
СО

 НС
НС
 +
4,5О2 О
+ 2CO2 + H2O
+
4,5О2 О
+ 2CO2 + H2O
 НС
НС
СО
Прямой синтез этиленоксида:

СН2=СН2 + 0,5О2 СН2-СН2О
Все эти процессы имеют очень большое практическое значение, так как получаемые продукты широко используются в качестве мономеров (акриловая, метакриловая кислоты, акрилонитрил, малеиновый и фталевый ангидрид) и промежуточных продуктов для синтеза пластификаторов, растворителей и других мономеров (фталевый ангидрид, этиленоксид, нитрилы, акролеин).
Теоретические основы процесса Гетерогенные катализаторы окисления и механизм реакций
Применяются следующие катализаторы:
Металлы меди и серебра, из которых более легко окисляющаяся медь функционирует в виде оксидов, образующихся в поверхностном слое. Другие металлы (платина, палладий) приводят к полному окислению до СО2 и воды.
Оксиды переходных металлов Cu+Cu2O, V2O5, другие оксиды неактивны или способствуют полному окислению.
Смеси оксидов и соли переходных металлов, особенно ванадаты, станнаты, вольфраматы, молибдаты Zn, Co, Bi (ZnOV2O5, CoOWO3, Bi3O3MoO3), но ферриты и хромиты вызывают полное окисление.
Катализатор применяют в виде стружек, сеток (Cu), зерен (V2O5) или нанесенными на пористый носитель (Ag, CuO, соли), нередко с добавками различных промоторов.
В механизме гетерогенных реакций окисления важную роль играет адсорбция реагентов на поверхности контакта. На металлах кислород сорбируется очень быстро, с последующим более медленным проникновением в приповерхностный слой. Неблагородные металлы в результате дают оксиды, а для серебра процесс ограничивается хемосорбцией с глубоким изменением свойств приповерхностного слоя. Кислород сорбируется на контакте без диссоциации или с диссоциацией молекулы, причем металл поставляет требуемые электроны и переводит адсорбируемый кислород в состояние ион-радикала:
Ag +
O2
![]()
![]()
![]()
Подобная хемосорбция кислорода осуществляется на оксидных и солевых катализаторах.
Углеводороды сорбируются на металлах сравнительно слабо и обратимо. Прочнее они сорбируются на оксидных и солевых катализаторах:
М(n+1)+
+ CH2=CHCH3
Mn+CH2![]() CH3
CH3
Имеются два главных типа механизма гетерогенно-каталитического окисления. В одном из них углерод сорбируется на окисленной поверхности катализатора, вначале сорбируясь по ион-радикалу кислорода, а затем, взаимодействуя с ним, с образованием продуктов окисления. Типичным примером является синтез этиленоксида:
![]()
 +
CH2=CH2
AgOOCH2
+
CH2=CH2
AgOOCH2![]()
![]() + CH2CH2O
+ CH2CH2O
Тот же механизм при окислении бензола в малеиновый ангидрид, идущего через промежуточное образование хинона:

![]() ОО
+
ОО
ОО
+
ОО
![]() ОО
ОО
ОО
ОО
СО
НС
![]() О
= = О
О
= = О
![]()
СО
Другой распространенный механизм – окислительно-восстанови-тельный. На ионе металла сорбируется углерод и он окисляется кислородом решетки катализатора, металл при этом восстанавливается в низшее валентное состояние и затем вновь взаимодействует с кислородом, переходит в первоначальную форму:
2КО + СН2=СН-СН3 2К + СН2=СН-СНО + Н2О
2К + О2 2КО
Этот механизм характерен для окисления олефинов и метилбензолов. Он подтверждается тем, что ожидаемые продукты могут получаться на катализаторе в отсутствие кислорода, а стадии окисления углеводорода и окисления катализатора можно проводить раздельно. Однако точно представить их картину не возможно, так как еще неясны строение поверхностных продуктов и их роль в окислении.
