- •Лекция 26. Шестичленные гетероциклические соединения с одним гетероатомом
- •Пиридин
- •Конденсация ацетальдегида и формальдегида с аммиаком:
- •I. Реакции, протекающие с участием гетероатома
- •Взаимодействие с алкил- и ацилгалогенидами. В этих реакциях пиридин образует четвертичные соли n-алкил- и n-ацилпиридиния соответственно.
- •Важнейшие производные пиридина пиколины
- •Гидроксипиридины
- •Аминопиридины
- •Пиридинкарбоновые кислоты
- •Пиперидин
- •Кислородсодержащие шестичленные гетероциклы с одним гетероатомом
- •Кумарин
Взаимодействие с алкил- и ацилгалогенидами. В этих реакциях пиридин образует четвертичные соли n-алкил- и n-ацилпиридиния соответственно.
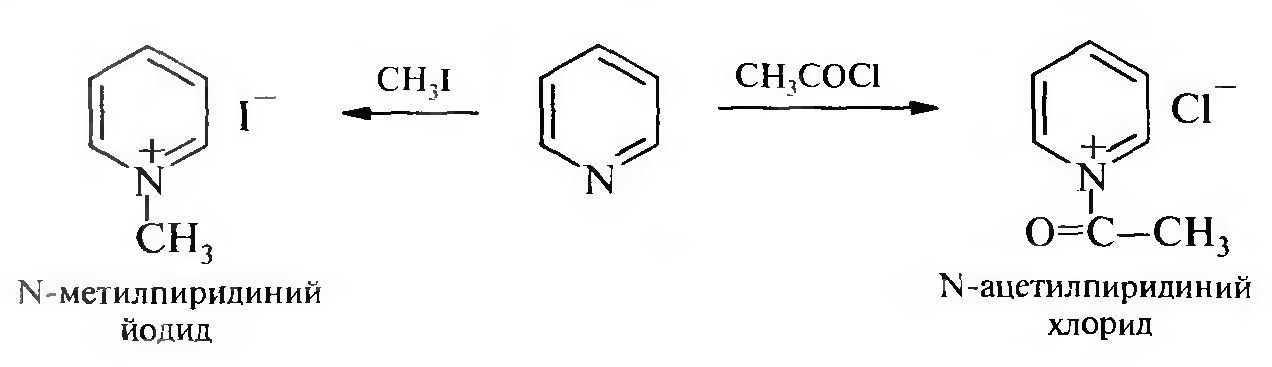
Реакции взаимодействия пиридина с алкил- и ацилгалогенидами указывают на нуклеофильные свойства пиридинового атома азота. Соли N-ацилпиридиния используются как ацилируюшие реагенты.
II.Реакции замещения атомов водорода пиридинового ядра
Для пиридина характерны как реакции электрофильного замещения (SE), так и нуклеофильного замещения (SN).
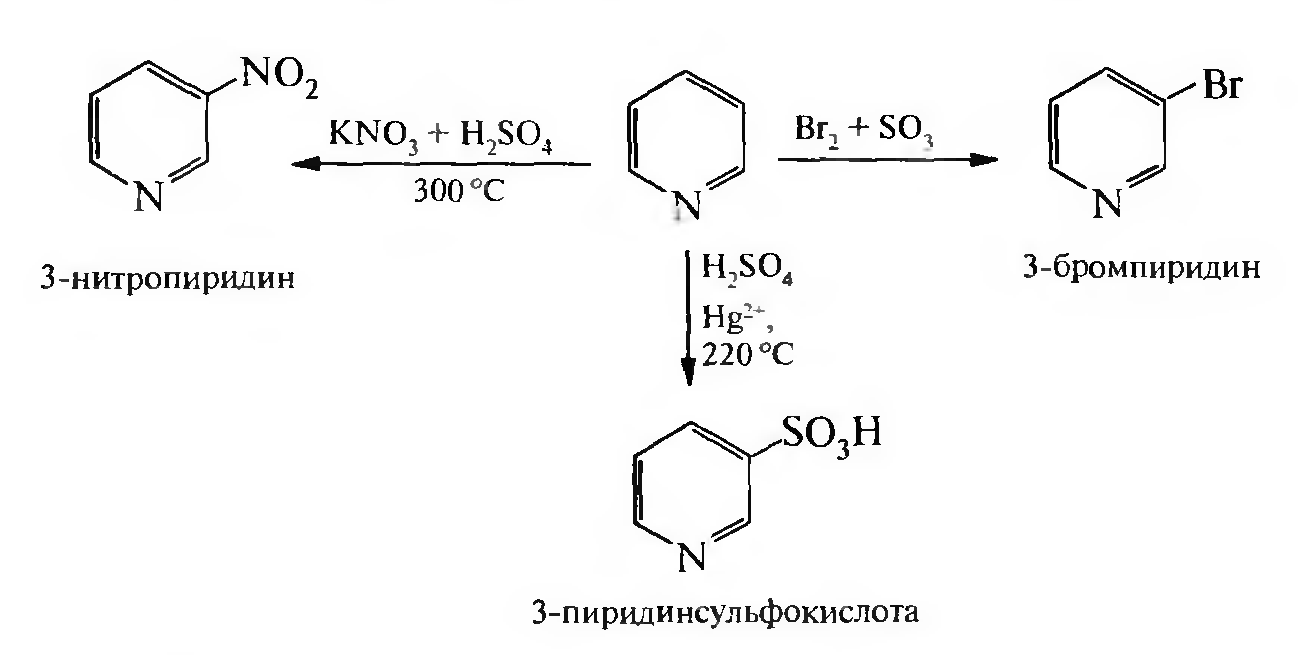
Реакции электрофильного замещения (SE). Электроноакцепторное влияние атома азота в молекуле пиридина приводит к тому, что реакции электрофильного замещения для пиридина протекают с трудом.
Реакции нитрования, сульфирования и галогенирования проходят медленно в жестких условиях и с низкими выходами. При этом электрофильный реагент направляется в β-положение:
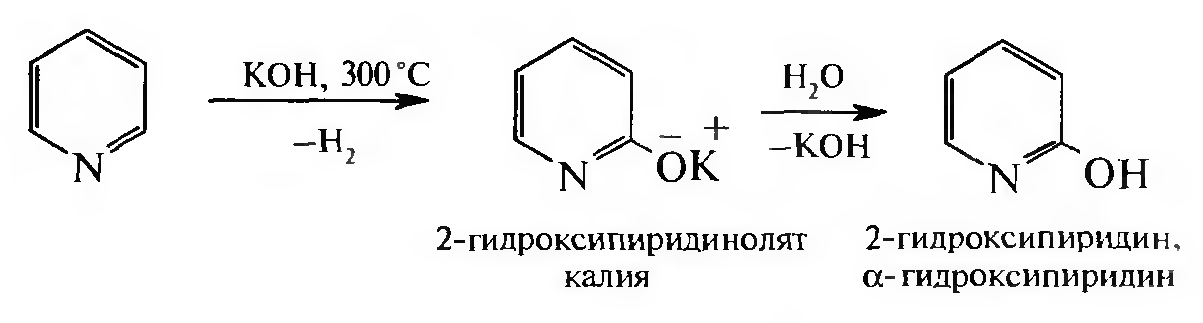
Реакции нуклеофильного замещения (SN). В реакции нуклеофильного замещения пиридин вступает легко. Замещение протекает по положениям 2,4,6, легче всего нуклеофильный реагент вводится в положения 2,6 (α-положения).
Ярким примером реакции этого типа является аминирование пиридина амидом натрия по Чичибабину.
Реакция протекает по механизму SN2:

Аналогично протекает гидроксилирование:
III. Реакции восстановления и окисления
Восстановление. Пиридин восстанавливается легче, чем бензол. В зависимости от природы восстановителя и условий проведения реакции образуются различные продукты.

Реакция с раскрытием пиридинового цикла протекает при высокой температуре в присутствии никелевого катализатора.
Окисление. Пиридиновое кольцо устойчиво к действию окислитилей. Алкилпиридины, подобно алкилбензолам, окисляются легко с образованием соответствующих пиридинкарбоновых кислот:
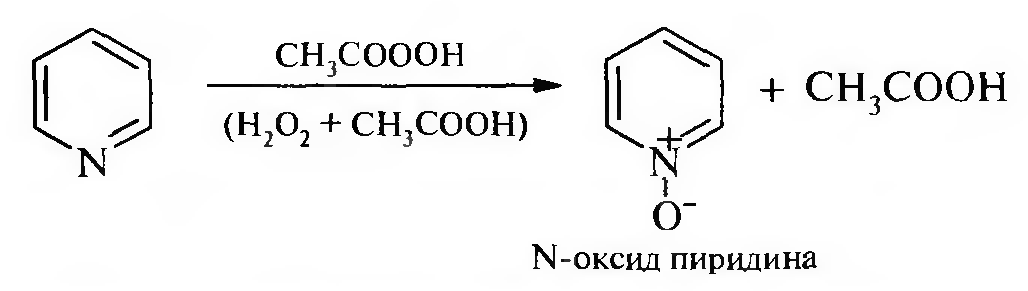
При действии пероксикислот пиридин окисляется по атому азота с образованием N-оксида.
N-оксид пиридина и его производные легко восстанавливаются:

Следует отметить, что N-оксид пиридина в отличие от пиридина довольно легко вступает в реакции электрофильного замещения. Это обусловлено электронодонорным влиянием атома кислорода. В результате смещения электронной плотности от атома кислорода в кольцо на атомах углерода в α и γ-положениях электронная плотность повышается.

Замещение идет легче по γ-положению, так как оно пространственно не затруднено. К тому же рядом стоящий атом азота понижает электронную плотность в α-положениях.
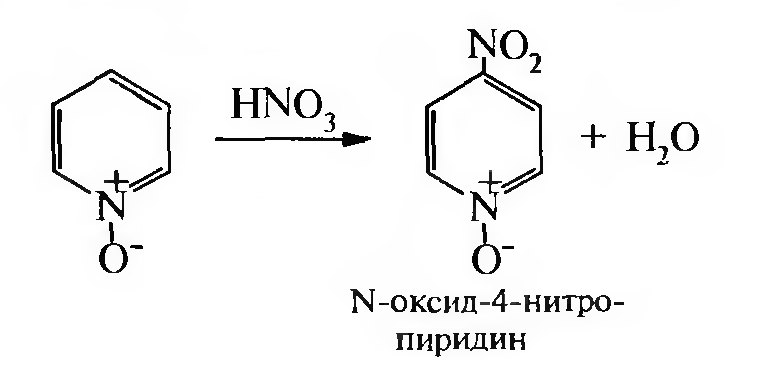
При нитровании N-оксида пиридина азотной кислотой с высоким выходом образуется N-оксид-4-нитропиридин:
N-Оксид пиридина используют для получения γ-замещенных производных пиридина:
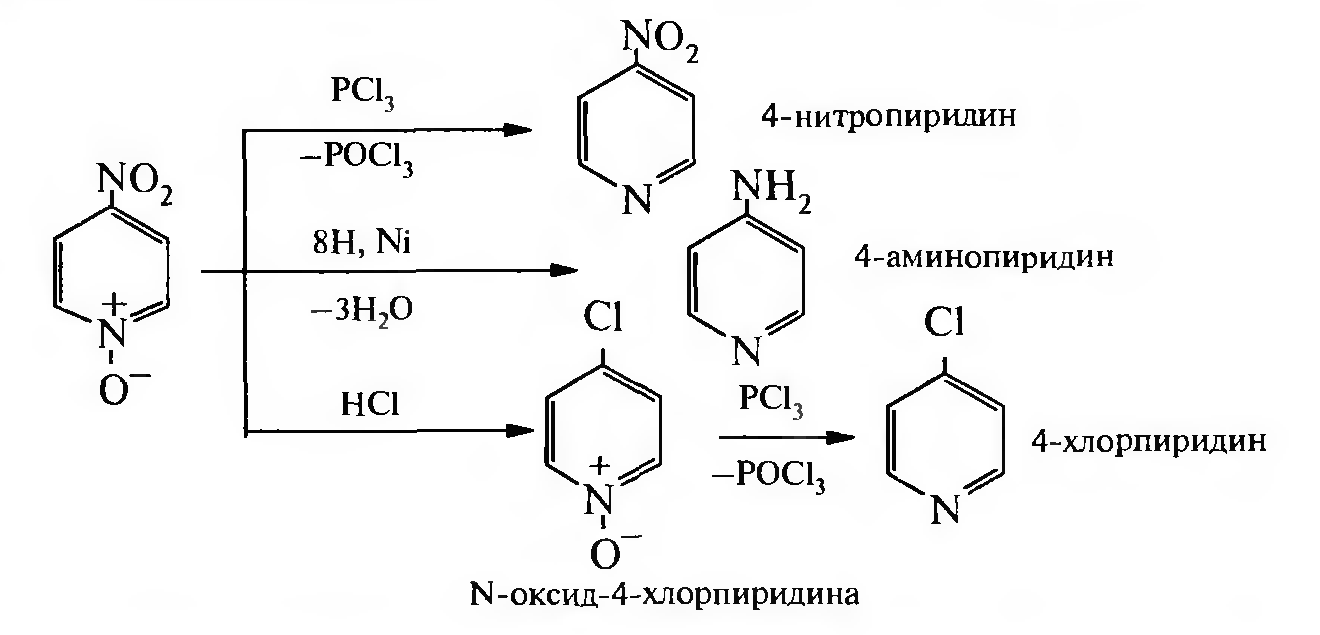
Алкилирование и ацилирование N-оксида проходит по атому кислорода с образованием солей N-алкокси- и N-ацилоксипиридиния соответственно:

Для N-оксида пиридина характерны также реакции нуклеофильного замещения, протекающие по положениям 2,4,6 (α и γ-положениям).
Важнейшие производные пиридина пиколины
Пиколинами называют монометильные производные пиридина:
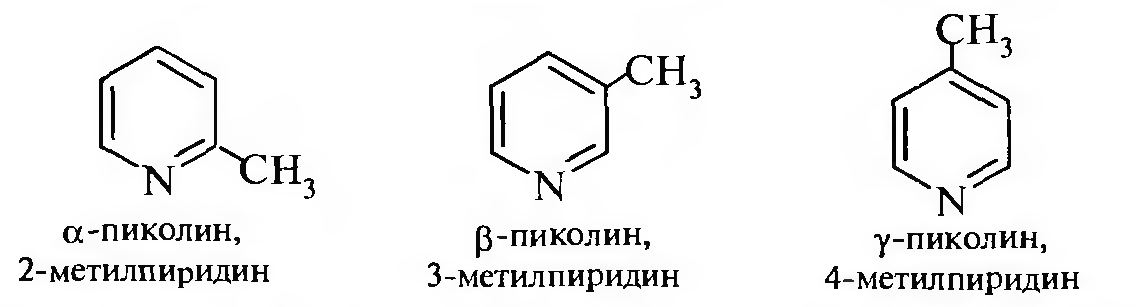
По химическим свойствам пиколины сходны с пиридином. Они образуют соли с сильными кислотами и алкилгалогенидами, окисляются до N-оксидов, восстанавливаются до производных пиперидина, аналогично метилпроизводным бензола окисляются до пиколиновой, никотиновой и изоникотиновой кислоты.
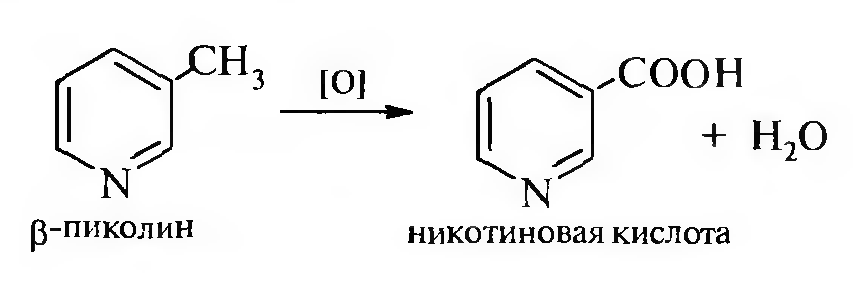
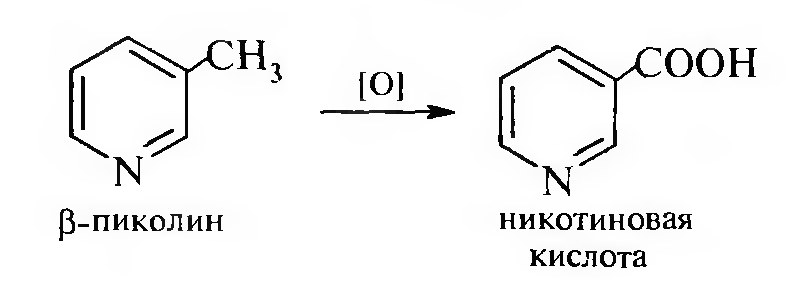
Например, при окислении β-пиколина образуется никотиновая кислота:
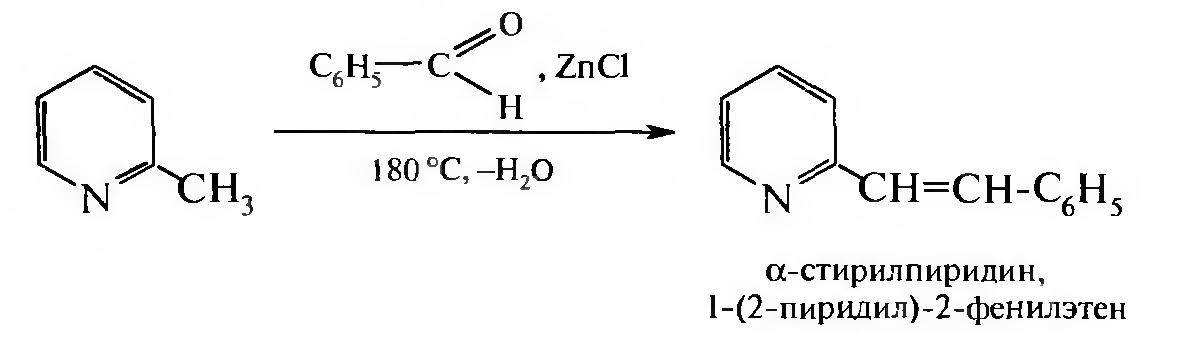
В молекулах α- и γ-пиколинов водородные атомы в метальных группах подвижны (σ, π-сопряжение), поэтому они в отличие от β-пиколинов вступают в реакции конденсации с альдегидами ароматического ряда.