
- •Глава 5
- •5.1. Основные понятия. Составление уравнений овр
- •5.1.1. Окисление и восстановление
- •5.1.2. Классификация овр
- •5.1.3. Распространённые окислители и восстановители
- •5.1.4. Составление уравнений овр
- •5.1.5. Влияние кислотности среды на продукты овр
- •5.2. Гальванический элемент, электродный потенциал
- •5.2.1. Катод, анод, электродные процессы
- •5.2.2. Разность потенциалов и энергия Гиббса
- •5.2.3. Уравнение Нёрнста
- •5.3. Применение электродных потенциалов для оценки направления овр
- •5.4. Электролиз. Аккумуляторы, химические источники тока
- •5.5. Заключение
5.2. Гальванический элемент, электродный потенциал
5.2.1. Катод, анод, электродные процессы
Если полуреакции окисления-восстановления проводятся без их пространственного разделения, никаких электрических эффектов или процессов не наблюдается. При сливании растворов Na2SO3 и KMnO4 ОВР
5Na2SO3 + 2KMnO4 + 3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 + 3Н2О
протекает гомогенно по всему объёму реакционного сосуда.
При помещении в раствор медного купороса цинковой пластинки, на ней появляется слой меди – протекает ОВР, более активный цинк вытесняет из раствора менее активную медь(+2) по всей доступной поверхности цинка:
CuSO4(в.) + Zn(тв.) = ZnSO4(в.) + Cu(тв.),
или в ионной форме
Cu2+(в.) + Zn(тв.) = Zn2+(в.) + Cu(тв.).
При этом обе полуреакции,
1) Cu2+ + 2e = Cu (восстановление);
2) Zn – 2e = Zn2+ (окисление);
также протекают во всех доступных для этого местах, и никакого разделения зарядов и возникновения электрических потенциалов не происходит: в фазе раствора вместо разряжающихся катионов Cu2+ образуются ионы Zn2+ с такой же скоростью; к фазе меди добавляются нейтральные атомы, а из фазы цинка, наоборот, удаляются нейтральные атомы.
Но если разделить полуреакции в пространстве, например, мембраной, не пропускающей катионы, но «прозрачной» для анионов (полупроницаемой перегородкой), и соединить цинк и медь электрическим проводником, как показано на рис. 5.1, то происходит следующее.

Рис. 5.1. Схема гальванического элемента с мембраной, составленного из цинкового анода в растворе ZnSO4 и медного катода в растворе CuSO4
Окисляющийся цинк уходит из фазы в виде катионов, оставляя в металле избыточные электроны. На цинке возникает отрицательный заряд и соответствующий электрический потенциал Е2. Цинк можно назвать отрицательно заряженным электродом, или катодом. В другой половине сосуда для перехода катионов меди в фазу металла, наоборот, требуются электроны. На меди возникает положительный заряд и потенциал Е1. Медь – положительно заряженный электрод, анод. Вследствие возникающей разности потенциалов ΔЕ = Е1 – Е2 в замкнутой цепи возникает ток – электроны двигаются преимущественно от цинка к меди.
Электронейтральность раствора обеспечивается движением ионов через мембрану. Вследствие протекания полуреакций окисления и восстановления в растворе ZnSO4 возникает избыто к, а врастворе CuSO4 недостаток положительных зарядов,. Для компенсации сульфат-ионы мигрируют через мембрану из раствора CuSO4 в раствор ZnSO4, как схематически показано на рис. 5.1.
Такое устройство было изобретено Л. Гальвани в 1780 г. и в его честь названо гальваническим элементом. Это частный случай химических источников тока (ХИТ), преобразующих энергию ОВР в электрическую энергию. Гальванический элемент – химический источник тока, в котором электрическая энергия вырабатывается в результате прямого преобразования химической энергии окислительно-восстановительной реакцией. В состав гальванического элемента входят два электрода: на катоде происходит полуреакция восстановления окислителя; на аноде – полуреакция окисления восстановителя.
В итоге работы гальванического элемента происходит не только ОВР
Cu2+(в.) + Zn(тв.) = Zn2+(в.) + Cu(тв.).,
но и увеличение концентрации ZnSO4 и уменьшение концентрации CuSO4. По мере протекания ОВР потенциалы электродов выравниваются, их разность уменьшается. При достижении равновесия ΔЕ = 0. Таким образом, гальванические элементы могут использоваться для преобразования энергии ОВР в электрическую одноразово, и по мере протекания ОВ-процесса вследствие уменьшения ΔЕ вырабатываемый ток будет уменьшаться (если нагрузка постоянна) и в конце концов прекратится.
Гальванические элементы как конкретные технические устройства могут быть выполнены самым различным образом (некоторые примеры приведены в разделе 5.4). В частности, вместо мембран часто используют солевые мостики 1, заполненные раствором электролита (KCl, NaCl и т. п.) в пористой среде, по которым катионы (K+, Na+) перемещаются в катодное пространство, а анионы (Cl– и т. п.) – в анодное (рис. 5.2).
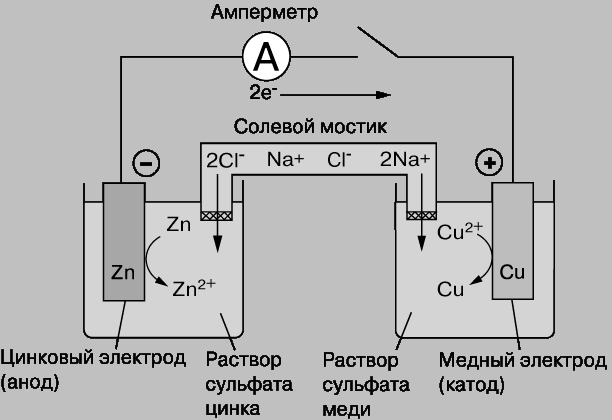
Рис. 5.2. Схема гальванического элемента с солевым мостиком, содержащим NaCl, составленного из цинкового анода в растворе ZnSO4 и медного катода в растворе CuSO4
Принципиальными условиями для работы гальванического элемента являются:
1) разделение протекания полуреакций окисления и восстановления в пространстве;
2) замыкание цепи как для потока электронов, так и противотока ионов.
Разумеется, для протекания самой ОВР должны быть выполнены все термодинамические условия, т. е. в случае изобарно-изотер-мического процесса ΔrG < 0. Важный и интересный вопрос: можно ли и как определить величину энергии, которую способен выработать гальванический элемент?
