
- •З історії розвитку біохімії
- •Напрями і методи дослідження в біохімії
- •Хімічний склад тваринного організму
- •Хімічний склад деяких органів і тканин, % (по с. M. Рапопорту)
- •Хімічний склад живої клітини (по о. Гізе)
- •Біологічні мембрани
- •Основні поняття і терміни біологічної хімії
- •Загальна характеристика, будова та функції вуглеводів
- •Загальна характеристика, будова та функції ліпідів
- •Білки. Амінокислоти
- •Класифікація l-a-амінокислот, які входять до складу білків, основана на полярності їх r–груп
- •Деякі амінокислоти, які не входять до складу білків, але відіграють важливу
- •Оптимальні значення рН для деяких ферментів (зa t.T. Березовим і б.Ф. Коровкіним)
- •Катіони металів, які активують деякі ферменти
- •Молекулярна активність деяких ферментів (за в.Й. Розенгартом)
- •1. Оксидоредуктази
- •2. Трансферази
- •3. Гідролази
- •5. Ізомерази
- •Вміст цукру в крові людини і деяких тварин
- •Добова потреба організму людини в жирах залежно від характеру трудової діяльності
- •Вміст мінеральних речовин у тваринних тканинах і органах
Вміст мінеральних речовин у тваринних тканинах і органах
мг% на сиру тканину
Орган або тканина |
К |
Na |
Ca |
Mg |
Cl |
P |
М'язи |
360 |
72 |
7 |
23 |
66 |
220 |
Серце |
250 |
185 |
10 |
17 |
135 |
270 |
Легені |
150 |
250 |
17 |
7 |
260 |
120 |
Мозок |
330 |
170 |
12 |
16 |
150 |
380 |
Печінка |
215 |
190 |
12 |
22 |
160 |
210 |
Еритроцити |
460 |
80 |
– |
5 |
190 |
60 |
Нирки |
175 |
175 |
20 |
21 |
220 |
140 |
Сироватка крові |
20 |
335 |
10 |
2 |
370 |
15 |
Кісткова тканина |
61 |
180 |
11000 |
105 |
190 |
5050 |
Зубна емаль |
50 |
250 |
36000 |
400 |
300 |
17000 |
Кінцевий обмін мінеральних речовин. Продукти кінцевого обміну мінеральних речовин видаляються з сечею, потом і калом. Легені майже не беруть участь у видаленні цих продуктів. Основними факторами, які визначають інтенсивність кінцевого обміну мінеральних речовин, є їх надлишок в раціоні і питній воді, швидкість обміну органічних сполук, в які вони входять, наявність в організмі речовин, йому не властивих (ліків, мінеральних домішок). Частина мінеральних речовин у самок виділяється з молоком.
Через нирки з сечею виділяється натрій, калій, кобальт, кальцій, магній, вісмут, літій, сурма, хлор, бор, бром, йод, фтор, сірка та деякі інші елементи. Натрій і калій виділяються у вигляді хлоридів і сульфатів, сірка – у вигляді сульфатів і парних сполук, фосфор – у вигляді середніх і кислих солей ортофосфорної кислоти.
З калом виділяються головним чином залізо, кальцій, мідь, стронцій, алюміній, берилій, марганець, цинк, молібден і взагалі важкі метали у вигляді різних солей. Слизова оболонка кишок здатна виділяти лужноземельні солі фосфорної кислоти. Крім того, з калом виділяються з організму мінеральні речовини, які не потрібні організму і входять до складу раціону (кремнієва кислота, силікати, ін.).
Частина мінеральних речовин виділяється з потом. Мінеральні речовини виділяються у вигляді хлоридів, сульфатів, фосфатів та ін.
Стан мінерального обміну в організмі характеризує мінеральний баланс. У молодих організмів і вагітних він позитивний, у старих – негативний, у тих, що знаходяться на стадії морфо-функціональної зрілості і розквіту продуктивності, спостерігається мінеральна рівновага, тобто кількість мінеральних речовин, що виділяються з організму, рівна кількості тих речовин, що поступили з раціоном.
Регуляція мінерального обміну. Мінеральний обмін регулюється нервовою системою, залозами внутрішньої секреції і складом їжі.
Мінеральний обмін, перш за все, регулюється центральною нервовою системою. Встановлено, що видалення у експериментальних тварин кори великих півкуль різко зменшує кількість мінеральних речовин в кістках, м'язах і збільшує їх вміст в печінці. Зростає виділення солей кальцію, натрію, калію і заліза з сечею, калом і потом.
Участь залоз внутрішньої секреції в регуляції мінерального обміну досить значна. Зокрема, паратгормон регулює обмін кальцію, магнію і фосфору. Мінералокортикоїди кори наднирників беруть участь у регуляції обміну кальцію і натрію, а також виділення їх надлишку з сечею. Альдостерон регулює розподіл іонів натрію і калію між плазмою крові і клітинами: він сприяє переходу іонів натрію з клітин у плазму і переходу іонів калію з плазми крові в клітини. Під впливом антидиуретичного гормону задньої частки гіпофіза зменшується виділення сечі з організму і відбувається затримка мінеральних речовин в органах, тканинах і клітинах. Статеві гормони стимулюють діурез і сприяють виділенню надлишку мінеральних речовин з організму.
На обмін кальцію і фосфору впливає також наявність вітамінів групи D. Між окремими мінеральними речовинами існує синергізм і антагонізм. Так, якщо у ферментативних процесах іони K+, NH4+ або Pb2+ є активаторами (наприклад, для альдегіддегідрогенази), то іони Na+, Li+ – інгібіторами. Це типово також для іонів Mg2+ і Ca2+, Mn2+ і Zn2+, ін.
Патологія мінерального обміну. Розрізняють первинні і вторинні порушення обміну мінеральних речовин. Первинні порушення виникають при недостатній кількості або надлишку в їжі і воді окремих мінеральних речовин. Прикладом може бути ендемічний зоб, що виникає при недостатній кількості в раціоні йоду. Основною причиною карієсу зубів є недостатня кількість в їжі і воді фтору, флюороз виникає при надлишку фтору.
Вторинні порушення мінерального обміну виникають через порушення обміну інших речовин або нейрогуморальної регуляції. Так, при пухлинах головного мозку різко зменшується вміст мінеральних речовин у кістковій і м'язовій тканинах. При недостатній кількості в раціоні вітамінів групи D зменшується ступінь засвоюваності організмом кальцію і фосфору. Гіпофункція паращитовидної залози призводить до виникнення тетанії – захворювання, яке супроводжується зменшенням вмісту кальцію в крові і т.д.
Мінеральний обмін порушується при багатьох інфекційних і інвазивних хворобах, при захворюваннях харчового каналу, печінки, нирок, шкіри.
Значення і обмін деяких хімічних елементів
Макроелементи
Чотири макроелементи складають органічну основу живих організмів. Це кисень (62,43%), вуглець (21,15%), водень (9,86%) і азот (3,10%). Решту макроелементів прийнято вважати мінеральними. З них найбільше значення мають такі:
Кальцій. На частку кальцію доводиться майже третина всіх мінеральних речовин організму (1,9% загальної маси тіла). 97% кальцію зосереджено в скелеті у вигляді солей фосфорної і вугільної кислот. Близько 1 % кальцію знаходиться в іонізованому стані.
Всмоктування кальцію відбувається переважно в тонкій кишці. Інтенсивність всмоктування залежить від вмісту кальцію в раціоні, потреби і наявності вітаміну D. При нормальному складі раціонів всмоктується близько 50% кальцію. Вітамін D є складовою частиною білкового переносника – кальцій-зв’язуючого протеїну, який виконує при всмоктуванні три функції: стимулятора дифузії, носія і концентратора. Всмоктування відбувається в два етапи – поглинання кальцію клітинами кишкового епітелію і транспортування його до серозної оболонки. 40% кальцію організму зв'язано з альбумінами крові, які беруть участь в транспортуванні кальцію до тканин і клітин.
Кальцій бере участь у регуляції порозності ендотелію судин, у створенні структури кісткової тканини, в процесах зсідання крові. Він знижує збудливість нервової системи, стимулює діяльність серцевого м'яза, знижує проникність клітинних мембран, зменшує здатність колоїдів зв'язувати воду, бере участь у регуляції діяльності багатьох ферментів. Так, кальцій є інгібітором енолази і дипептидази, активатором лецитинази і актоміозин-АТФ-ази. При недостатній кількості в раціоні кальцію виникає гіпокальційемія. Вона супроводжується гіперфосфатеміею, підвищенням проникності клітинних мембран, остеопорозом, ламкістю і викривленням кісток, остеомаляцією, рахітом, судомами.
Обмін кальцію в організмі регулюється паратгормоном і кальцитоніном. Надлишок кальцію з організму видаляється з калом (в основному шляхом секреції слизових оболонок кишок) і сечею.
Фосфор. Вміст фосфору в організмі в середньому складає 1% загальної маси. В організмі фосфор є складовою частиною кісток і зубів, компонентом нуклеїнових кислот, фосфопротеїдів і фосфатидів, входить до складу буферних систем, макроергічних фосфатів і посередника гормональної регуляції (3', 5'-АМФ), бере участь в багатьох реакціях обміну речовин, перш за все, гліколізу, глікогенолізу і окислювального фосфорилування.
Всмоктується фосфор в проксимальній ділянці тонкої кишки. Для всмоктування фосфору необхідна наявність іонів Ca2+ і, мабуть, K+ в химусі. Всмоктування фосфору через стінку кишок здійснюється проти градієнта концентрації з участю білкових переносників. Фосфор, всмоктується у вигляді аніона РО3-4, поступає в кров, швидко поглинається печінкою, нирками, селезінкою, повільніше – нервовою, м'язовою і кістковою тканинами. Фосфор характеризується високим ступенем метаболізму, наприклад фосфор кісток і зубів оновлюється протягом 4 діб. Виділяється з сечею, калом і потом.
Обмін фосфору в організмі регулюється паратгормоном, частково – статевими гормонами. При недостатній кількості фосфору, порушенні співвідношення Ca:P або захворюваннях паращитовидної залози виникає рахіт, остеомаляція і фіброзний остит.
Mагній. Магній складає близько 0,05% загальної маси. В основному магній міститься в скелеті і м'яких тканинах. Магній входить до складу кісток і зубів, бере участь у функціонуванні нервово-м'язового апарату й імунобіологічних процесах, є складовою частиною і активатором багатьох ферментів (АТФ-ази м'язів, АХЕ, фосфатаз), регулятором окислювального фосфорилування, бере участь у біосинтезі білка (служить своєрідним містком між рРНК і тРНК+іРНК) і ацетилхоліну, діяльності мітохондрій, терморегуляції й ін.
Всмоктування магнію відбувається в шлунку і дванадцятипалій кишці. Мабуть, для кальцію і магнію існує одна і та ж система всмоктування (див. вище). Найкраще всмоктується магній молока. Дещо гірше всмоктується магній у вигляді солей MgSO4•7H2O і MgCO3. У крові знаходиться у вигляді іонів, солей і сполук з альбумінами і глобулінами. Депонується в печінці, потім поступає в м'язову і кісткову тканини. Магній – антагоніст кальцію. Виділяється з сечею, калом і потом у вигляді солей.
При недостатній кількості магнію виникає трав'яна тетанія або гіпомагнезія, яка виявляється в м'язових судомах, уповільненні росту, порушенні нервово-м'язової діяльності.
Калій. Його вміст в організмі досягає 0,22 – 0,23% загальної маси. Калій бере участь в підтримці осмотичного тиску всередині клітини, передачі нервових імпульсів, регуляції скорочень серцевого й інших м'язів, входить до складу буферних систем крові і тканин, підтримує гідратацію іонів і колоїдних частинок, активує діяльність багатьох ферментів (АТФ-ази, піруват- і фруктокіназ й ін.), є складовою частиною натрій-калієвого насоса.
Найбільше калію зосереджено в тканинах печінки, нирок, шкіри, м'язів і нервової системи. Калій в основному зосереджений у клітинах (540 – 620 мг%), мало його в міжклітинній рідині (15,5 – 21 мг%). Знаходиться у вигляді солей – хлоридів, фосфатів, карбонатів і сульфатів, в іонізованому стані і у зв'язаному стані з білками або іншими органічними сполуками.
Всмоктування калію відбувається всіма частинами харчового каналу. Через кишкову стінку калій проникає в результаті дифузії. Екзогенний калій спочатку потрапляє в міжклітинний простір, потім у кровоносну систему і печінку. Надлишок калію з організму видаляється з сечею, калом і потом.
Обмін калію в організмі регулюється мінералокортикостероїдами кори наднирників. Гіперкаліємія спостерігається при посиленому розпаді тканин, травмах, інфекціях, порушеннях регуляції з боку наднирників. При цьому гальмуються реакції гліколізу, клітинне дихання, окислювальне фосфорилування, збудливість, наступає інтоксикація. Гіпокаліємія виникає при недостатній кількості калію і виявляється у вигляді блювоти, ентеритів і ін. Це призводить до появи парезів, паралічів, нефриту і ін.
Натрій. Обмін натрію тісно пов'язаний з обміном калію. Його вміст в організмі складає 0,08% загальної маси. Натрій є складовою частиною буферних систем, разом з калієм бере участь у створенні в організмі і його клітинах відповідного осмотичного тиску, в підтримці кислотно-лужної рівноваги і проведенні нервових імпульсів. Невелику кількість гідрокарбонату натрію секретують слинні і підшлункова залози. Він і створює необхідну реакцію середовища для процесів травлення в ротовій порожнині і кишках. Натрій поступає в організм в основному у вигляді хлориду натрію. Основна маса натрію зосереджується в плазмі крові, лімфі, лікворі й інших біологічних рідинах у вигляді хлоридів, гідрокарбонатів, фосфатів і т.д. Багата натрієм шкіра, легені, мозок.
Велика кількість натрію всмоктується в тонкій кишці, а також в шлунку і товстій кишці. Натрій проникає через стінку кишок проти градієнта концентрації з участю спеціальних переносників. 90 – 95% поглиненого натрію виділяється з сечею, 5 – 10% – з калом і потом.
Обмін натрію в організмі регулюється альдостероном. Гіпонатріємія виникає при недостатній кількості натрію в раціоні, посиленій роботі, діабеті, захворюваннях наднирників. Це призводить до ослаблення апетиту, млявості, зменшення продукції залозами дна шлунку соляної кислоти, посиленої евакуації химуса з шлунку в кишки, гальмуванню виділення соку підшлункової залози. Гіпернатріємія виникає при зменшенні реадсорбції натрію в ниркових канальцях і порушенні інкреції альдостерону або антидиуретичного гормону гіпофіза. Розвиваються набряки в тканинах. Ці явища спостерігаються при нефриті, цирозах печінки, міо- і перикардитах.
Хлор. Хлор складає близько 0,08% загальної маси. Бере участь у регуляції осмотичного тиску, служить компонентом для синтезу соляної кислоти залозами шлунку. Є активатором амілази і поліпептидази. Всмоктується хлор головним чином у тонкій кишці. Концентрується в позаклітинних рідинах (до 85%), усередині клітин хлор в основному зосереджений в еритроцитах. Найбільше хлору міститься в сироватці крові. В організмі в середньому утримується 31% спожитого хлору. Надлишок хлору видаляється з сечею, калом і потом.
Обмін хлору в організмі регулюється мінералокортикоїдами кори наднирників.
Сірка. Вміст сірки в організмі коливається від 0,08 до 0,5% загальної маси. Сірка – складова частина багатьох білків, глутатіону, коензиму А, вітамінів, мукополісахаридів, деяких жовчних кислот, сульфатидів, парних сполук і ін.
Поступає з їжею у вигляді органічних (білків, амінокислот, вітамінів) і неорганічних (сульфатів) сполук. З неорганічних сполук сульфат-іони відразу ж всмоктуються кишками. Частина сірки засвоюється бактеріями харчового каналу і перетворюється в органічну. Органічні сірковмісні сполуки (білки, пептиди) організм засвоює після попереднього їх розщеплення в харчовому каналі. Частина екзогенної сірки нагромаджується в організмі у вигляді біологічно активних речовин.
Сірка бере участь в біосинтезі кератинів шерсті і волосся, в утворенні багатьох білків, гормонів, хондроітинсірчаної і таурохолевої кислот. Деяка частина сірки піддається окисленню, перетворюючись на сірчану кислоту, яка використовується клітинами печінки для нейтралізації токсичних продуктів у вигляді парних сполук – фенолсірчаної кислоти, тваринного індикана. З організму сірка виводиться з сечею, калом, потом у вигляді сульфатів або ефірів з фенолами. При недостатній кількості сірки спостерігається втрата апетиту, випадання шерсті і волосся, слюно- і сльозотеча й ін.
Мікроелементи
Йод. В організмі йоду міститься до 0,027% загальної маси. Йод необхідний для синтезу гормонів щитовидної залози. В організм йод поступає з кормом, водою і повітрям. Всмоктується в шлунку і проксимальних ділянках харчового каналу. Йодиди всмоктуються швидше, ніж йод, зв'язаний з білками і амінокислотами. Частина йоду всмоктується за допомогою білкових переносників. У крові міститься 0,5 – 10 мкг% йоду. До 90% всього йоду поглинається щитовидною залозою, інше – тканинами тонкої кишки, нирок, яєчників, плаценти, шкіри, волосся і шерсті. Найбільше йоду міститься в тканинах щитовидної залози, печінки, шкіри, нирок, яєчників, лімфовузлів і кори великих півкуль. Близько 2/3 йоду крові знаходиться у вигляді тироксина, ди- і трийодтиронінів, решта йоду зв'язана з білками, в основному з альбумінами.
Характеризується інтенсивним обміном (після введення 131J він через 10 – 15 хв з'являється в щитовидній залозі).
Надлишок йоду з організму видаляється з сечею, потом, молоком, калом, повітрям, що видихається.
Обмін йоду в організмі регулюється тиреотропним гормоном гіпофіза. Через нестачу йоду розвивається ендемічний зоб, гальмується основний обмін, окислювальне фосфорилування, пригнічується синтез білка, патологічно відкладається жир, сповільнюється ріст.
Фтор. В організмі фтор складає 0,009% загальної маси. Бере участь в утворенні опорних тканин, особливо кісткової, і зубів. Впливає на активність багатьох ферментів і на обмін речовин в цілому.
В організм поступає більше з водою, ніж з їжею. В харчовому каналі всмоктується до 80% екзогенного фтору. Швидко поглинається спочатку щитовидною залозою, потім нирками і наднирниками. Депонується в емалі зубів, дентині, діафізах і епіфізах кісток, селезінці, волоссі і шерсті, плазмі крові, еритроцитах, лікворі і молоці у вигляді фторапатита й інших сполук. З віком вміст фтору в організмі зростає. Основна маса фтору депонується в кістках (до 95%). Виділяється з сечею, калом і потом.
При недостатній кількості фтору в раціоні і питній воді розвивається карієс зубів і остеопороз кісток. Надлишок фтору в раціоні і питній воді призводить до фторозу зубів (поява темних плям на зубній емалі) і їх швидкому зношуванню, деформації кісток скелета і суглобів, обмеженню рухливості і виникненню парезів.
Залізо. В організмі залізо складає до 0,005% загальної маси. В основному воно зосереджено в гемоглобіні, феритині і гемосидерині, міоглобіні, цитохромах, каталазі, трансферинах і інших сполуках. Залізо є складовою частиною багатьох білків, необхідним мікроелементом для кровотворення і біологічного окислення. В організм поступає з їжею й питною водою.
Всмоктування відбувається в тонкій кишці, шлунку і частково в товстій кишці. Спочатку залізо поглинається слизовою оболонкою кишок, потім за допомогою білкових переносників або іншим шляхом проникає в кров. На адсорбцію заліза впливають різні екзо- і ендогенні чинники. Під впливом HCl шлункового соку іони Fe2+ перетворюються на іони Fe3+ і за допомогою феритину слизових оболонок всмоктуються. Близько 90% концентрується в червоному кістковому мозку, де використовується для утворення еритроцитів. Частина заліза депонується в печінці, селезінці, стінці кишок у вигляді феритинів і гемосидерина. Надмірний зміст заліза виділяється з калом, частково з сечею, молоком, у птахів – у складі яйця.
Обмін заліза в організмі регулюється центрами гіпоталамуса на рівні ретикуло-ендотеліальної системи і печінки. Вміст заліза в крові зменшується при анеміях, отруєннях гемолітичними отрутами, гемолітичних жовтяницях. Іноді в організмі відкладається екзогенне залізо (у вигляді Fe2O3).
Цинк. Кількісний вміст цинку в організмі складає 0,003% загальної маси. Цинк – складова частина металоензимів: дегідрогеназ, пептидаз, трансфосфорилаз, карбангідрази, урикази, фосфатаз, альдолази, уреази. Є активатором і інгібітором багатьох ферментів. Зокрема, цинк активує каталітичну дію аргінази, енолази, лецитинази, дегідро-, три- і амінопептидаз. Він входить до складу молекули інсуліну, активує дію адреналіну, тестостерону, фолікуліну, пролану, антидиуретичного і гонадотропного гормонів. З наявністю Zn в організмі пов'язані процеси клітинного дихання, росту і розвитку, обмін білків, нуклеїнових кислот, ліпідів і вуглеводів, імунітет, гемопоез, енергетичний обмін.
В організм цинк поступає головним чином у складі раціону. Всмоктується в тонкій кишці. Депонується в печінці, після чого поступає до інших органів і тканин. В організмі знаходиться у вигляді комплексних сполук з білками. Найбільше цинку міститься в тканинах ока, особливо в сітківці (249,5 мг%), а також печінці, підшлунковій залозі, аорті (161,6 мг%), селезінці. Кров і нервова тканина бідні на цинк.
Обмін цинку в організмі регулюється щитовидною залозою. При недостатній кількості цинку в раціоні сповільнюється ріст, випадає шерсть і волосся, виникають дерматити, анемія, наступає безплідність, виснаження. Вміст цинку в тканинах зростає при аноксії і асфіксії, зменшується – при лейкозі, ракових захворюваннях, нефриті, гепатитах, артритах.
Кобальт. В організмі міститься 0,000001 – 0,000075% від загальної маси. Кобальт – складова частина металоензимів: ізомераз, транскарбоксилази, гліцилгліциндипептидази. В багатьох реакціях обміну речовин він є активатором ферментів: піруваткарбоксилази, рибофлавінкінази, кісткової лужної фосфатази, аргінази й ін. Кобальт – складова частина вітаміну B12, інсуліну й інших речовин. Активує процеси кровотворення, прискорює ріст, синтез нуклеїнових кислот і м'язових білків, асиміляцію азоту і основний обмін.
В організмі всмоктується в харчовому каналі. Тут же він використовується мікробами для біосинтезу вітаміну B12. Після надходження в кровоносне русло депонується спочатку в печінці, потім в інших органах: у підшлунковій і вилочковій залозі, нирках, селезінці, наднирниках. Видаляється з організму з сечею, секретами харчового каналу і жовчю. Відсутність кобальту в раціоні призводить до акобальтозу (сповільнюється ріст, знижується продуктивність, розвивається анемія).
Мідь. В організмі міститься близько 0,00015% міді. Мідь входить до складу багатьох білків печінки, червоного кісткового мозку, плаценти, молока, пігментів і металоензимів: ЦХО, тирозинази, аскорбіноксидази, аскорбінкінази, альдолази й ін. Мідь бере участь у біосинтезі гемоглобіну, еластину, ферментів каталази і пероксидази. В організмі мідь знаходиться в зв'язаному (в основному з білками) і вільному (у вигляді іонів) стані. Іони Cu2+ володіють окислювальними властивостями: вони можуть перетворювати сульфгідрильні групи в дисульфідні. Іони Cu2+ гальмують дію лужної фосфатази, амілаз, ліпаз, пепсину, β-глюкуронідази і прискорюють окислення вітаміну С. Вітамін А і каротиноїди інактивують каталітичну дію міді. Мідь посилює використання тканинами вітамінів E і К, активує дію інсуліну і гальмує дію адреналіну, стимулює діяльність гормонів гіпофіза, усуває токсичну дію тироксина.
Всмоктується мідь у шлунку і тонкій кишці. Інтенсивність всмоктування залежить від складу раціону. Солі міді з амінокислотами і жирними кислотами всмоктуються краще, ніж солі мінеральних кислот. Транспортується мідь білками крові, в основному альбумінами, в купферовські клітини печінки, де і депонується. З печінки мідь поступає до інших органів і тканин. Надлишок міді виділяється з жовчю через кишки, нирками, шкірою, слизовими оболонками дихального апарату. У самок під час лактації частина міді виділяється з молоком.
При недостатній кількості міді розбивається анемія, порушуються функції нервової, м'язової, кровоносної і статевої систем. Надлишок міді в раціонах призводить до отруєнь – метгемоглобінемії, жовтяниці, гемоглобінурії.
Бром. В організмі брому міститься до 0,002% загальної маси. Бром бере участь в регуляції нервової діяльності – посилює процеси гальмування і еякуляції. Він є інгібітором амілаз.
В організм поступає з їжею, водою і повітрям (узбережжя морів і океанів). Основним місцем всмоктування брому є тонка кишка. Депонується в печінці, потім поступає до інших органів і тканин.
За певних умов бром може витісняти йод з його органічних похідних, що призводить до йодної недостатності. Адреналін затримує виведення брому з організму. Надлишок брому видаляється з організму з сечею, калом і потом, молоком.
Бор. В організмі бор складає 0,000001 – 0,00001% загальної маси. Найбільше його міститься в зубах і кістках (16 – 138 мг/кг сухої речовини). Біологічна роль бору повністю не з'ясована. Відомо, що бор уповільнює азотний обмін, сприяє відкладенню жиру, посилює гіпоглікемічний ефект інсуліну, інактивує діяльність деяких ферментів (лужної фосфатази, уреази, аргінази, холінестерази), інактивує дію вітамінів B2 і B12.
Бор поступає в організм з їжею і питною водою. Всмоктується в тонкій кишці. Близько 50% депонується в кістках і інших органах. Надлишок бору виділяється з сечею і частково з калом. При підвищеному вмісті бору виникають борні ентерити, нефрит, гепатити, стерильність, набряки мозку.
Марганець. В організмі ссавців марганцю в середньому міститься 0,00005% загальної маси. Марганець посилює процеси зсідання крові, кровотворення, біосинтез нуклеїнових кислот, білків, холестерину, антитіл. Він є складовою частиною деяких металоензимів: аргінази, глутамілтрансферази, дипептидази, ізоцитратдегідрогенази, карбоксилази й ін., активатором глюкокінази, фосфатаз і гексокіназ. Стимулює дію гормонів передньої частки гіпофіза, андрогенів, інсуліну. Активує ряд реакцій гліколізу і циклу трикарбонових кислот.
Марганець поступає в організм з їжею і частково з водою. Всмоктується в тонкій кишці, потім з током крові поступає в печінку й інші органи і тканини. В м'язах і крові концентрація марганцю зазвичай не перевищує 1 мг/кг. Велика частина екзогенного марганцю виділяється з жовчю в кишечник, решта – з сечею, потом, у самок – з молоком, у самців – з еякулятом.
При недостатній кількості марганцю зменшуються процеси росту, окостеніння, розвивається анемія, тетанія, знижується молочна продуктивність. Надлишок марганцю призводить до виникнення марганцевого рахіту.
Молібден. В організмі вміст молібдену визначається стотисячними частками відсотка по відношенню до загальної маси. Молібден бере участь в окисно-відновних процесах, входить до складу молекул деяких ферментів, впливає на обмін пуринових і піримідинових основ, білків, ліпідів, вуглеводів, вітамінів і ін.
В організмі молібден всмоктується всіма частинами харчового каналу, потім з током крові поступає в печінку й інші органи. Міститься в кістках (0,2 – 12 мг/кг сухої маси), печінці, жовчі. Багата молібденом біла і сіра речовина мозку, підшлункова і щитовидна залози, сім’яники. Надлишок молібдену виділяється з сечею, калом і потом, у самок – з молоком.
При підвищеному вмісті молібдену виникає токсикоз, який виявляється в порушеннях пуринового обміну і сильному виснаженні. При токсикозі порушується міцність кісток, виникає анемія, у самців гальмується сперматогенез, розвивається безплідність.
Селен. Більшість тварин містить до 0,0000035 – 0,000035% селену по відношенню до загальної маси. Селен володіє антиоксидантними властивостями, бере участь в окислювальному фосфорилуванні, разом з вітаміном E виконує функції каталізатора в процесах перенесення електронів, у комплексі з вітамінами А і E виявляє радіозахисну дію, бере участь в імунобіологічній реактивності організму і виробленні стійкості до анафілактичного шоку, гальмує дію цитратгідролази, підвищує сприйняття сітківкою ока світлового проміння.
Селен всмоктується всіма частинами харчового каналу. З білками селен всмоктується легше, ніж з неорганічними сполуками. В процесі всмоктування беруть участь білкові переносники. Частина мінеральних солей селену під впливом ферментів мікрофлори включається в амінокислоти і у такому вигляді всмоктується. В організмі селен транспортується спочатку альбумінами крові, потім α- і β-глобулінами. Близько 80% селену поглинається еритроцитами, решта маси депонується клітинами нирок, печінки і інших органів. У крові селен знаходиться у складі сполук з білками, пептидами і амінокислотами, а також у вигляді вільних іонів. Видаляється соками кишок, з повітрям, що видихається, частково з сечею, у самок – з молоком. Підвищений вміст селену призводить до токсикозу, який проявляється у вигляді гострої і хронічної форм. При цьому порушується діяльність оксидоредуктаз (особливо СДГ), біосинтез метіоніну, ріст покривних і опорних тканин, виникають анемії. Недостатня кількість селену призводить до виникнення білом’язової хвороби, коли атрофується скелетна мускулатура, з'являється безплідність, ексудативний діатез і некротична дегенерація печінки.
Хром. Відноситься до життєво необхідних елементів. Його вміст в організмі може досягати 0,001 – 0,0001%. Є дані про участь хрому в остеогенезі, обміні нуклеїнових кислот і вуглеводів, у регуляції діяльності щитовидної залози. Хром бере участь в процесах кровотворення, активує трипсиноген, посилює гіпоглікемічну дію інсуліну.
В організмі хром всмоктується в кишках. До 50% хрому депонується в кістках, м'язах і шкірі. Багато хрому міститься в гіпофізі (3 мг%), щитовидній і підшлунковій залозах, наднирниках і яєчниках. З організму видаляється в основному з сечею, частково – з калом і потом, у лактуючих самок – з молоком.
Великі дози хрому (особливо шестивалентного) викликають отруєння.
Нікель. В організмі нікелю міститься 0,000001%. Біологічне значення цього мікроелемента вивчено недостатньо. Відомо, що він активує аргіназу, впливає на окислювальні процеси. В організм поступає з їжею, частково з водою. Всмоктується в основному в тонкій кишці. Нагромаджується в печінці, нирках, підшлунковій залозі й інших органах. З організму виводиться з калом, сечею і потом.
При надмірній кількості розвивається токсикоз, який найчастіше виявляється в кератитах і керато-кон'юнктивітах. На ураженій роговій оболонці ока розвиваються язви або більмо. Захворювання зазвичай завершується сліпотою.
Миш'як. Вміст миш'яку в організмі досягає 0,0000008 – 0,00002% загальної маси. Біологічна роль миш'яку вивчена недостатньо. Встановлено, що він бере участь в реакціях гліколізу, окислювальному розпаді складних вуглеводів, бродінні й інших процесах. Арсенати прискорюють реакції гліколізу і розпад гексозофосфатів, арсеніти гальмують окисно-відновні реакції і процеси дихання еритроцитів.
Всмоктується у складі органічних сполук на 50% швидше, ніж у складі мінеральних. Депонується в шкірі і її похідних, щитовидній залозі, печінці, міокарді, слизовій оболонці матки. З організму миш'як виводиться в основному з сечею, потом, калом, у лактуючих самок – з молоком.
Його надлишок викликає отруєння: втрату апетиту, дерматити, паралічі, і смерть. Ссавці більш чутливі до цього, ніж птахи.
Стронцій. В золі, одержаній при спалюванні тіла тварин, міститься 0,0005% стронцію. Цей мікроелемент бере участь в остеогенезі, процесах зсідання крові та деяких ферментативних реакціях як інгібітор або активатор.
В організмі стронцій всмоктується в краніальній частині тонкої кишки. Нагромаджується в кістковій тканині, частково в інших органах і тканинах. З віком його кількість в організмі зростає. У жуйних надлишок стронцію з організму видаляється переважно з калом, у людини і мавп – з сечею. Багато стронцію містять жовчне і ниркове каміння.
При надлишку стронцію виникає стронцієвий рахіт: сповільнюється ріст, наступає виснаження організму, розм'якшуються кістки і виникають переломи. При цій хворобі іони Sr2+ витісняють іони Ca2+ з молекул апатиту в кістковій тканині. Велику небезпеку для організму представляє 90Sr – радіоактивний стронцій, який швидко всмоктується і може нагромаджуватися в кістках, сприяючи розвитку лейкемії і ракових захворювань. Накопичення 90Sr можна загальмувати, обмежуючи наявність в раціоні вітамінів групи D і збільшуючи вміст в організмі фосфору і кальцію.
В тканинах організму знайдені й інші мікроелементи: ванадій, олово, рубідій, цезій, титан, ртуть, срібло, золото, свинець, уран і ін. Однак біологічна роль їх вивчена недостатньо.
Лекція № 16. Обмін речовин як єдине ціле.
Біохімічні перетворення різних речовин у тваринних організмах взаємозв'язані. Порушення обміну якої-небудь однієї групи речовин, наприклад нуклеїнових кислот, як правило, спричиняє за собою зміну обміну речовин організму в цілому. Відомо, що обмін речовин складається з двох процесів: асиміляції і дисиміляції. У молодого організму, який росте, процеси асиміляції переважають над процесами дисиміляції. У дорослих тварин між процесами асиміляції і дисиміляції встановлюється динамічна рівновага. У старіючих і хворих – розпад речовин переважає над їх синтезом.
Реакції обміну речовин, що протікають в організмі, характеризуються високим ступенем узгодженості. Вони являють собою впорядковану і цілісну систему, яка склалася в результаті тривалої еволюції живого світу, закріпилася генетично і передається від покоління до покоління. Обмін речовин є закономірним порядком перетворень речовин і енергії в організмі.
Взаємозв'язок і взаємообумовленість реакцій обміну речовин координуються центральною нервовою системою і залозами внутрішньої секреції, які утворюють чітку систему нейрогуморальної регуляції асиміляції і дисиміляції. Регуляція здійснюється за допомогою ферментів, гормонів, цАМФ, медіаторів нервового збудження, загальних продуктів біохімічних реакцій. Кожна ферментативна реакція – це ланка відповідного метаболічного циклу, а всі метаболічні шляхи в сукупності складають обмін речовин. Біохімічні реакції також взаємозв'язані і протікають в певному порядку і послідовності. Так, обмін нуклеїнових кислот, білків, ліпідів, вуглеводів на перших етапах відбувається різними шляхами, але у результаті утворюються одні й ті ж кінцеві продукти. При окисленні всіх органічних речовин в організмі утворюються СО2 і Н2О, а при окисленні нуклеїнових кислот і білків, крім того, азотовмісні сполуки: сечовина, сечова кислота та ін.
Одним з „вузлових” метаболітів, який як би стоїть на перетині багатьох метаболічних шляхів, є піруват. В одних випадках ним завершується розщеплення складних речовин (наприклад, глікогену), в інших – починається біосинтез. Взаємозв'язок різних видів обміну в основному здійснюється через реакції циклу трикарбонових кислот. З окремих метаболітів, що містяться в клітинах, при необхідності утворюються структурні одиниці нуклеїнових кислот, білків, вуглеводів, ліпідів і т.д.
Взаємозв'язок обміну нуклеїнових кислот із обміном інших речовин. Обмін нуклеїнових кислот пов'язаний з іншими видами обміну речовин. Зокрема, інтенсивність біосинтезу залежить від наявності в клітині відповідної „сировини” і білків-ферментів: ДНК- і РНК-полімераз, полінуклеотидфосфорилази, синтетаз пуринових і піримідинових основ та ін. При розпаді пуринових основ утворюється гліоксилова кислота, з якої утворюється гліцин. При розпаді піримідинових основ утворюється b-аланін – джерело утворення пантотенової кислоти і коензима А. Гліцин і b-аланін можуть служити матеріалом для біосинтезу білків.
Існує зв'язок між обміном нуклеїнових кислот і вуглеводів. Так, D-рибоза і D-дезоксирибоза використовуються для біосинтезу нуклеозидів, нуклеотидів і нуклеїнових кислот. Біосинтез вуглеводів залежить від біосинтезу нуклеїнових кислот. Частина УТФ використовується для утворення уридиндифосфоглюкози – основи для біосинтезу поліглюканів.
b-Окислення вищих жирних кислот дає клітині макроергічні сполуки – нуклеозиди- і нуклеозидтрифосфати, які є джерелами хімічної енергії для утворення багатьох речовин. Біосинтез деяких фосфоліпідів залежить від ЦТФ.
Утворення нейтральних жирів із вуглеводів. Вуглеводи служать джерелом утворення жирів. Зв'язуючими ланками переходу вуглеводів у жири і назад є піруват і ацетил-КоА. З них залежно від потреби організму можуть утворюватися інші ліпіди. Гліцерин може утворюватися шляхом відновлення 3-фосфогліцеринового альдегіду або фосфодіоксіацетона (продуктів глікогеноліза або гліколіза). З піровиноградної кислоти утворюється ацетил-КоА, а з нього – вищі жирні кислоти.
Утворення вуглеводів із жирів. Вуглеводи в організмі можуть синтезуватися з жирів. Цей процес має особливе значення для тварин, які впадають в зимову сплячку. Запаси жиру у цих тварин до моменту сплячки досягають 50% загальної маси, дихальний коефіцієнт взимку низький – 0,4 – 0,6. Під впливом клітинних ліпаз жир гідролізується. Гліцерин окислюється в гліцериновий альдегід, який фосфорилується і може бути джерелом утворення глюкози і глікогену. З вищих жирних кислот при b-окисленні утворюється ацетил-Ко А, з нього – піруват і інші речовини, характерні для анаеробіозу. З глюкози утворюється, глікоген, ацетил-КоА виникає при розпаді інших ліпідів.
Утворення білків із вуглеводів. Між вуглеводним і білковим обміном існує взаємозв'язок через загальні метаболічні шляхи перетворення:
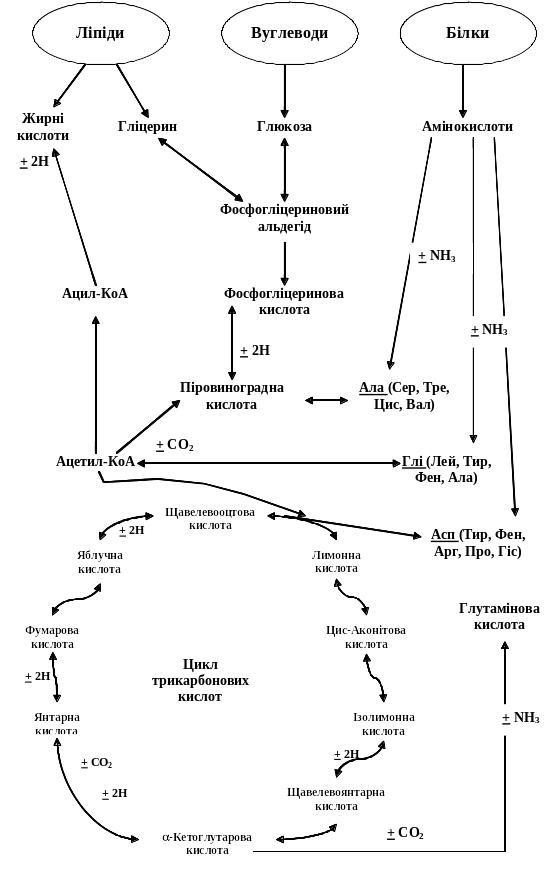
І в даному випадку ключовим продуктом обміну є піруват, з якого можуть утворитися аланін, фенілаланін, тирозин, триптофан, гістидин та ін. Крім того, з пірувата утворюється щавелевооцтова кислота, з якої синтезується аспарагінова. В ході функціонування циклу трикарбонових кислот утворюється a-кетоглутарова кислота, з якої синтезується глутамінова, і т.д. Процеси перетворення вуглеводів у білки і білків у вуглеводи регулюються глюкокортикоїдами.
Єдність обміну речовин в організмі. Обмін різних речовин в організмі є єдиним цілим. Залежно від потреб організму в тканинах і клітинах із загальних продуктів хімічних реакцій можуть синтезуватися необхідні для життєдіяльності речовини. Ведуча роль в цих процесах належить ферментам. Наявність у клітині ДНК забезпечує передачу генетичної інформації і сувору специфічність у структурі найважливіших біополімерів. При розщепленні вуглеводів і ліпідів, а іноді і білків, поновлюються запаси АТФ та інших макроергічних сполук.
Таким чином, живий організм є саморегульованою системою, яка за рахунок безперервного обміну речовин забезпечує своє існування. Порушення реакцій обміну і діяльності цієї системи призводить до патології.
Лекція № 17. Контроль і регуляція метаболізму.
Живі організми – відкриті системи, важливою умовою існування яких є підтримання сталості складу внутрішнього середовища, стабільності біохімічних параметрів, що визначають поняття гомеостазу. Все це забезпечується за участю специфічних внутрішніх та зовнішніх факторів у процесі тісної взаємодії організму з навколишнім середовищем. Забезпечення регуляції процесів життєдіяльності є необхідною умовою існування організмів. Злагоджений перебіг біохімічних перетворень, їх тісний взаємозв'язок і взаємозумовленість, можливість взаємоперетворення різних класів органічних сполук, швидка мобілізація внутрішніх резервів організму забезпечує існування живих організмів в умовах взаємодії їх з навколишнім середовищем.
При зміні умов навколишнього середовища включаються механізми, які забезпечують динамічну стабілізацію основних параметрів, що визначають життєдіяльність. Механізми регуляції сформувались у процесі тривалої еволюції і відповідають завданню максимального виживання організму. Дані механізми включаються на самих ранніх рівнях організації живих систем і здійснюються на молекулярному, субклітинному, клітинному та організменному рівнях. Для кожного з них характерні певні специфічні закономірності та загальні принципи, що реалізуються як на рівні окремих клітин, так і на рівні організму в цілому. Розрізняють декілька рівнів регуляції процесів життєдіяльності – метаболітний, оперонний, клітинний, організменний, популяційний та ін.
Регуляція на рівні мембрани
У дослідженнях на бактеріях вдалося точно охарактеризувати механізми, що забезпечують активне і специфічне проникнення в клітину деяких метаболітів завдяки участі в них білків пермеаз, які переносять ці метаболіти через мембрани. Деякі з пермеаз, наприклад білок М, що відповідає за активне перенесення β-галактозидів, вже стають відомі. Значно менше вивчений активний специфічний транспорт субстратів всередину тваринних клітин. Наведемо декілька прикладів.
– Всмоктування вуглеводів в кишечнику є специфічним і активним процесом. Швидкість всмоктування для різних вуглеводів неоднакова. Активний транспорт забезпечує всмоктування вуглеводів тільки D-ряду. Глюкоза і галактоза переносяться активно, але фруктоза не піддається активному транспорту.
– Проникнення вуглеводів усередину клітини ставить складні проблеми. В загальному, фундаментальне значення тут приписують інсуліну. Цей гормон сприяє активному надходженню глюкози і галактози, але не фруктози. Гіперглікемія, яка спостерігається при панкреатичному діабеті, частково пояснюється порушенням транспорту глюкози в клітини.
– Рух води і іонів в нирках до певної міри знаходяться під гормональним контролем. Іони Na+ реабсорбуються в основному в проксимальній частині каналу, проте частина їх абсорбується і на дистальній ділянці. Ця остання реабсорбція активується альдостероном. Реабсорбція іонів Na+ супроводжується секрецією іонів К+. Вазопресин сприяє проходженню води через мембрани, стимулюючи також і реабсорбцію води в нирках.
– Мембрана нервового волокна володіє вибірковою проникністю по відношенню до іонів. Зміни проникності відповідальні за формування току дії нервового імпульсу.
Мембрани беруть участь в регуляції ще і завдяки іншим своїм властивостям, частково зв'язаним між собою, а саме:
– здатність мембран фіксувати гормони. Мембрани різних типів клітин містять специфічні ділянки фіксації (рецептори) нестероїдних гормонів. Наявність специфічного для даного гормону рецептора на мембрані обумовлює активність цього гормону в клітині.
– ферментативній активності мембран. Клітинні мембрани містять ферменти; деякі з них, наприклад аденілатциклаза, зв'язані з рецепторами гормонів. Інші ферменти, такі, як АТФ-ази, беруть участь у проникненні іонів до клітини.
– участь у регуляції клітинного росту, ймовірно за допомогою регуляції синтезу ДНК. Контактне гальмування здійснюється через посередництво мембрани.
Регуляція за участю циклічного АМФ (цАМФ)
цАМФ відіграє основну регуляторну роль на різних рівнях. Синтез цАМФ сам по собі є об'єктом регуляції. Цей синтез управляється мембранним ферментом – аденілатциклазою, активність якого контролюється гормонами, що фіксуються на специфічних ділянках мембрани. Молекули цАМФ відіграють, таким чином, роль „вторинних вісників” цих гормонів. Два гормони, які впливають на одну і ту ж клітину шляхом активації аденілатциклази, наприклад адреналін і глюкагон у печінці, володіють однаковою фізіологічною активністю. цАМФ гальмується ферментом фосфодіестеразою, який наявний в цитозолі і в плазматичній мембрані. Вважають, що дія цАМФ у еукаріот завжди виявляється через посередництво тієї або іншої протеїнкінази, яку він активує. Специфічність різних протеїнкіназ дуже різноманітна. Вони локалізовані головним чином у цитозолі, плазматичній мембрані і в білках хроматина (останні, проте, не активуються цАМФ). Перерахуємо основні види регуляторної активності цАМФ:
– Метаболічна роль. цАМФ активує глікогеноліз і ліполіз і гальмує глікогеногенез.
– Дія на синтез і виділення гормонів. Виділення гіпофізарних гормонів знаходиться під контролем гормонів гіпоталамуса. Гіпофізарні гормони направляють синтез і виділення гідрокортизону, статевих гормонів і тиреоїдних гормонів. Всі ці явища управляються цАМФ, який стимулює також і виділення інсуліну.
– Дія на секрецію. цАМФ стимулює секрецію амілази, НСl, шлункового соку, простагландину і кальцитоніну.
– Дія на мембранну проникність. Вазопресин і окситоцин сприяють проникненню води і активному транспорту іонів Na+. цАМФ діє також на синаптичні мембрани і тим самим на проведення нервового імпульсу.
– Дія на білковий синтез. цАМФ активує протеїнкінази, які фосфорилують рибосомальні білки, проте наслідки цього фосфорилування невідомі. цАМФ стимулює синтез певних білків, наприклад синтез тирозинтрансамінази. Він, є медіатором індукції ферментів деякими гормонами.
– Дія на транскрипцію. Ця дія добре вивчена у бактерій. У еукаріот вона менш очевидна, хоча фосфорилювання білків хроматина і стимулює транскрипцію, але протеїнкинази хроматина нечутливі до цАМФ.
– Дія на ріст клітин. цАМФ є інгібітором клітинного росту. Чим швидше росте клітина, тим менше вона містить цАМФ. цАМФ, ймовірно, бере участь у контактному гальмуванні. Ракові клітини бідні цАМФ. Додавання цАМФ до ракових клітин уповільнює їх ріст і сприяє нормалізації їх морфології.
– Дія на гладеньку мускулатуру і серцевий м'яз. цАМФ викликає пониження тонусу гладеньких м'язів. Для серцевого м'яза він є медіатором дії норадреналіну.
– Дія на агрегацію клітин. цАМФ гальмує агрегацію кров'яних пластинок, стимулює дисперсію меланофорів шкіри, викликаючи її пігментацію.
– Вплив на рухливість. цАМФ стимулює рухливість сперматозоїдів і найпростіших. Він проявляє свою активність в мікротрубочках, що відповідають за переміщення внутрішньоклітинних компонентів.
Метаболічний рівень регуляції
Метаболічний рівень регуляції забезпечує узгодженість процесів обміну за рахунок зміни концентрації метаболітів. Метаболіти – це низькомолекулярні сполуки, які потрапляють в організм з продуктами харчування або утворюються в результаті послідовних ферментативних перетворень різних сполук. Оскільки основна маса метаболітів утворюється внаслідок ферментативних перетворень, то даний рівень регуляції забезпечується за рахунок заміни активності ферментних систем.
Регуляція активності ферментних систем здійснюється кількома шляхами – за участю специфічних і неспецифічних механізмів та зміни об'єму синтезу ферментів. Перший та другий механізми регуляції включають ізостеричну та алостеричну взаємодію, а також вплив температури, значення рН, концентрації субстратів та ін. Зміна об'єму синтезу ферментів забезпечується, як правило, за рахунок індукції та репресії.
Зміна концентрації субстратів досягається переважно за рахунок компартменізації, скоординованості біохімічних перетворень у просторі і часі. Окремі біохімічні перетворення локалізовані на певних ділянках клітин – в органелах, цитоплазмі чи мембранних системах, де і зосереджені відповідні ферментні системи. Синтез білка здійснюється на рибосомах, гліколіз – у цитоплазмі, процеси біологічного окислення – на внутрішній мембрані мітохондрій. Завдяки цьому численні біохімічні перетворення, досить часто зовсім протилежні (розщеплення і синтез), здійснюються одночасно, не заважаючи один одному, тобто за рахунок компартменізації забезпечується просторова скоординованість біохімічних перетворень.
Перебіг біохімічних реакцій у живих організмах здійснюється також у суворій послідовності, внаслідок чого створюється, як правило, ланцюг взаємопов'язаних реакцій, в яких кінцеві продукти одного перетворення можуть бути використані у вигляді вихідних продуктів для наступного перетворення. Так, анаеробне перетворення вуглеводів (гліколіз) включає одинадцять послідовних реакцій, кожна з яких створює умови для перебігу наступної, тобто швидкість кожної з цих реакцій залежить від метаболітів, що утворюються в результаті попередньої. При цьому швидкість процесу гліколізу може регулюватись як певними метаболітами, що утворюються внаслідок даного перетворення, так і кінцевими продуктами гліколізу (молочна кислота може гальмувати утворення вихідного субстрату – глюкозо-6-фосфату).
Регуляція метаболічних реакцій здійснюється за принципом зворотного зв'язку (ретрогальмування). Важлива роль у забезпеченні даного процесу належить мультиферментним комплексам і системам, в яких індивідуальні ферменти організовані так, що продукт попередньої реакції є субстратом наступної. Прикладом може бути піруватдекарбоксилазний комплекс, синтетаза жирних кислот та ін.
Метаболіти, за участю яких забезпечується регуляція швидкості ферментативних перетворень, можуть мати екзогенне походження. Так, синтез білка в гетеротрофних організмах лімітується надходженням незамінних амінокислот.
Регуляція активності ферментних систем може здійснюватись за рахунок зміни концентрації ефекторів (активаторів та інгібіторів) алостеричних ферментів. Зв'язуючись з алостеричним центром, ефектори можуть кооперативно змінювати конформацію субодиниць, що призводить до зміни просторової орієнтації як усієї молекули ферменту, так і ділянок її, що відповідають за перетворення субстрату (активних центрів), а це спричиняє зміну активності ферменту в бік її зниження чи підвищення. Ефекторами, як правило, є низькомолекулярні метаболіти, іони металів, гормони. Кількість алостеричних ферментів при цьому не змінюється.
Слід зазначити, що метаболіти можуть виступати і в ролі ізостеричних (конкурентних) інгібіторів ферментів.
Активність ферментів значною мірою залежить від зміни умов, в яких проходить ферментативне перетворення. Ферменти досить чутливі до зміни температури, рН середовища, іонної сили тощо.
Регуляція активності ферментних систем може забезпечуватись також за рахунок зміни кількості ферментів. Кількість ферментів у клітині залежить від наявності білків-репресорів, які кодуються геном-регулятором. Залежно від того, в якому стані утворюється білок-репресор, розрізняють індукцію (збільшення) та репресію (зменшення) синтезу ферментів.
У вигляді індукторів, як правило, виступають низькомолекулярні сполуки, продукти ферментативних перетворень (метаболіти). Ферменти, що утворюються внаслідок індукції, називаються індукованими.
Оперонний рівень регуляції
Даний рівень регуляції процесів життєдіяльності забезпечується на рівні оперона. Оперон – ділянка ДНК, обмежена промотором і термінатором, яка знаходиться під регуляторною дією гена-регулятора і забезпечує синтез молекул іРНК. Оперон може бути моно- і поліцистронним. У першому випадку він забезпечує синтез однієї молекули іРНК, яка може виступати в ролі матриці в процесі синтезу білка, а в другому – кількох молекул іРНК. Отже, на рівні оперона забезпечується регуляція синтезу іРНК, які використовуються в ролі матриці в процесі синтезу білка на рибосомах. Білки – ферменти, синтез яких здійснюється при трансляції, забезпечують численні ферментативні перетворення різних субстратів. Слід зазначити, що при трансляції здійснюється також синтез білків, які не мають ферментативних властивостей (гістонові, рибосомальні й ін.), які забезпечують перебіг досить важливих процесів обміну. Синтез цих білків також регулюється на рівні оперона за рахунок зміни об'єму синтезу іРНК при транскрипції.
Регуляція синтезу іРНК на оперонному рівні забезпечується за рахунок кількох механізмів, серед яких важливе значення має індукція і репресія, посттранскрипційна модифікація, взаємодія з хроматином гормон-рецепторних комплексів тощо. За участю даних механізмів здійснюється зміна метаболічної активності та регуляція функцій геному.
Клітинний рівень регуляції
Якщо врахувати, що клітина є основною структурною одиницею живих організмів, то інтенсивність перебігу обмінних процесів у ній відіграє вирішальну роль у забезпеченні процесів життєдіяльності. Механізми, що забезпечують регуляцію процесів життєдіяльності на клітинному рівні, досить різноманітні. Серед них найважливіше значення мають ядерно-цитоплазматичні відносини, посттранскрипційні та посттрансляційна модифікації макромолекул, макромолекулярна взаємодія, транспорт речовин та іонів.
Суть ядерно-цитоплазматичних взаємовідносин полягає у взаємозалежному контролі синтезу важливих біополімерів клітин. Так, синтез структурних компонентів деяких біополімерів, зокрема субодиниць ферментів, може здійснюватись на рибосомальному апараті в цитоплазмі та автономному апараті білкового синтезу в мітохондріях чи хлоропластах.
Регуляція синтезу субодиниць ферментів у першому випадку забезпечується за рахунок ядерного апарата клітини, а в другому – відповідно хлоропластного чи мітохондріального геному, локалізованого в цитоплазмі.
Такий ядерно-цитоплазматичний контроль характерний для синтезу багатьох білків-ферментів, зокрема таких, як цитохромоксидаза, протонна Н+-АТФ-аза, рибулозо-1,5-дифосфаткарбоксилаза, а також білків, що входять до складу мембранних структур клітини. За рахунок ядерно-цитоплазматичних відносин забезпечується злагоджена робота білок-синтезуючих систем клітини, внаслідок чого здійснюється синтез численних білків з характерними властивостями та функціями, підтримуються на належному рівні всі процеси обміну в клітині.
Суть посттранскрипційної та посттрансляційної модифікацій біомолекул полягає у перетворенні попередників, що утворюються в результаті транскрипції чи трансляції на функціонально-активні молекули. Посттранскрипційна модифікація різних видів РНК, що утворюються в процесі транскрипції (тРНК, мРНК, рРНК), полягає в метилюванні азотистих основ мононуклеотидів, вирізанні певної послідовності нуклеозидмонофосфатів, приєднанні певних олігонуклеотидних фрагментів та функціональних груп тощо. Забезпечується це з участю специфічних ферментів, характерних для певного виду модифікацій. Прикладом може бути посттранскрипційна модифікація іРНК, яка здійснюється в результаті процесингу і сплайсингу первинного транскрипту.
Процеси посттранскрипційної модифікації різних видів РНК клітини називаються дозріванням. Формування функціонально-активних молекул у процесі посттранскрипційної модифікації значною мірою визначає інтенсивність білкового синтезу в клітині.
Важливе значення у забезпеченні перебігу метаболічних процесів в організмі має також посттрансляційна модифікація білкових молекул, синтез яких здійснюється на рибосомальному апараті клітини. Суть посттрансляційної модифікації полягає у відщепленні пептидних фрагментів, приєднанні функціональних груп та модифікації залишків амінокислот тощо. Прикладом посттрансляційної модифікації є глікозилювання білків – приєднання вуглеводних компонентів, залишків фосфату, внаслідок чого утворюються різні групи складних білків. Посттранскрипційна модифікація забезпечує утворення множинних форм ферментів, які відіграють важливу роль у регуляції метаболічних процесів. Регуляція процесів життєдіяльності на клітинному рівні забезпечується також за рахунок взаємодії між макромолекулами (білок – білкової, білок – нуклеїнової, білок – ліпідної, вуглевод – білкової взаємодії).
Взаємодія між різними біомолекулами в клітині забезпечує злагодженість та скоординованість біохімічних перетворень, характерних для живих систем. Найсуттєвішим серед інших видів взаємодії є білок – білкова взаємодія.
Даний вид взаємодії сприяє утворенню мультиферментних комплексів, ферментів мультимерів, які забезпечують поетапне перетворення різних субстратів, а також утворення гормон-рецепторних комплексів, що забезпечують дію гормонів пептидної та білкової природи.
Внаслідок білок-ліпідної взаємодії забезпечується структура та функції мембранних систем клітини, визначається рівень біологічної активності мембранно-зв'язаних ферментів, ступінь проникності мембран для різних метаболітів тощо.
Організменний і популяційний рівні регуляції
Організменний рівень регуляції забезпечується за рахунок складних механізмів, для здійснення яких необхідна наявність спеціальних диференційованих клітин і систем, що виявляють контрольну функцію (нервові клітини, ендокринні залози). Отже, регуляція процесів життєдіяльності на організменному рівні відбувається на рівні нервової та ендокринної систем (нейрогуморальний механізм регуляції). Нервові клітини та ендокринні залози забезпечують досить тонкі механізми регуляції процесів життєдіяльності. Зв'язок між ними здійснюється на рівні гіпоталамічної ділянки мозку і гіпофіза. Нервова регуляція, як система екстреного реагування та більш повільна гормональна регуляція, складають дві сторони єдиного важливого процесу, який забезпечує існування живих організмів в умовах постійного двостороннього зв'язку з навколишнім середовищем.
Суть популяційного рівня регуляції полягає у взаємодії між певними популяціями за рахунок впливу хімічних сполук, що продукуються одними з них, на обмін речовин та поведінкові реакції інших. Реалізуються популяційні взаємовідносини через систему рецепторів тканин – мішеней реципієнтів. Найчастіше внутрішньовидова та міжвидова взаємодії забезпечуються за допомогою таких сполук, як антибіотики, терпени, фітонциди, фітоалексини, фітогормони та ін.
Дослідження взаємовідносин між популяціями є предметом науки – хімічної екології, яка займається розробкою екологічної стратегії та з'ясуванням суті механізмів біохімічних зв'язків між організмами в живій природі.
ГАГ
