
- •З історії розвитку біохімії
- •Напрями і методи дослідження в біохімії
- •Хімічний склад тваринного організму
- •Хімічний склад деяких органів і тканин, % (по с. M. Рапопорту)
- •Хімічний склад живої клітини (по о. Гізе)
- •Біологічні мембрани
- •Основні поняття і терміни біологічної хімії
- •Загальна характеристика, будова та функції вуглеводів
- •Загальна характеристика, будова та функції ліпідів
- •Білки. Амінокислоти
- •Класифікація l-a-амінокислот, які входять до складу білків, основана на полярності їх r–груп
- •Деякі амінокислоти, які не входять до складу білків, але відіграють важливу
- •Оптимальні значення рН для деяких ферментів (зa t.T. Березовим і б.Ф. Коровкіним)
- •Катіони металів, які активують деякі ферменти
- •Молекулярна активність деяких ферментів (за в.Й. Розенгартом)
- •1. Оксидоредуктази
- •2. Трансферази
- •3. Гідролази
- •5. Ізомерази
- •Вміст цукру в крові людини і деяких тварин
- •Добова потреба організму людини в жирах залежно від характеру трудової діяльності
- •Вміст мінеральних речовин у тваринних тканинах і органах
5. Ізомерази
Ці ферменти каталізують реакції внутрішньомолекулярного переміщення різних груп органічних речовин. Складаються з п’яти підкласів.
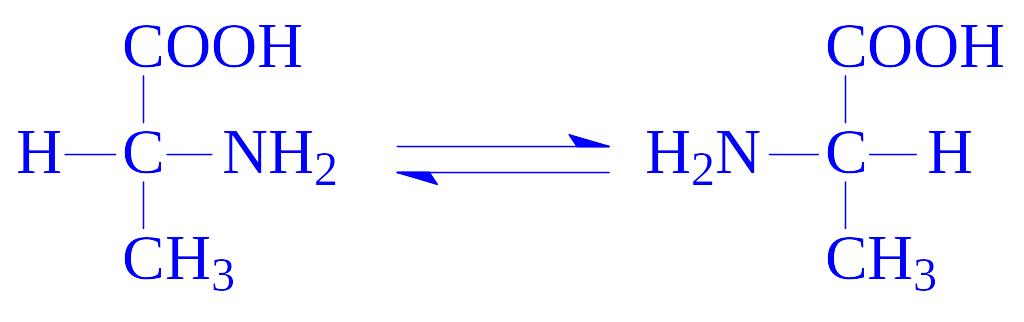
5.1. Рацемази і епімерази. Каталізують реакції інверсії асиметричних груп в молекулах різних речовин. Розрізняють чотири підпідкласи: рацемази і епімерази амінокислот і їх похідних, оксикислот і їх похідних, вуглеводів і їх похідних і інших сполук. Ферменти, що здійснюють реакції ізомеризації в субстратах з одним асиметричним атомом, називають рацемазами. До них слід віднести бактерійні ферменти, які перетворюють L-амінокислоти в D-амінокислоти, зокрема аланінрацемазу (аланінрацемаза, КФ 5.1.1.1):
Ферменти, що здійснюють перетворення субстратів з декількома асиметричними атомами вуглецю, називаються епімеразами. Так, УДФ-глюкозоепімераза (УДФ-глюкозо – 4-епімераза, КФ 5.1.3.2) в тканинах молочної залози ізомеризує УДФ-глюкозу в УДФ-галактозу, яка необхідна для біосинтезу лактози (за участі НАД і іонів Mg2+):
УДФ-глюкоза « УДФ-Галактоза
5.2. Цис-транс-ізомерази. Ці ферменти змінюють геометричну конфігурацію органічних сполук, що містять подвійні зв’язки. Зокрема, малеїнатізомераза (малеїнат – цис-транс-ізомераза, КФ 5.2.1.1) здійснює перетворення:
![]()
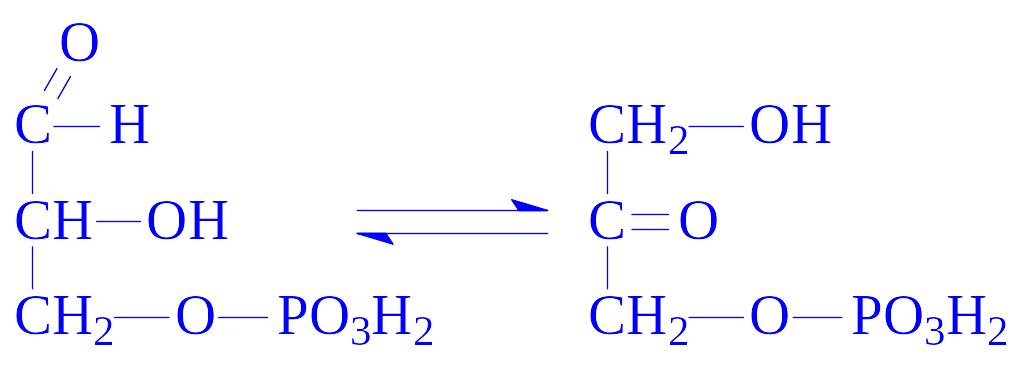
5.3. Внутрішньомолекулярні оксидоредуктази. Ці ферменти каталізують взаємні перетворення альдоз і кетоз. З їх участю окислюються –CH–ОН-групи, одночасно відновлюється сусідня СО-група. Так, тріозофосфатізомераза (D-гліцеральдегід-3-фосфат – кетол-ізомераза, КФ 5.3.1.1) каталізує реакцію:
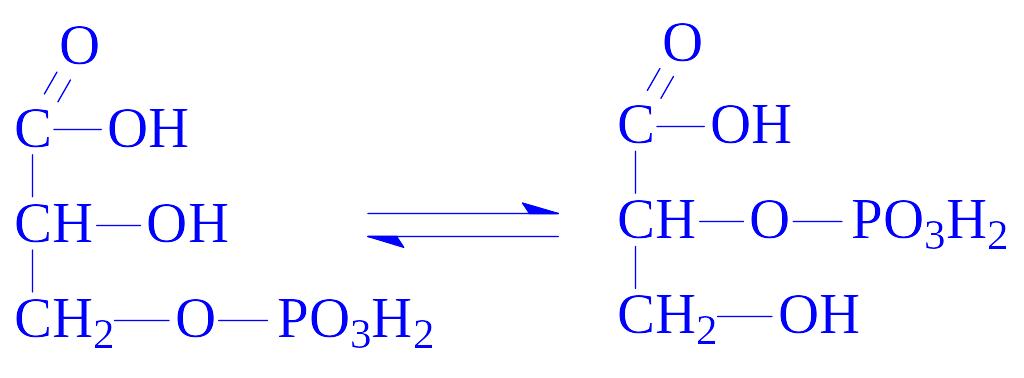
5.4. Внутрішньомолекулярні трансферази. Ці ферменти часто називають мутазами. Вони переносять певні групи з однієї частини молекули на іншу. Так, під впливом фосфогліцерат-фосфомутази (D-фосфогліцерат – 2,3-фосфомутази, КФ 5.4.2.1) відбувається реакція:
5.5. Внутрішньомолекулярні ліази. До ферментів, що каталізують внутрішньомолекулярні перетворення ліазного типу, відноситься муконат-циклоізомераза (4-карбоксиметил-4-оксиізокротонолактон – ліаза (дециклізуюча), КФ 5.5.1.1), що каталізує реакцію:
(+)-4-карбоксиметил-4-окси-ізокротонолактон = Цис-цис-муконат
6. лігази (синтетази)
Ці ферменти каталізують реакції з’єднання двох молекул та реакції спряжені з відщепленням залишків фосфорної кислоти від АТФ або її аналогів. Термін „лігази” застосовують також до ферментів, що каталізують реакції синтезу без нуклеозидтрифосфатів. Вони сприяють утворенню хімічних зв’язків, що власне і є причиною їх назви (від лат. ligare – зв’язувати). Механізм реакцій складний. Він є або трьохстадійним перенесенням, або утворенням потрійних комплексів. Кофакторами багатьох лігаз є біотин і його похідні. Число лігаз, відомих зараз, досягає 100.
6.1. Лігази, які утворюють С–О-зв’язки. До підкласу належать ферменти, що каталізують приєднання амінокислот до відповідних тРНК. Число лігаз відповідає кількості амінокислот, які використовуються для біосинтезу молекул білків. Утворюються аміноацил-тРНК. Так, тирозил-тРНК – синтетаза (L-тирозин: тРНК – лігаза (АМФ), КФ 6.1.1.1) за наявності іонів Mg2+ і K+ каталізує реакцію
АТФ + L-Тирозин + тРНК = АМФ + Пірофосфат + L-Тирозил-тРНК
6.2. Лігази, які утворюють С–S-зв’язки. Ці ферменти здійснюють утворення С–S-зв’язків між залишками жирних кислот і KoA. Зв’язок макроергічний. Активований залишок жирної кислоти залучається до всіляких реакцій синтезу або розщеплення. Так, під впливом ацетил-KoA – синтетази (ацетат: KoA – лігази (АМФ), КФ 6.2.1.1) і за наявності іонів Mg2+ в різних тканинах протікає реакція
АТФ + Ацетат + KoA = АМФ + Пірофосфат + Ацетил-КоА
6.3. Лігази, які утворюють С–N-зв’язки. Підклас складається з п’яти підпідкласів: амідсинтетази, пептидсинтетази, циклолігази, інші С–N-лігази і С–N-лігази з глутаміном в ролі N-донора. Особливе значення мають пептидсинтетази, під впливом яких з амінокислот синтезуються пептиди. Наприклад, g-глутамілцистеїнсинтетаза (L-глутамат:L-цистеїн – лігаза (АДФ), КФ 6.3.2.2) в тканинах печінки за наявності іонів Mg2+ каталізує реакцію утворення дипептида:
АТФ + L-Глутамат + L-Цистеїн = АДФ + Ортофосфат + g-L-глутаміл-L-цистеїн
6.4. Лігази, які утворюють С–С-зв’язки. З цього підкласу найбільш детально вивчена карбоксилаза, що каталізує реакцію карбоксилування. Так, під впливом піруваткарбоксилази (піруват: CO2 – лігази (АДФ), КФ 6.4.1.1) в тканинах за наявності іонів Mg2+ з піровиноградної кислоти і вуглекислого газу утворюється щавелевооцтова кислота:
АТФ + СН3–СО–СООН + СО2 + Н2О = НООС–СН2–СО–СООН + АДФ + Н3РО4
Другий фермент цього підпідкласу ацетил-КоА – карбоксилаза (ацетил-КоА:CO2 – лігаза (АДФ), КФ 6.4.1.2) каталізує утворення з ацетил-КоА і СО2 малоніл-КоА – проміжного продукту біосинтезу вищих жирних кислот:
АТФ + Ацетил-КоА +СО2 + Н2О = АДФ + Ортофосфат + Малоніл-КоА
Класифікація і номенклатура ферментів у ході розвитку біохімії і в результаті відкриття нових ферментів постійно удосконалюються, а їх число з кожним роком збільшується.
Взаємозв’язок між ферментами
Обмін речовин в організмі каталізується поліферментними системами, в які входять ферменти, що належать до всіх шести класів. Між ферментами існує взаємозв’язок, спадкоємність і послідовність. Для нормального протікання обмінних процесів необхідні оптимальні умови ферментативного каталізу. Відсутність одного з ферментів системи спричиняє за собою порушення обміну речовин організму в цілому.
Зв’язок між ферментами може носити різний характер. Наприклад, в порожнині шлунку під впливом пепсину починається розщеплення білків продуктів харчування, надалі ці процеси продовжуються, завершуючись в тонкій кишці внаслідок дії ферментів трипсина, хімотрипсина, амінополіпептидаз, карбоксиполіпептидаз, три- і дипептидаз. Часто система зв’язку між ферментами створюється за допомогою проміжних продуктів реакції, причому продукт, що виник в результаті діяльності одного ферменту, є субстратом для наступного ферменту. Прикладами може бути анаеробна фаза розщеплення вуглеводів, цикл трикарбонових кислот, b-окислення жирних кислот, орнітиновий цикл утворення сечовини та ін. Продукти реакції одного ферменту в надлишку можуть гальмувати його активність або активність іншого ферменту. Так, надлишок молочної кислоти в середовищі гальмує активність ЛДГ. Такий вид гальмування діяльності ферментів називається субстратним, оскільки фермент, який сприяє утворенню субстрата, сам виявляється заблокованим. Якщо субстрат гальмує активність ключового ферменту, яким починається метаболічний цикл, таке гальмування називається ретроградним. Так, надлишок молочної кислоти – одного з головних кінцевих продуктів анаеробного глікогенолізу або гліколізу, гальмує діяльність гексокінази, з якої починається розпад глікогену або глюкози. Виникає гальмування діяльності ферменту за принципом зворотного зв’язку.
Існує спадкоємність в діяльності ферментів різних класів. Так, поживні речовини під впливом гідролаз травних соків розщеплюються на прості речовини (монози, гліцерин, жирні кислоти, амінокислоти і т.д.). Вони поступають у кровоносну систему, потім – до органів, тканини і клітини. В клітинах під впливом різних лігаз з них утворюються речовини, необхідні для пластичних, захисних, регуляторних, енергетичних і інших потреб. Такі ферменти прийнято називати регуляторними. Вони зазвичай розміщені на початку мультиферментної системи. Продукт ферментативної реакції в даному випадку діє як алостеричний інгібітор.
У ряді випадків взаємозв’язок ферментів між собою здійснюється генетично, тобто кодується генетичною інформацією, закладеною в молекулі ДНК, і передається через синтез ферментативних білків. Окремі ферменти можуть синтезуватися в клітинах під впливом певного субстрату. На відміну від конституційних ферментів, які завжди присутні в клітині, ці ферменти називають адаптивними, або індуцибельними. Вони синтезуються в клітині у результаті депресії генів, що не допускає утворення цих ферментів, як відповідь на появу в середовищі індуктора-субстрату. Іноді наступає дерепресія синтезу групи ферментів, оскільки дерепресується група генів, розміщених в частині молекули ДНК, відповідальної за синтез цих білків, – опероні.
Ферменти в народному господарстві, медицині, ветеринарії і зоотехнії
Ферменти широко використовуються в народному господарстві. Так, в хлібопеченні застосовують ферментативні препарати, які покращують якість і аромат хліба. Дозрівання тіста прискорюється на 30%, а витрата цукру на виготовлення булочних виробів зменшується в 2 рази. В шкіряному і хутряному виробництві застосовуються препарати пептидогідролаз, які прискорюють видалення шерсті із шкіри і розм’якшення її у декілька разів, а також підвищують сортність і якість шкіри і хутра. Лізоцим застосовується як консервант коров’ячого молока та ікри осетрових риб. Глюкозооксидаза використовується як антиокислювач при зберіганні м’яса, фруктових соків, непастеризованих пива і вина. Використання препарату бактерійної амілази дає можливість зменшити витрату ячменю на виробництво одного декалітра пива на 165 г.
У медицині і ветеринарії широко застосовується ензимодіагностика. Так, багато захворювань печінки (жовтяниця, гепатити, цирози) діагностуються по збільшенню в крові вмісту лужної фосфатази. При різних захворюваннях печінки в крові збільшується вміст альдолази і трансамінази і різко зменшується вміст амілази. Поява в сечі і крові ізоферментів ЛДГ4 і ЛДГ3 може бути ознакою деяких захворювань нирок, ізофермента ЛДГ3 – легень. При інфаркті міокарду в крові зростає вміст амінотрансфераз і альдолази.
Багато ферментів застосовуються з терапевтичною метою. Так, препарат трипсину в поєднанні з антибіотиками використовується при лікуванні хронічних виразок кінцівок, карбункулів, фурункулів, панариціїв (запалення нігтьового ложа) і піодермії (гнійне запалення шкіри). Панкреатична ДНК-аза застосовується при лікуванні деяких респіраторних захворювань. Гіалуронідаза застосовується в невеликих дозах для прискорення всмоктування різних ліків, що вводяться підшкірно. Препарати гіалуронідази застосовуються в хірургії, в офтальмології, тваринництві, гінекології. Вони використовуюся для розсмоктування гематом, ексудатів і транссудатів. Для руйнування тромбів часто використовують фібринолізин. Аспарагіназа, яка розщеплює аспарагін, необхідний для синтезу білків раковими клітинами, застосовується при лікуванні злоякісних утворень.
Лекція № 8. Гормони.
Загальна характеристика гормонів
Гормони – це біологічно активні речовини, які синтезуються залозами внутрішньої секреції і виділяються безпосередньо в кров, лімфу або ліквор. Наука про залози внутрішньої секреції називається ендокринологією.
За хімічною природою гормони є білками (інсулін), пептидами (окситоцин), стероїдами (андростерон), похідними амінокислот (тироксин), фенолами (адреналін). Гормони володіють високою біологічною активністю в дозах 10-3 і навіть 10-6 мг. В організмі тварин за добу синтезується декілька міліграмів або часток міліграмів окремих гормонів. Концентрація їх вимірюється частками грама (10-6 – 10-9) на 100 мл крові. Гормони діють короткочасно і швидко руйнуються. Зазвичай гормони не володіють видовою специфічністю. Так, гормон, отриманий із залоз внутрішньої секреції будь-якого хребетного, має схожу фізіологічну дію.
Для більшості гормонів розшифрована будова їх молекул. Багато гормонів отримано в чистому вигляді (інсулін, фолікулін). Частина гормонів синтезована (адреналін, інсулін, кортизон та ін.). Для деяких були отримані синтетичні аналоги (синестрол). В тканинах виділені гормоноїди, або парагормони, – речовини, що володіють гормональною активністю, такі, як секретин, панкреозин, гепарин, гастрин та ін.
Діяльність залоз внутрішньої секреції контролюється нервовою системою (схема 1).
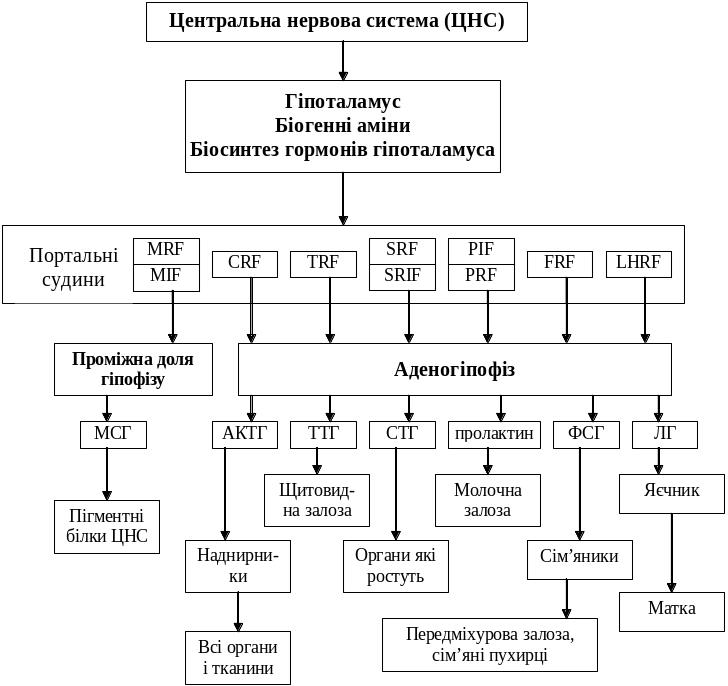
Схема 1. Діяльність залоз внутрішньої секреції
Ще М.М. Чебоксаров (1910) встановив, що черевний нерв є секреторним нервом наднирників. У свою чергу, залози внутрішньої секреції впливають на діяльність нервової системи, у тому числі і кори великих півкуль.
Гормони різносторонньо впливають на багато реакцій обміну речовин – нуклеїнових кислот, білків, вуглеводів, ліпідів, мінеральних сполук. За характером дії гормони діляться на пускові і гормони-виконавці. До пускових відносяться нейрогормони гіпоталамуса та аденогіпофіза. Саме вони стимулюють діяльність відповідних залоз внутрішньої секреції. Гормони-виконавці безпосередньо діють на основні реакції обміну речовин організму, які забезпечують його ріст, розвиток, продуктивність, адаптацію, розмноження, діяльність та ін.
Механізм дії гормонів-виконавців повністю не з'ясований. Припускають три шляхи, по яких гормони діють на тканини і клітини:
зміна проникності клітинних мембран;
взаємодія гормонів з ферментами шляхом утворення оборотних алостеричних зв'язків;
вплив гормонів на генетичну інформацію з подальшою зміною синтезу ферментів.
Посередником між гормоном-виконавцем в одних випадках (білкові і пептидні гормони) служить цАМФ, в інших (стероїдні гормони) внутрішньоклітинні рецептори, в третіх (деякі інші гормони і гормоноїди) – недостатньо вивчені речовини. Через посередників молекула гормону впливає на характер і перебіг різних ферментативних реакцій.
В клініці часто зустрічаються гормональні порушення – гіпо- і гіперфункції залоз внутрішньої секреції.
Гормони в організмі знаходяться в зв'язаному і вільному стані. Між дією різних гормонів існує взаємозв'язок. Так, окремі гормони за своєю дією можуть бути синергістами (соматотропін і тироксин) або антагоністами (інсулін і глюкагон). Відомо близько 100 гормонів і гормоноїдів, які класифікують за будовою, функціями і місцем утворення. Ми розглядаємо класифікацію за місцем утворення, як найпоширенішу.
Гормони гіпоталамуса
Гіпоталамус здійснює зв'язок між центральною нервовою системою і залозами внутрішньої секреції. 32 пари ядер гіпоталамуса беруть участь в регуляції функцій і обміну речовин організму. Регуляція здійснюється нейрогуморальним шляхом. Від нервових центрів гіпоталамуса у відповідні відділи центральної нервової системи відходять пучки нервових волокон. У клітинах багатьох нервових центрів синтезуються гормони, які через кровоносне русло, лімфу і ліквор прямують до клітин відповідних залоз внутрішньої секреції – клітин-мішеней і, в першу чергу, гіпофіза (схема 1).
Хімічна природа. В ядрах гіпоталамуса синтезується, принаймні, сім стимуляторів (рилізинг-факторів) і три інгібітори (рилізинг-гальмуючі фактори) інкреції гормонів гіпофіза. Для деяких з них була вивчена структура і здійснений синтез, інші знаходяться на різних стадіях вивчення.
Тироліберин (тиротропін-рилізинг фактор, ТРФ) має будову Піроглу-Гіс-Про-NH2:
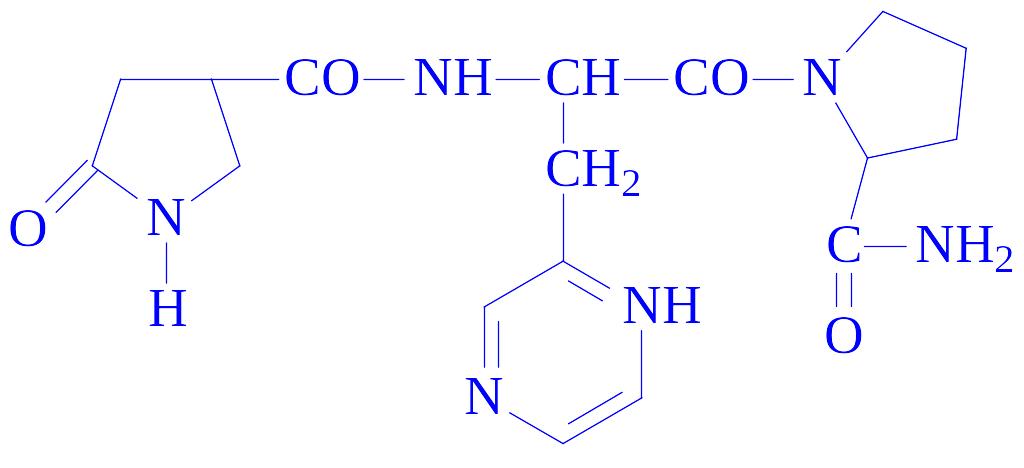
Люліберин (рилізинг-фактор лютеїнізуючого гормону, ЛРФ) має складнішу будову:
Піроглу-Гіс-Три-Сер-Тир-Глі-Лей-Арг-Про-Глі-NН2.
Соматостатин (соматотропін-рилізинг-гальмуючий фактор РГ-РФ,) має таку будову:

Біосинтез. Гормони синтезуються рибосомальним і нерибосомальним шляхом. Біосинтез регулюється центральною нервовою системою і гуморально. Гуморальна регуляція здійснюється гормонами периферичних ендокринних залоз за принципом зворотного зв'язку. Молекули гормонів нагромаджуються в синаптосомах, потім поступають в капіляри портальної системи, після чого впливають на клітини-мішені.
Метаболізм. Питання обміну гормонів вивчені мало. Період біологічного напівжиття молекули тироліберина, що характеризує швидкість його обміну, в крові щура складає близько 4 хв. Інактивація здійснюється відповідними пептидгідролазами. Амінокислоти, що утворюються, використовуються клітинами для різних цілей.
Біологічна дія. Мішенню гормонів є клітини передньої і середньої частин гіпофіза. Припускають, що молекула відповідного гормону спочатку в зовнішній мембрані клітини-мішені активує фермент аденілатциклазу. В результаті утворюється цАМФ, який бере участь в передачі гормонального сигналу. Потім активується діяльність цАМФ-залежної протеїнкінази, синтезуються молекули гормону-виконавця. Активність ферментних систем супроводжується дисоціацією комплексу Са2+–АТФ або Mg2+–АТФ: виділяються катіони і АТФ.
Змінюється порозність мембран. Синтезовані гормони поступають у кровоносне русло, а з нього – до різних органів і тканин.
Патологія. Біосинтез гормонів порушується при багатьох хворобах, особливо центральної нервової і ендокринної систем.
Застосування. Ці гормони поки не отримали належного застосування через недостатнє їх вивчення.
Гормони гіпофіза
Гіпофіз – найважливіша залоза внутрішньої секреції. Разом з гіпоталамусом утворює єдину морфофізіологічну систему, яка регулює різні сторони обміну речовин. Гіпофіз складається з трьох частин: передньої, середньої і задньої. В них синтезується ряд життєво важливих гормонів.
А. Гормони передньої частини гіпофіза (аденогіпофіза).
До гормонів передньої частини гіпофіза належить обширна група різноманітних за біологічною дією і хімічною будовою гормонів.
Соматотропін (гормон росту, соматотропний гормон, СТГ). Соматотропін був відкритий в екстракті гіпофіза Г. Евансом і Дж. Лонгом у 1921 р.
Хімічна природа. Соматотропін належить до білків з невисокою молекулярною масою – 21500 – 46000. Молекула білка складається з одного поліпептидного ланцюга і містить два дисульфідних містки. Активність гормону значною мірою пов'язана з e-аміногрупою лізину і залишками тирозина. Кінцевими групами соматотропіна є залишки фенілаланіна. Гормон володіє властивостями глобулінів, термолабільний, ізоелектрична точка знаходиться близько 6,8, містить 15,6% азоту.
Біосинтез. Гормон синтезується в ацидофільних клітинах передньої частини гіпофіза з амінокислот, які поступають з током крові. Синтез протікає типово для білка.
Біологічна дія. Соматотропін багатогранно діє на всі види обміну речовин. Він активує діяльність ДНК-полімераз. У клітинах зростає біосинтез іРНК і рРНК. Підвищується проникність для амінокислот і інтенсивність біосинтезу білків, зростає мітотичне ділення клітин, посилюється хондріо- і остеогенез, біосинтез глікогену і мобілізація жирів з жирових депо, відкладення кальцію і фосфору в кістках. Він стимулює засвоєння тканинами моноз та проявляє діабетогенну дію.
Патологія. Надмірна продукція гормону в ранньому віці призводить до гігантизму. У людей гігантами називають чоловіків, ріст яких перевищує 200 см, жінок – вище 190 см. Найвища людина, описана в літературі, мала зріст 320 см. Надмірне виділення соматотропіна у дорослих призводить до захворювання – акромегалії, коли у хворих непропорційно збільшуються окремі частини тіла (стопа, кисть, щелепа, губи, ніс). Недостатня продукція гормону в ранньому віці призводить до нанізму – низький ріст і малі розміри тіла (у людини – зріст нижче 120 – 130 см).
Застосування. Гормон використовується як діабетогенний засіб.
Пролактин (лактотропний гормон, маматропін, лактотропін, ПРЛ). Пролактин був виділений з екстракту гіпофіза в 1933 р. Регулює материнський інстинкт, розвиток і функціонування молочної залози.
Хімічна природа. Пролактин відноситься до білків з молекулярною масою 23000 – 24000, термолабільний, ізоелектрична точка – 5,73. У 1969 р. встановлена первинна структура пролактина: послідовність амінокислотних залишків в молекулі пролактина овець, а пізніше – в гормоні великої рогатої худоби.
Біосинтез. Пролактин синтезується з амінокислот в ацидофільних клітинах. Утворення гормону регулюється гормоном гіпоталамуса пролактоліберином. Гормон виділяється в кровоносну систему і ліквор, потім доставляється до клітин-мішеней.
Метаболізм. Після прояву біологічної дії пролактин піддається звичайним перетворенням які типові для проміжного і кінцевого обміну білків.
Біологічна дія. Утворення пролактина стимулюється актом смоктання. Нервові імпульси поступають в центральну нервову систему і гіпоталамус. При цьому активізується біосинтез пролактоліберина, під впливом якого зростає утворення пролактина. З током крові гормон поступає в молочну залозу, де його молекули зв'язуються із спеціальними рецепторами мембран альвеол. Активуються РНК-синтетази, протеїнкінази й інші ферменти. Індукується синтез казеїногена і інших білків, лактози і ліпідів. Пролактин бере участь в регуляції водно-сольового обміну. Його дія зв'язана з діяльністю інших гормонів – естрогену і гестагенів. Пролактин стимулює також розвиток жовтого тіла.
Патологія. При руйнуванні ацидофільних клітин слабшає і припиняється виділення гормону.
Застосування. Пролактин застосовують при зниженій секреції молочної залози в післяпологовий період.
Фолітропін (фолікуло-стимулюючий гормон, ФСГ). Фолітропін – гонадотропний гормон, у самок стимулює ріст і дозрівання фолікул яєчників, у самців – розвиток сперматогенного епітелію в сім’яниках і сперматогенез.
Хімічна природа. Фолітропін належить до складних білків-глікопротеїдів з молекулярною масою до 67 000, ізоелектрична точка – 4,5. Молекула фолітропіна містить азот, сірку, глюкозу і глюкозамін.
Біосинтез. Гормон синтезується в базофільних клітинах з амінокислот, глюкози і глюкозаміну. Утворення гормону регулюється гіпоталамічним фактором – фоліберином.
Метаболізм. Синтезований гормон поступає в ліквор і кровоносну систему, доставляється до клітин-мішеней; після прояву біологічної дії руйнується.
Біологічна дія. Основними клітинами, на які діє фолітропін, є клітини фолікулів і сперматогенного епітелію. Інтенсивність виділення гормону залежить від фаз статевого циклу. Спільно з лютропіном стимулює біосинтез естрогену і частково андрогенів. Володіє біохімічною і імунологічною специфічністю.
Патологія. При руйнуванні базофільних клітин у результаті пошкодження гіпофіза пухлинами або різними інтоксикаціями утворення гормону припиняється.
Застосування. Застосовують аналог фолітропіна – сироватковий гонадотропін крові для стимуляції овуляції або як засіб лікування німфоманії та ін.
Лютропін (лютеїнізуючий гормон, ЛГ). Лютропін – гонадотропний гормон, стимулює у самок ріст фолікулів, їх дозрівання, овуляцію і утворення жовтого тіла.
Хімічна природа. Лютропін відноситься до складних білків-глікопротеїдів з молекулярною масою від 40000 до 100000. Молекула лютропіна містить тирозин, триптофан і глюкозамін.
Біосинтез. Гормон синтезується в базофільних клітинах з амінокислот і глюкозаміна. Утворення гормону регулюється гіпоталамічним фактором – люліберином.
Метаболізм. Синтезований гормон поступає в ліквор і кровоносну систему, доставляється в яєчник; після прояву біологічної дії руйнується.
Біологічна дія. Біологічна дія ЛГ виявляється після попереднього впливу на клітини фолікула ФСГ. ЛГ у самок викликає інтенсивний ріст фолікулів, стимулює овуляцію і утворення жовтого тіла; у самців – розвиток інтерстиціальної тканини сім’яників і синтез тестостерона. Біологічну дію ЛГ відображає схема (на схемі пунктирною стрілкою позначена тонічна секреція ЛГ, жирною – овуляторна хвиля ЛГ):
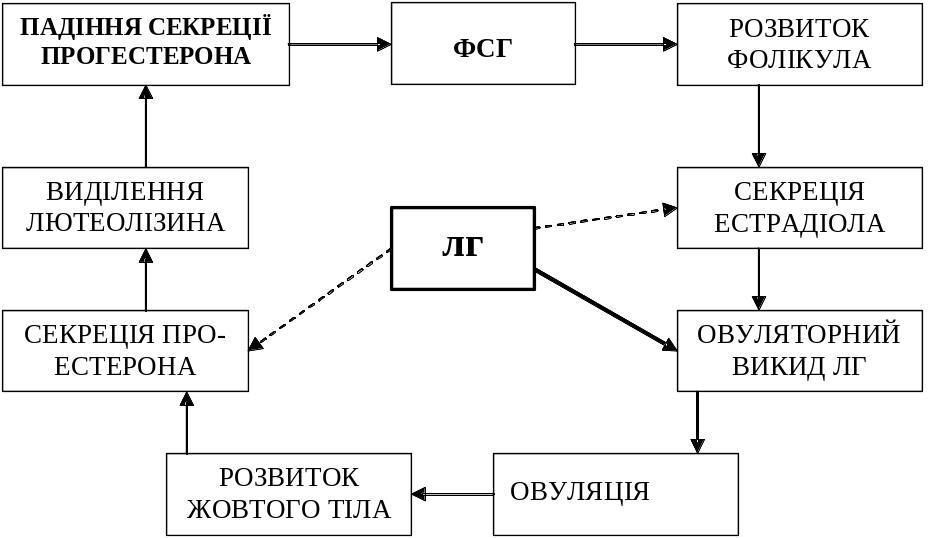
Патологія. При недостатній секреції гормону виникають розлади менструального циклу. Відбувається патологічне збільшення розмірів фолікулів, які не можуть овулювати.
Застосування. Препарати застосовують для стимуляції статевих функцій у інфантильних самок і самців.
Кортикотропін (адренокортикотропний гормон, АКТГ). Гормон стимулює діяльність кори наднирників.
Хімічна природа. АКТГ – нерозгалужений поліпептид, що складається з 39 амінокислотних залишків. Має молекулярну масу 4500. Біологічна активність гормону обумовлена 24 амінокислотними залишками з N-кінцевої ділянки молекули. Решта 15 амінокислотних залишків визначає видові і імунологічні особливості гормону. Вивчено будову АКТГ бика, людини, вівці і свині.
Біосинтез. АКТГ виділяється базофільними клітинами передньої частини гіпофіза у відповідь на роздратування, що приводять організм у стан напруги. Біосинтез АКТГ знаходиться під контролем гормону гіпоталамуса кортиколіберина. Синтез АКТГ протікає звичайним для всіх білків шляхом.
Метаболізм. Синтезований гормон поступає в ліквор і кровоносне русло, потім досягає клітин-мішеней, на які і впливає. Концентрація АКТГ в крові визначається рівнем у ній гормонів кори наднирників. При збільшенні їх вмісту виділення АКТГ зменшується, а при зменшенні – зростає. Після прояву біологічної дії АКТГ швидко розщеплюється відповідними ферментами.
Біологічна дія. АКТГ стимулює ранні етапи біосинтезу гормонів кори наднирників, знижує вміст холестерину в організмі і збільшує його концентрацію в корі наднирників. АКТГ активує ліази, які здійснюють відщеплення від молекули холестерину бічного ланцюга між 20-м і 22-м атомами вуглецю, утворюючи основу ядра для молекул кортикостероїдів. Він активує гідроксилази, сприяючи введенню кисню в 17-е положення вуглецю. АКТГ посилює проникнення глюкози в клітини кори і реакції пентозного циклу, стимулює асиміляцію вітаміну С тканинами наднирників. Пентозний цикл дає можливість клітинам отримати достатню кількість НАД∙Н2 і НАДФ∙Н2, які необхідні для біосинтезу молекул гормонів з ядра холестерину і ацетатів. АКТГ є стимулятором ліпаз, фосфорилаз та інших ферментів. Він проявляє жиромобілізуючу і меланоцитактивуючу здатність. З діяльністю АКТГ пов'язана мобілізація захисних сил організму при різних шкідливих діях: стресах, травмах, інфекціях, токсикозі. АКТГ – антагоніст соматотропіна і пролактина.
Патологія. Біосинтез АКТГ порушується при багатьох захворюваннях, пов'язаних з ушкодженням передньої частини гіпофіза. При цьому зменшується виділення АКТГ і порушуються реакції обміну речовин, в яких він бере участь.
Застосування. АКТГ застосовується як гормональний препарат при недостатній діяльності кори наднирників, лікуванні ревматизму, поліартритів, подагри, екземи, астми, алергій і т.д.
Тиротропін (тиротропний гормон, ТТГ). Гормон стимулює розвиток і діяльність щитовидної залози. Відкритий П. Смітом і Дж. Смітом у 1922 р. як речовина екстракту гіпофіза, що запобігає атрофічному переродженню щитовидної залози.
Хімічна природа. Тиротропін належить до складних білків – глікопротеїдів з молекулярною масою 23000 – 32000, добре розчиняється у воді, ізоелектрична точка рівна 8, інактивується під впливом пепсину, трипсину і хімотрипсину. Молекула тиротропіна складається з a- і b-субодиниць. a-Субодиниця має однакову будову не тільки у різних гормонів (ЛГ і ТТГ), але і у гормонів різних видів тварин. Вони відрізняються лише структурою вуглеводної частини молекули. Специфічна біологічна активність гормону визначається властивостями b-субодиниці. Проте ця активність виявляється тільки після з'єднання a- і b-субодиниць.
Біосинтез. Синтез тиротропіна контролюється центральною нервовою системою і гормоном гіпоталамуса тироліберином. При збільшенні в крові концентрації тиреоїдних гормонів синтез тиротропіна гальмується за принципом негативного зворотного зв'язку: в гіпоталамусі зменшується синтез тироліберина, в гіпофізі – тиротропіна, в щитовидній залозі – тироксина.
Біологічна дія. Тиротропін стимулює ріст і розвиток епітелію фолікул щитовидної залози, активізує діяльність органоїдів, що беруть участь в біосинтезі її гормонів. Механізм його впливу на діяльність щитовидної залози складається з декількох етапів: спочатку гормон активує утворення цАМФ, вона, у свою чергу, біосинтез тиреоглобулінів. Тиротропін сприяє „захопленню” йоду клітинами фолікул і розщепленню тиреоглобулінів на окремі гормони і білковий залишок.
Гормон стимулює, поглинання кисню клітинами щитовидної залози і підвищує їх проникність для моносахаридів, амінокислот і інших речовин.
Патологія. При захворюваннях передньої частини гіпофіза (особливо при пухлинах і токсикозі) сповільнюється і припиняється синтез гормону. Наступає гальмування і припинення біосинтезу тиреоїдних гормонів. Це приводить до патологічних порушень типу мікседеми і зобу.
Застосування. Тиротропін застосовують при лікуванні захворювань щитовидної залози з порушенням її функцій.
Б. Гормони середньої частини гіпофіза
Середня частина гіпофіза утворена епітеліальними клітками. З віком середня частина збільшується в основному за рахунок базофільних клітин. Порожнина між передньою і середньою частинами заповнена колоїдом.
З гормонів середньої частини гіпофіза вивчений один – меланотропін.
Меланотропін (меланоцитстимулюючий гормон, МСГ). Гормон був відкритий як речовина, що регулює пігментацію шкіри.
Хімічна природа. Меланотропін – поліпептид, що складається з 13 – 22 амінокислотних залишків, має молекулярну масу близько 2 тис. Водні розчини гормону дають кольорові реакції, характерні для білків. Одержують гормон з лужних екстрактів гіпофізів великої рогатої худоби і свиней. Розрізняють два типи меланотропіна: a- і b-
CH3CO-Cep-Tиp-Cep-Meт-Глy-Гіc-Фeн-Apг-Tpи-Глі-Ліз-Пpo-Baл-NH2;
Структура a-меланотропіна
NH2-Acп-Глу-Глі-Про-Тир-Ліз-Мет-Глу-Гіс-Фен-Apr-Три-Глі-Сер-Про-Про-Ліз-Асп-ОН
Структура b-меланотропіна
a-Меланотропін зазвичай складається з 13 амінокислотних залишків, b-меланотропін – з 18. a-Меланотропін має однакову будову у різних видів тварин, а b-меланотропін володіє видовою специфічністю. Молекули всіх меланотропінів мають загальний гепталептид, відповідальний за активність гормону: -Мет-Глу-Гіс-Фен-Арг-Три-Глі-.
Біосинтез. Біосинтез гормону регулюється гормонами гіпоталамуса – меланоліберином і меланостатином. Гормон синтезується як типовий поліпептид.
Метаболізм. Гормон поступає в ліквор і кровоносну систему, розноситься по всьому організму де впливає на біосинтез шкірного пігменту меланіну. Після цього молекула гормону руйнується клітинними пептидгідролазами.
Біологічна дія. Меланотропін стимулює діяльність меланофорів: вони збільшуються в розмірах, ускладнюється структура їх відростків і галуження, під впливом гормону амінокислота тирозин перетворюється на меланін. Меланотропін активізує біосинтез світлочутливого пігменту сітківки ока родопсина, сприяє адаптації ока до темноти і підвищує гостроту зору.
Патологія. Причинами порушень можуть бути різні травми гіпофіза, пухлини, інфекційні хвороби, токсикоз.
Застосування. Препарат у вигляді розчину застосовується при лікуванні гемералопії, пігментної дегенерації сітківки ока і міотичного хоріоретиніта.
В. Гормони задньої частини гіпофіза (нейрогіпофіза)
Нейрогіпофіз складається з трьох зон. Зовнішня зона є аксонами нейронів гіпоталамуса і відростками гліоцитів. Центральна зона містить провідні шляхи нейросекреторної системи гіпоталамуса. Внутрішня зона складається з тіл питуїцитів, заповнених гормонами, і гліоцитів.
Гормони нейрогіпофіза – вазопресин і окситоцин – відомі тим, що в їх молекулі раніше, ніж в інших поліпептидах, була встановлена послідовність амінокислотних залишків, головним чином, завдяки класичним роботам Дю Віньо.
Вазопресин (адиуретин, антидиуретичний гормон, ВП, АДГ). Відкритий у 1895 р. як речовина гіпофіза, що підвищує кров'яний тиск.
Хімічна природа. Вазопресин відноситься до циклічних пептидів, складається з дев'яти амінокислотних залишків:
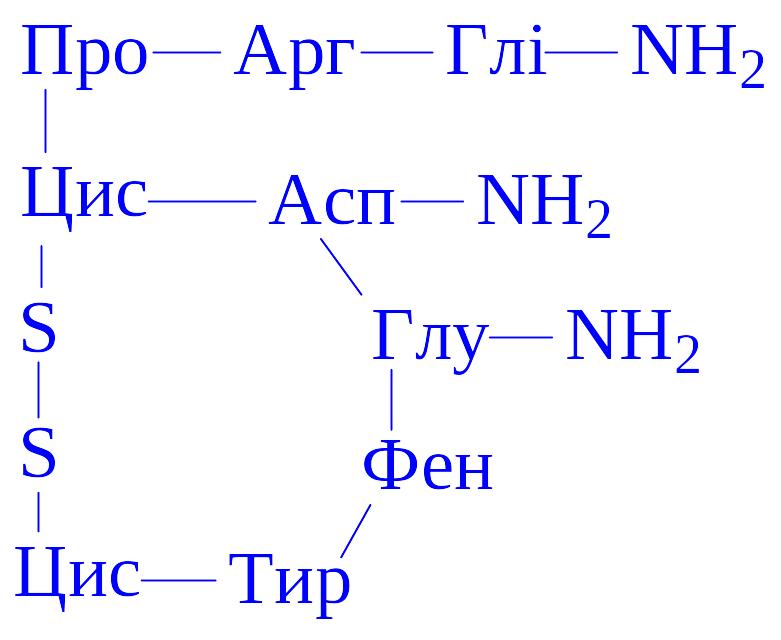
Молекулярна маса вазопресина – 1056, добре розчиняється у воді, дає кольорові реакції на тирозин і лізин, ізоелектрична точка рівна 10,85 – 10,9.
Біосинтез. Вазопресин синтезується в нейронах супраоптичного ядра гіпоталамуса з амінокислот, потім він по аксонах і клітинних відростках передається в задню частину гіпофіза, де і нагромаджується в пітуїцитах. Під впливом відповідних стимулів гормон поступає безпосередньо в кров. За типом негативного зворотного зв'язку при надлишку вазопресина його подальший синтез гальмується.
Метаболізм. Через кровоносну систему гормон розноситься по всьому організму. Після виконання своїх функцій вазопресин інактивується пептидгідролазами з утворенням амінокислот, які використовуються для різних потреб клітин.
Біологічна дія. Вазопресин діє на рецептори кровоносних судин: наступає їх звуження, підвищується кров'яний тиск, відбувається зворотне всмоктування води в ниркових канальцях, останнє послужило причиною ще однієї назви вазопресина – антидиуретичний гормон. Вважають, що гормон активує гіалуронідазу, яка розщеплює в клітинах надлишок гіалуронової кислоти і тим самим підвищує проникність клітинних мембран. Вазопресин бере участь у підтримці відносної постійності водно-сольового обміну в організмі.
Патологія. Порушення гормональної діяльності пов'язані з пошкодженням задньої частини гіпофіза (пухлини, травми, інфекції, отруєння). У хворих виникає нецукровий діабет. Кількість сечі, що виділяється за добу, зростає в п'ять і навіть більше разів.
Застосування. Препарати вазопресина застосовують для нормалізації кров'яного тиску і при лікуванні нецукрового діабету.
Окситоцин (оцитоцин, ОКСТ). Гормон був відкритий у 1895 р. в екстракті гіпофіза.
Хімічна природа. Окситоцин є циклічним пептидом, що складається з дев'яти амінокислотних залишків:
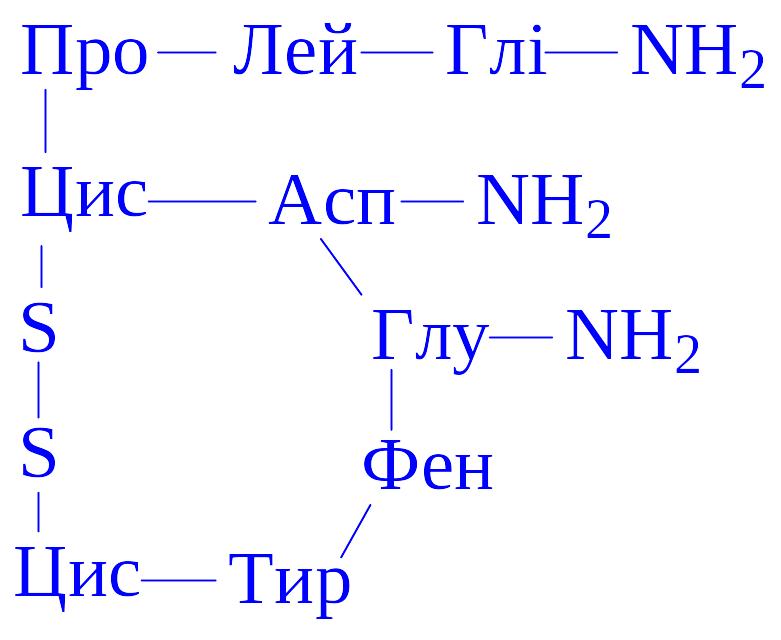
Молекулярна маса гормону складає 1 тис. Гормон добре розчиняється у воді, ізоелектрична точка рівна 7,7. За своїм амінокислотним складом окситоцин схожий з вазопресином. Окситоцин більшості тварин ідентичний по амінокислотному складу. Заміна в окситоцині залишку тирозина залишком фенілаланіна призводить до втрати активності гормону на 95%, ізолейцина валіном – на 65%, ізолейцина лейцином – на 100%.
Біосинтез. Гормон синтезується в клітинах паравентрикулярного ядра гіпоталамуса, потім переміщується в задню частку гіпофіза і нагромаджується в пітуїцитах. Пітуїцити підходять близько до капілярів і через них гормон поступає в кров.
Метаболізм. Обмін окситоцина протікає аналогічно обміну вазопресина.
Біологічна дія. Гормон підвищує тонус гладкої мускулатури, особливо матки. Ці процеси пов'язані з впливом гормону на проникність мембран м'язових волокон для іонів К+, зниженням їх мембранного потенціалу і збільшенням збудливості. Під час вагітності активність гормону послаблюється в результаті ферментативного його розщеплення. В передпологовий період і під час пологів активність ацетилхолінестерази пригнічується, зростає збудливість м'язів матки і їх скоротність. Після пологів чутливість м'язів матки до гормону різко падає. Крім того, гормон стимулює активність міоепітелія молочної залози і біосинтез пролактина. Окситоцин інактивується прогестероном.
Патологія. Причинами зниженої інкреції гормону є травми, пухлини, загибель клітин задньої частини гіпофіза при деяких інфекційних, інвазивних і незаразних хворобах.
Застосування. Препарат гормону застосовують при гіпотонії мускулатури матки, слабих потугах під час пологів, затримці посліду, ендометритах та ін.
Гормони епіфіза
Епіфіз – це невелика залоза внутрішньої секреції, вона розміщена між мозочком і півкулями головного мозку. Основу епіфіза складають пінеальні і гліальні клітини. Тут синтезується декілька гормонів: мелатонін, 8-аргінінвазотоцин, гонадотропін-гальмуючі субстанції та деякі інші.
Мелатонін. Мелатонін відноситься до найбільш вивчених гормонів епіфіза. Відкритий у 1917 р. як речовина, що впливає на пігментацію шкіри.
Хімічна природа. Мелатонін – О-метилпохідне індола.
Біосинтез. Місцем утворення гормону є пінеальні клітини. Він синтезується з триптофана через ряд проміжних продуктів:
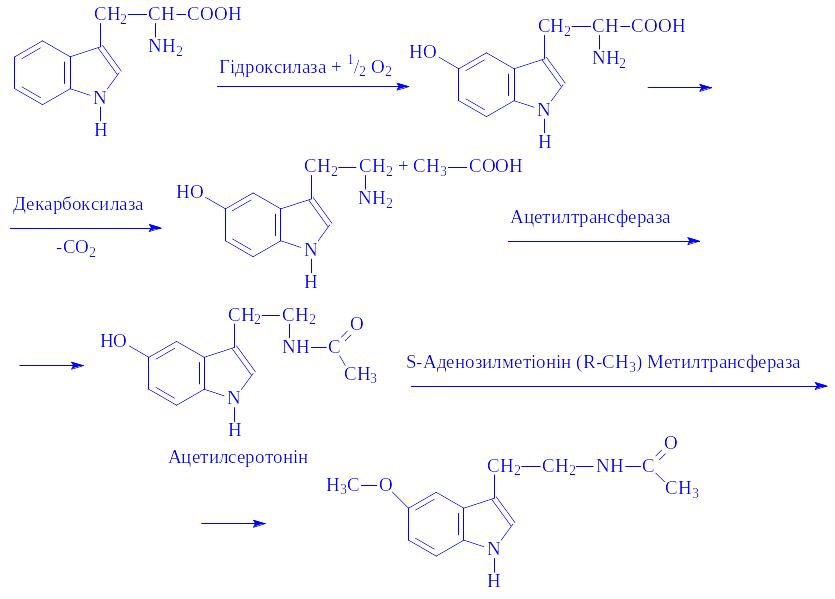
Метаболізм. Синтезований гормон поступає в кровоносну систему і розноситься по всьому організму. Після припинення біологічної дії відповідними ферментами інактивується. Продукти розпаду виділяються з сечею (у вигляді тваринного індикана та ін.), потом, калом, видихуваним повітрям.
Біологічна дія. На відміну від меланотропіна впливаючи на меланофори гормон висвітлює шкіру. Він знижує статеву збудливість, гальмуючи відповідні гіпоталамічні центри, гальмує дію соматотропіна, тиротропіна і АКТГ.
Патологія. Гіперфункція епіфіза гальмує прояв статевих ознак. Руйнування епіфіза викликає передчасне статеве дозрівання.
Застосування. Гормон застосовується при лікуванні порушень статевого апарату.
Гормони щитовидної залози
Щитовидна залоза – найважливіший орган внутрішньої секреції. У різних тварин її розміри досягають 6 – 7 см, маса – 15 – 42 г. Швидкість кровотоку в щитовидній залозі в 100 разів більша, ніж у тазових кінцівках, у 46 разів більша, ніж у м'язах, і в 5,5 раз більша, ніж у нирках. Гормони синтезуються у фолікулах, порожнина яких заповнена колоїдом.
Тироксин. Е. Кендалл у 1915 р. виділив з гідролізата щитовидної залози речовину, що оберігає від розвитку зобу, і назвав його тироксином (3,5,3',5'-тетрайодтиронин). Ч. Харінгтон у 1926 р. встановив його структуру і здійснив синтез. Була також визначена структура аналогів тироксина.
Хімічна природа. Йодовані похідні амінокислоти тирозина.
Гормони існують в трьох формах: тиреоглобулін (основна форма), тироксин (циркулює в біологічних рідинах) і 3, 5, 3'-трийодтиронін (знаходиться в комплексі з білками плазми):
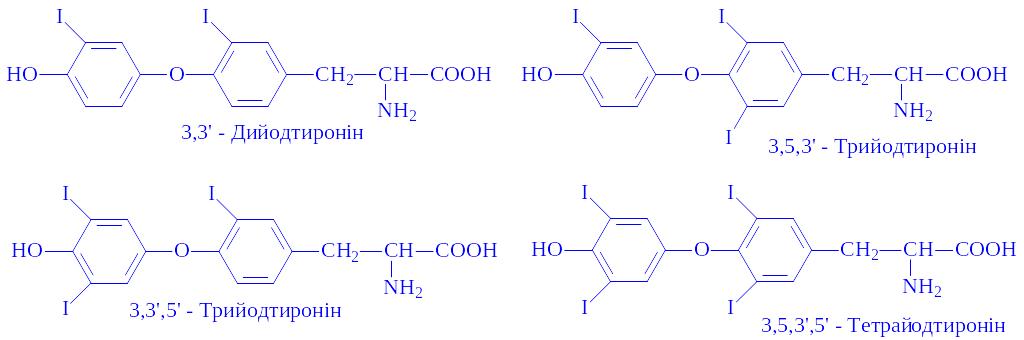
Тиреоглобулін – це глікопротеїд, містить вуглеводний компонент – гіалуронову кислоту. Молекулярна маса білка досягає 700 тис. Білок зв'язаний з тироксином і 3, 5, 3'-трийодтироніном. Йод складає 65% молекулярної маси тироксина. Зв'язаний тироксин знаходиться в стані динамічної рівноваги з вільним.
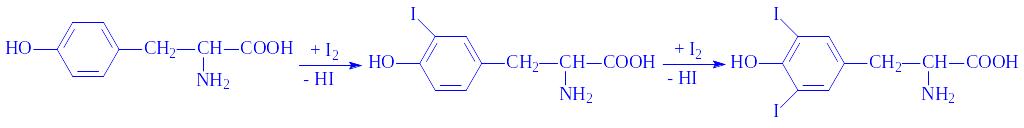
Біосинтез. Синтез гормонів регулюється гіпоталамічним фактором тироліберином і гормоном гіпофіза тиротропіном за принципом зворотного негативного зв'язку, оскільки підвищення в крові концентрації тироксина гальмує біосинтез цих гормонів, а зменшення – стимулює. На інтенсивність біосинтезу гормонів впливає наявність у поживних речовинах і воді достатньої кількості йоду, навколишня температура, загальний стан організму, пора року та ін. Білкова і вуглеводна частини тиреоглобуліну утворюються в рибосомальній фракції епітелію фолікул. Потім відбувається йодування амінокислотних залишків тирозина (іноді і фенілаланіна). Джерелом йоду служать йодиди. Йодування відбувається в декілька стадій (для простоти викладу узята амінокислота аланін):
Молекула тироксина утворюється в результаті окислювальної конденсації двох молекул 3,5-дийодтирозина:
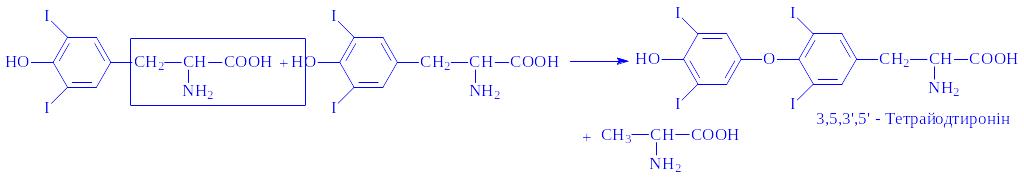
Йодування відбувається в ендоплазматичній сітці епітелію фолікул.
Метаболізм. Гормони поступають в кров у результаті дії на тиреоглобулін протеолітичних ферментів. Цей процес контролюється тиротропіном. У крові йодвмісні гормони зв'язуються з білками плазми і у такому вигляді циркулюють в організмі. В крові міститься тироксина в 7 разів більше, ніж 3,5,3'-трийодтироніна. При контакті з клітинами-мішенями білки плазми, з якими зв'язані гормони, розщеплюються, і гормони виділяються в міжклітинну рідину. В клітинах основна маса гормонів сконцентрована в гіалоплазмі, менше їх в мітохондріях і рибосомах. Під час міграції гормонів у клітини відбувається їх дезамінування і декарбоксилування з утворенням йодованих тиреооцтової і тиреопіровиноградної кислот, які і здійснюють біологічну дію. Частина гормонів інактивується відщепленням йоду, розривом біциклів і утворенням ефірів з глюкуроновою кислотою. Інактивація гормонів відбувається, головним чином, у тканинах печінки. Ефіри тироксина виділяються з калом і сечею. Частина йоду знов залучається до синтезу щитовидною залозою, надлишок йоду виділяється з сечею, жовчю, іноді з потом, слиною і повітрям.
Біологічна дія. Гормони надзвичайно сильно впливають на загальний обмін речовин в організмі, посилюють реакції біологічного окислення, активують обмін нуклеїнових кислот, білків, ліпідів, вуглеводів, мінеральних сполук, прискорюють процеси росту і розвитку організму. Гормони посилюють моторику шлунку, утворення і всмоктування летких жирних кислот. Тироксин сприяє відновленню дисульфідних груп тіолових ферментів у сульфгідрильні. Під його впливом зростає активність гексокінази, СДГ, катепсинів, ферментів, які беруть участь в окислювальному фосфорилуванні, що забезпечує адаптацію організму до низьких температур шляхом роз'єднання реакцій клітинного дихання і окислювального фосфорилування. При цьому зменшується утворення АТФ і вивільняється більше тепла. Припускають, що в цих випадках тироксин зв'язує катіони фосфорилування.
Патологія. В клініці зустрічаються симптоми гіпо- і гіпертиреоза. Гіпофункція щитовидної залози або її атрофія у молодих організмах призводить до розвитку кретинізму (карликового росту) і порушення пропорцій тіла. У дорослих виникає мікседема. При цьому розвивається набряк шкіри, відбувається затримка води в тканинах, зменшується основний обмін, наступає загальна млявість, патологічне ожиріння і передчасне старіння. Якщо гіпофункція розвивається при недостачі йоду в їжі і воді, то розвивається ендемічний зоб: щитовидна залоза збільшується в розмірах, у молодих тварин затримується ріст і розвиток, у дорослих – різко падає рівень основного обміну, порушується статевий цикл, зменшується продуктивність, змінюється екстер'єр, погано розвиваються вторинні статеві ознаки, спостерігаються самовільні аборти.
Гіперфункція виявляється у вигляді базедової хвороби – дифузного токсичного зобу. Причини можуть бути різні: хронічні інтоксикації, інфекційні захворювання, сильні перегріви та ін. Під впливом гормонів збільшується проникність мембран клітин, особливо мітохондрій. Частина субстратів циклу Кребса виходить в гіалоплазму, де відбувається посилене утворення тепла і гальмується синтез АТФ. При цьому наступає швидка стомлюваність, погіршується апетит, знижується рівень продуктивності, з'являється понос, витрішкуватість та ін. Порушуються всі види обміну речовин. Розвиваються явища токсикозу.
Застосування. Для профілактики і лікування ендемічного зобу в раціон вводиться йодована кухонна сіль (25 г KJ на 1 т солі). Для лікування зобу застосовують препарат щитовидної залози боєнського походження – тиреоїдин. При гіпертиреозі застосовуються антагоністи гормонів:
В деяких випадках для лікування гіперфункціональних порушень застосовують 131J.
Кальцитонін (тиреокальцитонін). Гормон був відкритий в 1963 р. в тканинах щитовидної залози, володіє здатністю знижувати вміст кальцію в крові. Походження гормону (з щитовидної залози) відображено в другій його назві – тиреокальцитонін.
Хімічна природа. Кальцитонін відноситься до поліпептидів, складається з 32 залишків амінокислот:
NН2-Цис-Сер-Асп-(NН2)-Лей-Сер-Тре-Цис-Вал-Лей-Сер-Ала-Тир-Тир-Арг-
-Асп(NH2)-Лей-Асп(NH2)-Асп(NН2)-Фен-Гіс-Арг-Фен-Сер-Глі-Мет-Глі-
-Фен-Глі-Про-Глу-Тре-Про-СОNН2.
Біосинтез. У риб, амфібій, рептилій і птахів гормон синтезується не в щитовидній залозі, а в клітинах ультимобранхіальних тілець, які розвиваються з останніх бранхіальних дуг; у ссавців – в С-клітинах інтерфолікулярних острівців щитовидної залози рибосомальним шляхом.
Метаболізм. Синтезований гормон поступає в кровоносне русло, вступає в контакт з a-глобулінами і з током крові доставляється в кісткову тканину. Може проникати в ліквор. Після прояву біологічної дії інактивується ферментами.
Біологічна дія. Гормон сприяє переходу кальцію з крові в кісткову тканину, підтримує постійний рівень у крові не тільки кальцію, але і фосфору, активує діяльність лужної фосфатази, посилює виділення фосфатів з сечею. Є антагоністом паратгормона.
Патологія. При пухлинах і інших захворюваннях, пов'язаних з атрофією щитовидної залози, синтез гормону уповільнюється і припиняється. Розвиваються патологічні явища, пов'язані з порушенням його функцій.
Застосування. Гормональний препарат застосовується при лікуванні захворювань кісткової системи і зубів (пародонтоза).
Гормон паращитовидної залози
Паращитовидні залози – невеликі епітеліальні утворення, розташовані у вигляді однієї – двох пар на поверхні щитовидної залози. Виробляють гормон, який є одним з основних регуляторів обміну кальцію і фосфору в організмі – паратгормон (паратирин).
Паратгормон. Хімічна природа. Паратгормон є поліпептидом, складається з 75 – 80 амінокислотних залишків з молекулярною масою в середньому 8500, добре розчиняється у воді, ізоелектрична точка рівна 4,8 – 6.
Біосинтез. Гормон синтезується в головних клітинах паращитовидної залози з амінокислот. Головні клітини функціонують циклічно. В неактивному стані вони мають великі розміри, багаті глікогеном, містять мало гранул гормону. В активному стані клітини зменшуються в розмірах, у них збільшуються розміри комплексу Гольджі, зникають запаси глікогену, зростає число гранул гормону.
Метаболізм. Синтезований гормон поступає в кровоносне русло, розноситься по всьому організму де і проявляє свою біологічну дію на реакції обміну речовин. Після цього інактивується пептидгідролазами.
Біологічна дія. Паратгормон підвищує вміст кальцію і знижує вміст фосфору в крові, забезпечує всмоктування кальцію в кишках, впливає на концентрацію кальцію в позаклітинній рідині, на згортання крові, процес збудливості кліток, проникність клітинних мембран, м'язову, нервову і судинну системи. Між паратгормоном і вітаміном D існує зв'язок, оскільки із збільшенням вмісту вітаміну в їжі підвищується всмоктування кальцію і фосфору, а також відновлюється рівновага вмісту їх іонів в організмі. Паратгормон є антагоністом кальцитоніна по відношенню до кальцію і синергістом по відношенню до фосфору.
Патологія. Зустрічаються два види порушень діяльності гормону, пов'язані з гіпер- і гіпофункцією залози: гіпер- і гіпопаратиреоз. У першому випадку відбувається демінералізація кісткової тканини і виникають спонтанні переломи, гальмується діяльність ізоцитратдегідрогенази, в кістках підвищується вміст лимонної кислоти, інактивується лужна фосфатаза, зростає утворення цитрата кальцію, який легко дифундує в кров. Спостерігаються фосфатна гіперкальциурія, атонія харчового каналу, запори. При гіпофункції залози зменшується вміст кальцію в крові і збільшується вміст фосфору. З'являються тетанічні судоми, гіпокальциурія, блювота, спазми харчового каналу, затримка розвитку зубів у молодих організмів.
Застосування. При гіпопаратиреозі застосовується паратгормон, який одержують з екстракту паращитовидних залоз великої рогатої худоби. При гіперпаратиреозі вводиться кальцитонін, який гальмує виділення кальцію з кісткової тканини.
Гормон навколовушної залози
Навколовушна залоза – найбільша або друга після підшлункової залози по величині залоза. У жуйних секретує безперервно. Навколовушна залоза виробляє гормон паротин.
Хімічна природа. Паротин – це поліпептид, складається з 16 – 17 амінокислотних залишків.
Біосинтез. Гормон синтезується в клітинах залози з амінокислот.
Метаболізм. Синтезований гормон поступає в кровоносну систему і з током крові розноситься по всьому організму. Після прояву біологічної дії інактивується пептидгідролазами.
Біологічна дія. Паротин стимулює біосинтез білків у хрящовій тканині, бере участь у біосинтезі дентину, осеїну й інших білків опорних тканин. Гормон разом з кальцитоніном і паратгормоном бере участь у регуляції кальцієвого і фосфорного обміну. Механізм дії гормонів в цих процесах не вивчений.
Патологія. При гіпофункції залози дегенерують еластичні волокна.
Застосування. Не застосовується.
Гормон вилочкової залози
Вилочкова залоза (тимус) – лімфоепітеліальний орган. Розвивається в ранньому віці, у дорослих тварин редукується. Залоза складається з кіркової і мозкової речовини. В мозковій речовині в шаруватих епітеліальних утвореннях (тільцях Гассаля) синтезується гормон тимозин.
Хімічна природа. Тимозин за хімічною природою є поліпептидом з молекулярною масою 7000.
Біосинтез. Гормон синтезується з амінокислот. Біосинтез протікає рибосомальним шляхом.
Метаболізм. Синтезований гормон поступає в кровоносну систему і з током крові розноситься по всьому організму. Після прояву біологічної дії інактивується ферментами.
Біологічна дія. Тимозин стимулює утворення лімфоцитів, активує утворення антитіл, особливо у тимектомованих тварин, бере участь у біосинтезі ДНК і РНК, підвищує імунологічну реактивність організму, гальмує виділення тиротропіна і тироксина, затримує статеве дозрівання, збільшує число циркулюючих у крові і тканинах лімфоцитів.
Патологія. Гормональна діяльність залози порушується при травмах і пухлинах, інфекціях і хронічних інтоксикаціях. Виникає стомлюваність, слабкість, падає продуктивність та ін.
Застосування. Не застосовується.
Гормони підшлункової залози
Підшлункова залоза виконує секреторні і інкреторні функції. Її гормонами є: інсулін, глюкагон, ліпокаїн і ваготонін. Гормони виробляються в основному в клітинах острівців Лангерганса, які складають близько 1% всієї маси залози. Їх число у людини досягає 200 000 – 1 500 000.
Інсулін. Відкриття інсуліну пов'язано із з'ясуванням причин цукрового діабету. Гормон відкрив Л.В. Соболєв у 1902 р. Ф. Бантінг і Ч. Бест у 1921 р. виділили його в чистому вигляді. Пізніше була встановлена структура інсуліну і був здійснений його синтез.
Хімічна природа. Молекула інсуліну складається з мономерів, які можуть між собою асоціювати, утворюючи частинки з молекулярною масою 12000 – 48000. Кожний мономер складається з двох ланцюгів, сполучених між собою дисульфідними зв'язками. Ланцюг А з N-кінця закінчується амінокислотою гліцином і містить 21 амінокислоту. Ланцюг В з N-кінцевою амінокислотою фенілаланіном складається з 30 амінокислот.
Інсуліни різних тварин відрізняються між собою залишками амінокислот в положеннях 8, 9 і 10 А-ланцюга.
Мономери інсуліну з'єднуються між собою в ди-, тетра-, гекса- і октомери атомом цинку через імідазольні залишки гістидина. В молекулі інсуліну в середньому міститься 0,3 – 0,6% Zn. Препарат інсуліну (його одержують із залози великої рогатої худоби) – це безбарвна речовина з температурою плавлення 233°С, добре розчиняється у воді.
Біосинтез. Інсулін синтезується в b-клітинах острівців Лангерганса з амінокислот. Спочатку утворюється проінсулін, що складається з 73 або 84 залишків амінокислот. Потім під впливом нейрогуморальних факторів у двох ділянках ланцюга молекули проінсуліна відбувається розрив і відокремлюється сполучаючий пептид. У результаті цього утворюється молекула інсуліну. Пептид містить 22 або 33 залишки амінокислот. Утворенню інсуліну з проінсуліна сприяє підвищення концентрації глюкози в крові.
Метаболізм. Гормон з b-клітин через синусоїдальні капіляри поступає в кровоносне русло. Тут він взаємодіє з a- і b-глобулінами і у вигляді комплексів з ними прямує до органів і тканин. Гормон діє нетривалий час, до 3 – 4 год. Потім інсулін інактивується ферментами, особливо, інсуліназою, яка міститься в багатьох органах. При однократному проходженні крові через печінку інактивується близько половини інсуліну, що міститься в ній.
Біологічна дія. Гормон впливає на вуглеводний, ліпідний, білковий і нуклеїновий обмін через ферментні системи. Основна функція інсуліну полягає в регуляції обміну вуглеводів. При недостатній кількості гормону виникає гіперглікемія і глюкозурія, що пов'язано зі зменшенням проникності клітинних мембран до глюкози, гальмуванням глюкокінази і глікогенсинтетази. Порушується діяльність пентозного циклу, а це негативно відображається на біосинтезі жирних кислот, оскільки немає належної кількості НАД∙Н2. Наявність потрібної концентрації інсуліну забезпечує переважання синтезу білків і ліпідів над їх розпадом, відкладення в тканинах глікогену. Інсулін бере участь у біосинтезі клітинних мембран і стимулює з’єднання іРНК з рибосомами. Підвищення проникності мембран пов'язано із здатністю дисульфідних груп гормону взаємодіяти з сульфгідрильними групами мембран. Інсулін стимулює процеси клітинного дихання і його поєднання з фосфорилуванням.
Патологія. При недостатній кількості або відсутності в організмі інсуліну виникає цукровий діабет. Причиною хвороби можуть бути інфекція, токсикоз, панкреатит, пухлини гіпофіза та ін. Наступає загальна слабкість, схуднення, гіперглікемія, глюкозурія, поліурія (добова кількість сечі зростає в 3 – 5 разів), виникає діабетична катаракта, помутніння і виразка рогівки, кома і загибель.
Застосування. Препарати інсуліну (природні і синтетичні) застосовуються при лікуванні цукрового діабету, гепатитів, панкреатиту, отруєнь (наприклад, свинцем) та ін.
Глюкагон (гіперглікемічний чинник, ГГФ). Глюкагон був виділений з підшлункової залози як домішка до інсуліну.
Хімічна природа. Глюкагон – це поліпептид, що складається з 29 залишків 16 амінокислот, молекулярна маса – 3470, погано розчиняється у воді, ізоелектрична точка знаходиться в області рН = 7,5 – 8,5. Глюкагон має таку первинну структуру:
Гіс-Сер-Глу(NH2)-Глі-Тре-Фен-Тре-Сер-Асп-Тир-Сер-Ліз-Тир-Ілей-Асп-Сер-Арг-
-Арг-Ала-Глу(NH2)-Асп-Фен-Вал-Глу(NH2)-Тир-Лей-Мет-Асп(NH2)-Тре
Біосинтез. Гормон синтезується з амінокислот в a-клітинах острівців Лангерганса.
Метаболізм. Синтезований гормон поступає в кровоносну систему і розноситься по всьому організму, впливаючи на обмін речовин.
Біологічна дія. Гормон активує фосфорилазу печінки, ліпази тканин, разом з інсуліном утворює єдину систему регуляції вмісту глюкози в організмі. В цьому процесі бере участь функціональний аналог гормону – адреналін.
Патологія. Зустрічаються гіпо- і гіперпродукція глюкагона. Гіпопродукція викликається інфекційними і токсичними пошкодженнями a-клітин.
Застосування. Глюкагон застосовується при лікуванні хвороб, що викликають дегенерацію a-клітин. Препарат глюкагона володіє високою активністю – доза 0,7 мкг/кг живої маси збільшує вміст цукру крові на 50%. При підвищеній продукції глюкагона для його інактивації застосовують препарати бутаміда і надизана.
Ліпокаїн. Гормон був відкритий як речовина, яка запобігає ожирінню печінки. Одержують після екстракції з тканини підшлункової залози інсуліну.
Хімічна природа. За хімічною структурою ліпокаїн є поліпептидом. За фізичними властивостями гормон є аморфним порошком, жовтого кольору, розчинний у воді, з характерним запахом.
Біосинтез. Гормон синтезується з амінокислот у клітинах епітелію дрібних вивідних проток підшлункової залози.
Метаболізм. Гормон поступає в кровоносне русло, потім до органів і тканин. Виявляє біологічну дію, після чого інактивується ферментами. Продукти розпаду гормону використовуються тканинами, деякі (сечовина, вуглекислий газ, вода) видаляються з організму.
Біологічна дія. Ліпокаїн стимулює окислення жирів, жирних кислот і вихід їх з печінки в тканини, запобігає і усуває жирову інфільтрацію печінки, сприяє біосинтезу фосфатидів за наявності в раціоні ліпотропних факторів (холіна, метіоніна, казеїна).
Патологія. Секреція гормону порушується при панкреатиті, різних інфекційних хворобах, інтоксикаціях, пухлинах.
Застосування. Препарати гормону застосовуються при лікуванні цукрового діабету, гепатитів, жирової дистрофії печінки і цирозу, атеросклерозу, ліпоїдозів, гіперхолестеринемій та ін.
Ваготонін. Цей гормон підшлункової залози, отриманий з її екстракту, вивчений ще недостатньо. Передбачається, що гормон має білкову природу. Стимулює діяльність парасимпатичної нервової системи і, перш за все, блукаючого нерва – вагуса. Впливаючи на цей нерв, ваготонін затримує розпад глікогену до глюкози, чим і викликає зменшення вмісту цукру в крові. Стимулює процеси кровотворення. В молекулі ваготоніна міститься до 8% карнітина.
Чоловічі статеві гормони
Чоловічі статеві гормони – андрогени синтезуються в основному в сім’яниках, деяка частина – в яєчниках і корі наднирників. Найбільша кількість гормонів міститься в спермі. Сперма на 90 – 98% складається з води решта суха речовина. Більшу частину сухої речовини складають білки.
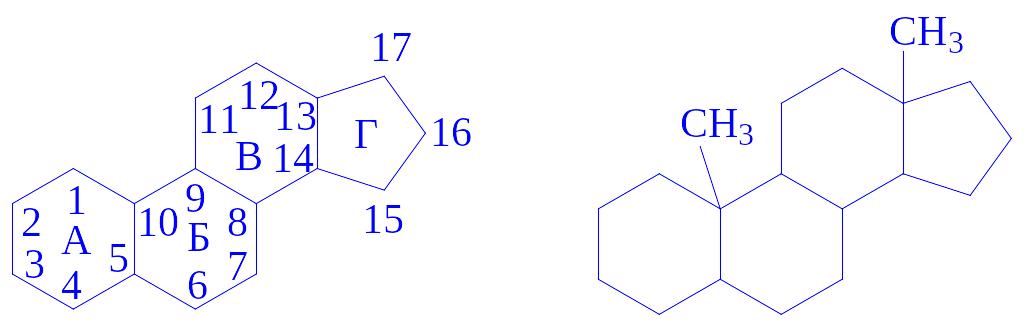
Хімічна природа. Перший андроген був отриманий Я. Бутенандтом у 1932 р. і названий андростероном. Всі андрогени є похідними циклічного вуглеводня – циклопентанпергідрофе-нантрена, зокрема, його метильованого гомолога – андростана:
Найбільший інтерес представляють андростерон, дегідроандростерон, тестостерон та їх синтетичний аналог – метилтестостерон:
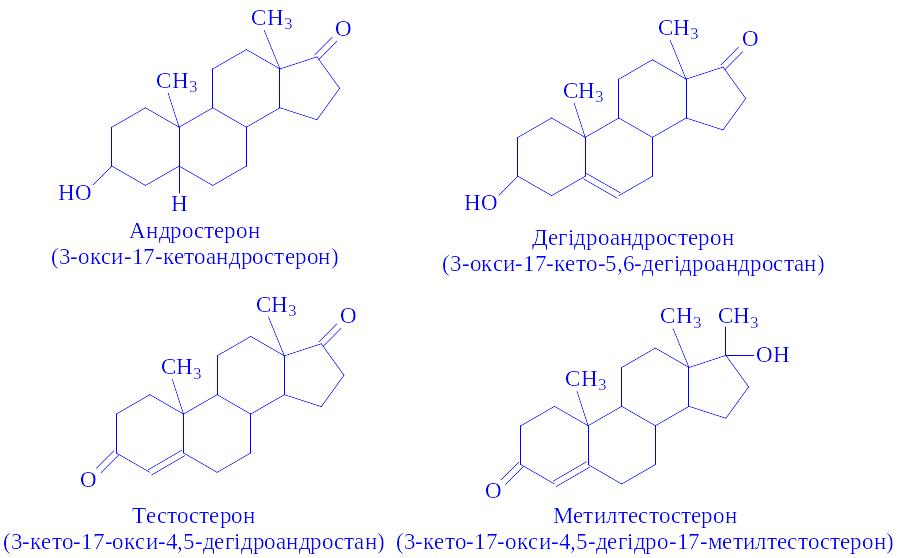
Андрогени не розчиняються у воді, розчиняються в етанолі, петролейному ефірі і ацетоні, можуть кристалізуватися, мають високу температуру плавлення, оптично активні. Метилтестостерон – кристалічний порошок, добре розчиняється у воді, гірше – в етанолі.
Біосинтез. Гормони синтезуються в основному в інтерстиціальних клітинах Лейтіга. Початковими речовинами для синтезу служать холестерин і ацетил-КоА. Центральне місце в синтезі займає прегненолон, з якого двома метаболічними шляхами (D4- і D5-шлях) під впливом ряду ферментів утворюється тестостерон (схема 2).
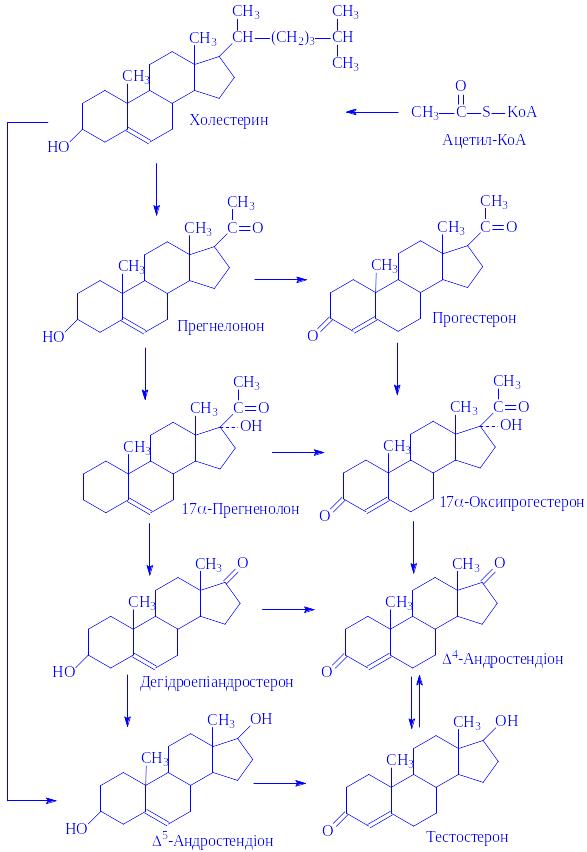
Схема 2. Синтез тестостерона
Біосинтез тестостерона й інших гормонів регулюється гормонами передньої частини гіпофіза – фолітропіном і лютропіном.
Метаболізм. Гормони поступають у кровоносне русло, розносяться по організму і де і впливають на обмін речовин. Період біологічного напівжиття молекули тестостерона складає 20 хв. Гормони зазнають ряд перетворень і у вигляді кінцевих продуктів обміну виділяються з організму. Деяка кількість гормонів виділяється з сечею без змін.
Біологічне значення. З діяльністю гормонів пов'язаний розвиток і прояв вторинних статевих ознак і стійкого статевого потягу. Виділення андрогенних гормонів протікає безперервно. Стероїдні гормони порівняно вільно проникають через клітинні мембрани і зв'язуються в клітинах-мішенях із специфічними білковими рецепторами. Гормон-рецепторний комплекс, що утворився, проникає в каріоплазму, де і впливає через ферментні системи на матричний синтез ДНК і РНК, а потім – на клітинний синтез білка. Андрогени проявляють анаболічний ефект на різні види обміну. Вони стимулюють біосинтез білка в м'язовій тканині, сприяють накопиченню в організмі азоту, фосфору, калія, натрію, хлора. Тестостерон у два рази активніший за дегідроандростерон, в шість разів активніший андростерона.
Патологія. Виділення гормонів порушується при багатьох захворюваннях – орхітах, епідимітах, травмах, пухлинах сім’яників, інфекціях, інтоксикаціях. Окрім гіпогонадотизму (недостатньої продукції гормонів) зустрічається гіпергонадотизм (надмірна продукція гормонів).
Застосування. Андрогени і метилтестостерон застосовуються при статевій недостатності, імпотенції, недорозвиненості сім’яників, статевому і нервовому виснаженні.
Жіночі статеві гормони
Жіночі статеві гормони синтезуються в яєчниках, плаценті і частково в наднирниках. Відрізняються між собою за хімічною будовою, властивостями і значенням.
Хімічна природа. Жіночі статеві гормони можна розділити на п'ять груп: естрогени, гестагени, релаксин, андрогени і гормони плаценти.
Естрогени і гестагени є похідними циклопентанпергідрофенантрена. Естроген в основі молекули містить ядро естрана. Вперше виділені з сечі вагітних у 1927 р., потім отримані в чистому виді естрон, естрадіол і естріол.
Молекула естрогену в ядрі А містить три подвійні зв'язки:
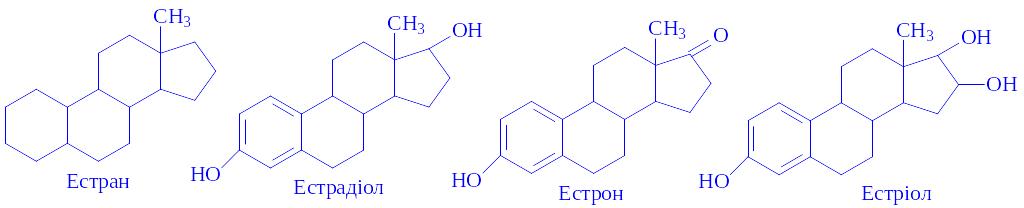
Естрон часто називають фолікуліном. Естрогени – кристалічні речовини з високою температурою плавлення, оптично активні, не розчиняються у воді, розчиняються в етанолі і маслах.
Гестагени – це гормони жовтого тіла і продукти їх обміну. Є похідними прегнана:
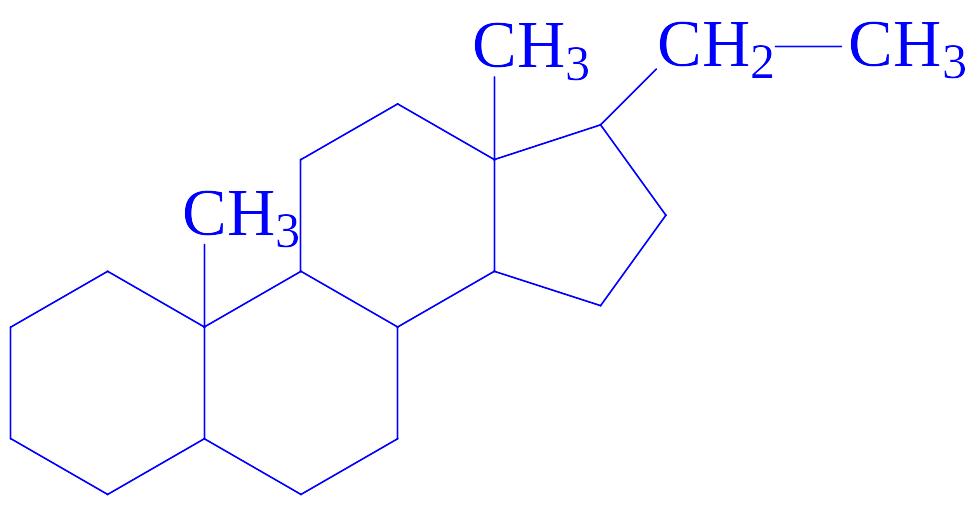
Прегнан вперше був отриманий Я. Бутенандтом у 1934 р. з яєчників свині. Потім виділені 20 a- і 20 b-оксипрогестерони. Прегнан і його похідні, в основному, кристалічні речовини з високою температурою плавлення, оптично активні, розчиняються в етанолі і діетиловому ефірі, не розчиняються у воді.
Релаксин належить до поліпептидів. Релаксин, виділений з яєчника свині, має основні властивості, його молекулярна маса – 6500. Молекула складається з двох субодиниць, сполучених між собою дисульфідним містком.
Андрогени, що синтезуються в тканинах яєчника, не мають істотного значення в статевій діяльності самки. Їх структура була розглянута вище.
Хоріонічний гонадотропін (хоріонгонадотропін) – це гормон плаценти, глікопротеїд, молекулярна маса – близько 100000, містить до 18% вуглеводів, 8,4% азоту, термостабільний, активується амілазою слини.
Біосинтез. Біосинтез жіночих статевих гормонів протікає циклічно. Естроген в яєчнику утворюється в клітинах внутрішньої теки фолікулів, зірчастих клітинах жовтих тіл і інтерстиціальних клітинах. Після овуляції (розриву фолікула і виходу яйцеклітини) гранульозні клітини проростають в кров'яний згусток і поступово трансформуються в лютеїнові клітини, утворюючи жовте тіло, яке продукує гестагени. За відсутності вагітності жовте тіло розсмоктується. Ці процеси регулюються нейрогуморально. Так, на початку циклу гіпофіз виділяє фолітропін. Під його впливом розвиваються фолікули яєчника, в яких під впливом лютропіна гіпофіза синтезується естроген. Вони стимулюють ріст фолікулів і їх чутливість до гонадотропінів. Коли інкреція естрогену досягає максимуму, відбувається викид великої кількості лютропіна з гіпофіза (за принципом позитивного зворотного зв'язку). Під впливом високих концентрацій лютропіна і функціональних змін, викликаних естрогеном, відбувається овуляція. Розвивається жовте тіло, клітини якого синтезують прогестерон.
В організмі естроген утворюється за схемою 3.
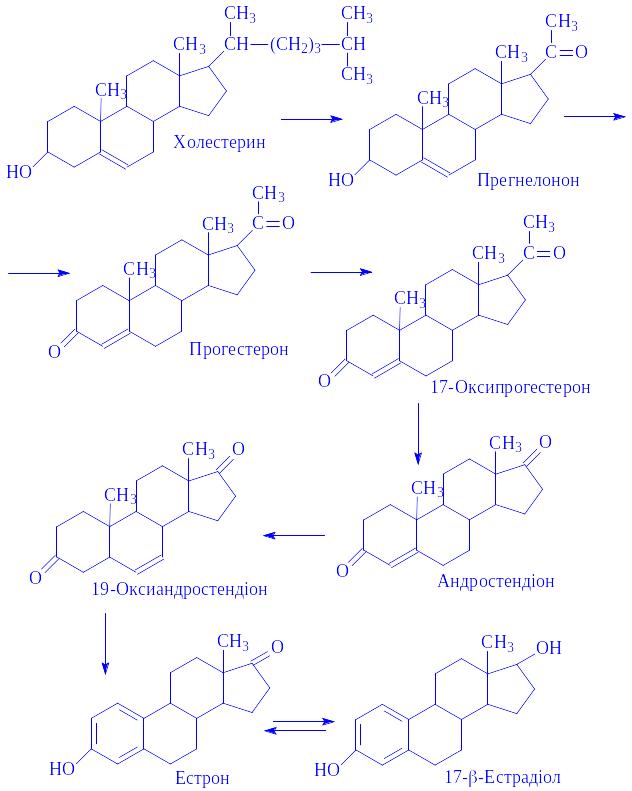
Схема 3. Утворення естрадіолу
У біосинтезі естрогену і гестагенів, андрогенів і кортикостероїдів наднирників виявляється ряд загальних продуктів. Під час вагітності в жіночому організмі розвивається ще один найважливіший орган, де продукуються гормони, – плацента. Утворення всіх п'яти груп гормонів каталізується одними і тими ж ферментними системами, хоча існують деякі відмінності, пов'язані із специфікою того або іншого гормону і органу. Біосинтез релаксину і хоріонгонадотропіна протікає типово для білка.
Метаболізм. Гормони, що утворилися, поступають у кровоносну систему і у вигляді біокомплексів з b-глобулінами транспортуються до органів і тканин. Після здійснення біологічної дії інактивуються, в основному, в печінці і нирках. Спочатку частина естрогену перетворюється на зв'язані форми – глюкуроніди та ефіри з сірчаною кислотою. Основна маса естрогену інактивується гідроксилюванням, метоксилюванням і окисленням з утворенням мало- і неактивного похідного естрогену. Частина гормонів виділяється з сечею в незмінному вигляді. Основним продуктом обміну прогестерону є прегнандіол, який виділяється у вигляді глюкуронідів. У перші дні вагітності у жінок з сечею виділяється до 10 мг прегнандіола, в останні дні – до 100 мг на добу.
Біологічна дія. Гормони забезпечують репродуктивні функції. Між дією естрогену і гестагенів існує взаємозв'язок і спадкоємність. Естрогени забезпечують розвиток і прояв у самок вторинних статевих ознак (тічку, статевий потяг), оптимальні умови для запліднення яйцеклітини після овуляції, підготовку матки для імплантації заплідненої яйцеклітини. Після настання вагітності на місці колишнього фолікула розвивається істинне жовте тіло, яке продукує гестагени. Під впливом гестагенів стимулюється розвиток маткових залоз і виділення ними секрету, які є поживною і захисною речовиною для яйцеклітини, що розвивається, до її імплантації.
Прогестерон готує слизову оболонку матки до прийняття заплідненої яйцеклітини і сприяє утворенню материнської частини плаценти. Прогестерон знижує скоротливу здатність м'язів матки і гальмує дію окситоцина. При вагітності гестагени гальмують овуляцію і сприяють розвитку молочної залози. Вони уповільнюють синтез лютропіна і тим самим не допускають овуляцію нових фолікулів. Прогестерон гальмує виділення фолітропіна, збільшує швидкість розпаду і синтезу білків, пуринових основ, вуглеводів.
Релаксин специфічно впливає на пізніх стадіях вагітності: під його впливом розм'якшуються епіфізи лонного зрощення і розслабляються лобкові зв'язки.
Хоріонгонадотропін сприяє нормальному протіканню вагітності: він впливає на розвиток і функціонування істинних жовтих тіл, регулює ендокринні функції плаценти.
Патологія. До патологічних порушень виділення гормонів відносяться різні захворювання: недорозвиненість яєчників, кісти яєчників, дисфункція гіпофіза і щитовидної залози та ін. Ці явища призводять до порушень реакцій обміну речовин, в яких беруть участь гормони. При близькоспорідненому заплідненні часто виникає інфантилізм – загальне недорозвинення організму або окремих органів.
Застосування. Гормони і їх синтетичні аналоги застосовуються як лікарські засоби при різних порушеннях жіночої статевої сфери. Особливе місце належить синестролу, який вживається для боротьби з безпліддям, при лікуванні ендометритів і для прискорення відділення посліду:
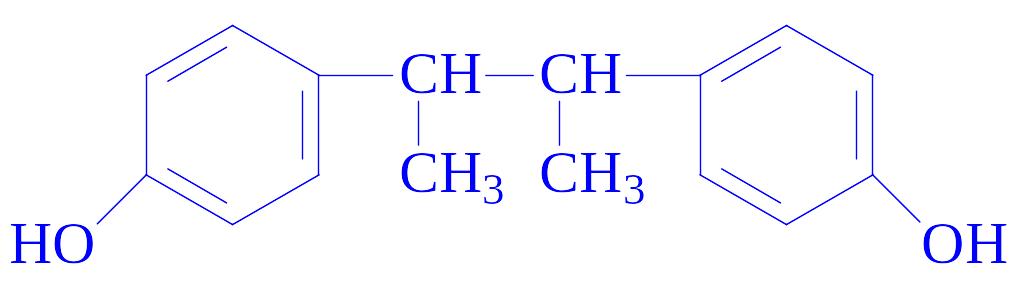
Високою естрогенною активністю володіє октестрол: він у 2,5 рази активніший за фолікулін, по активності він рівний синестролу.
Гормони кори наднирників
Наднирники – парні залози внутрішньої секреції. Кожний наднирник складається з кіркової і мозкової речовини. Кіркова речовина складає 60 – 70% загальної маси органу. Експериментальне видалення органу приводить до загибелі тварин.
Гормони кори наднирників почали вивчати після робіт Т. Аддісона (1855), який встановив, що причиною бронзової хвороби є дегенерація клітин кори наднирників. Е. Кендалл і співробітники, а також Т. Рейхштейн отримали з екстракту кори наднирників велику кількість стероїдів, які володіють гормональною активністю.
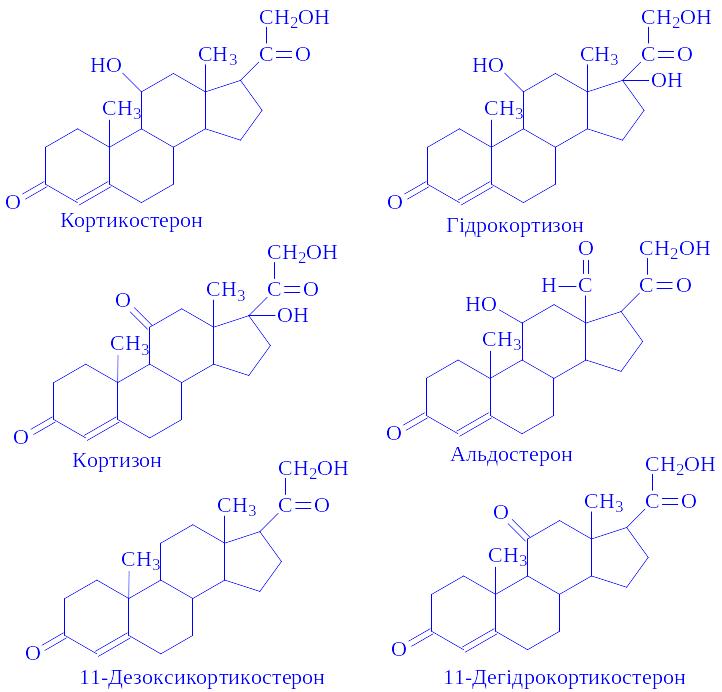
Хімічна природа. За фізіологічною дією гормони ділять на чотири групи:
глюкокортикоїди (кортикостерон, гідрокортикостерон, кортизон),
мінералокортикоїди (альдостерон, дезоксикортикостерон),
андрогени (андростендіон, дегідроепіандростерон, тестостерон та ін.),
естроген (естрон, еквіленин та ін.).
Перші дві групи називають власне кортикостероїдами. Всі ці гормони є похідними циклопентанпергідрофенантрена. Його ядро служить основою для утворення всіх чотирьох груп гормонів. Гідрокортизон і кортикостерон складають близько 80% всіх гормонів кори, альдостерон – 2, інші – 18%. Найбільш докладно вивчено шість гормонів:
Біосинтез. У клітинах клубочкової зони кори наднирників утворюється альдостерон, в пучковій зоні – гормони, які забезпечують регуляцію обміну багатьох органічних речовин і реакцію організму на стресові дії. Біосинтез кортикостероїдів регулюється гормоном гіпофіза АКТГ, який з током крові поступає в тканини наднирників. Тут з попередників (холестерину і ацетил-КоА) утворюються гормони.
Між ендокринними залозами, що беруть участь в утворенні і регуляції біосинтезу кортикостероїдів, існує прямий і зворотний зв'язок. Так, при появі в кровоносному руслі надлишку кортикостероїдів у гіпоталамусі зменшується синтез і виділення кортиколіберина, що призводить до зменшення швидкості біосинтезу АКТГ в гіпофізі і навпаки. Деякі попередники гормонів утворюються в стероїдопродукуючих органах, особливо, в статевих залозах і плаценті, потім поступають у кору наднирників.
Специфічність в утворенні гормонів залежить від виду тварин, від активності ферментів, що каталізують дані процеси. Так, розрив бічного ланцюга прегнана здійснюється карбоксилазою. Утворення гідроксильних груп каталізується специфічними гідроксилазами, які розрізняються залежно від місця розташування груп – ОН. Джерелом водню найчастіше є вітамін С, яким багата кора наднирників. Водень транспортується у вигляді НАДФ∙Н2.
Метаболізм. Синтезовані в корі наднирників гормони поступають у кровоносне русло. Близько 90% загальної кількості гормонів знаходиться у вигляді комплексних сполук з білками. Так, гідрокортизон і кортизон з'єднуються з a-глобулінами, альдостерон – з альбумінами крові. Це дає можливість клітинам поступово використовувати гормони і оберігає кортикостероїди від руйнування. Період біологічного напівжиття молекули гідрокортизону рівний 80 – 110 хв, кортикостерона – 60 – 90 і кортизону – 30 хв.
Основна маса кортикостероїдів виділяється з організму у вигляді їх метаболітів. Загальним для всіх стероїдних гормонів є переважання в їх обміні відновних реакцій. Відновлені метаболіти в печінці утворюють парні сполуки з глюкуроновою і сірчаною кислотами. Парні сполуки виділяються з організму з сечею і калом. Близько 1% гідрокортизону виділяється з сечею в незмінному вигляді. Кортикостерон виділяється з жовчю.
Біологічна дія. Під впливом глюкокортикоїдів збільшується розпад білків і гальмується їх синтез, зменшується маса тіла і зростає виділення з сечею сечовини, сечової кислоти й інших азотовмісних сполук, зростає вміст глікогену в м'язах, стимулюється глюконеогенез, підвищується рівень глюкози в крові і накопичення глікогену в печінці. При зменшенні виділення цих гормонів спостерігається зворотна дія. Інтенсивний синтез глюкокортикоїдів сприяє збільшенню в крові кількості лейкоцитів, особливо нейтрофілів, і зменшенню в ній числа еозинофілів і лімфоцитів.
Мінералокортикоїди впливають на водно-сольовий обмін. Вони затримують у тканинах іони Na+ і створюють передумови для утримування організмом води. При недостатній кількості цих гормонів зменшується вміст у тканинах іонів Na+ і хлорид-іонів, падає осмотичний тиск, настає зневоднення. Мінералокортикоїди, особливо альдостерон, володіють слабкою глюкокортикоїдною дією, впливаючи на обмін вуглеводів. Як і глюкокортикоїди, вони впливають на мінеральний обмін. Андрогени і естроген у корі наднирників синтезуються у невеликій кількості. Їх роль у виникненні і прояві статевих ознак невелика.
Патологія. При гіпофункції кори наднирників виникає гостра і хронічна недостатність всіх чотирьох груп гормонів. Причиною гострої недостатності можуть бути інфекційно-токсичні процеси, новоутворення, травми і інші ураження органу. При цьому слабшає серцева діяльність і порушується робота харчового каналу. Причиною хронічної недостатності може бути атрофія кори наднирників. При цьому падає кров'яний тиск, зменшується м'язовий тонус, виникає бронзове забарвлення шкіри і слизових оболонок (бронзова хвороба), наступає гіпоглікемія і гіпоазотемія, порушується водно-мінеральний обмін.
Іноді зустрічається гіперфункція кори наднирників. В її основі лежить посилення функціонування клітин якоїсь однієї зони. Так, при підвищеній функції клубочкової зони зростає виділення альдостерону і розвивається синдром альдостеронізма (гіпертонія, гіпернатрійемія, судоми, парез). Причиною цього можуть бути аденоми і карциноми кіркової речовини наднирників або різні інфекційні і токсичні процеси. При пухлинах пучкової зони кори починається надлишкове виділення глюкокортикоїдів, що призводить до виникнення наднирково-кіркового синдрому обмінного типу. При цьому поступово затухає синтез білків, зростає їх розпад і гальмується імунобіологічна реактивність організму.
Застосування. Гормони застосовуються відповідно до їх біологічної дії. Так, кортизон використовується при лікуванні ревматоїдного артриту, поліартритів, гострого суглобового ревматизму, вовчаку, спондіоартритів, бронхіальної астми і ін. Ацетат кортизону застосовується для лікування ревматизму, дерматитів, лейкозу; альдостерон (в 30 – 120 разів активніше дезоксикортикостерона) – при порушеннях мінерального обміну. Для цієї мети застосовуються деякі синтетичні аналоги – дексаметазон (у 30 разів активніший за гідрокортизон) і 9a-фторпреднізолон (у 50 разів активніший за гідрокортизон).
Гормони мозкової речовини наднирників
Мозкова речовина наднирників складає 30 – 40% його загальної маси. Продукує гормони адреналін і норадреналін. Вивчення гормонів почалося після дослідів Н. Цибульського і Л. Шимановича в 1895 р., які встановили, що екстракт мозкової речовини наднирників підвищує кров'яний тиск. У 1899 р. з екстракту мозкової речовини був виділений адреналін, а в 1947 р. – норадреналін.
Хімічна природа. Гормони є похідними діоксібензола (катехола або пірокатехіна). Їх називають катехоламінами:
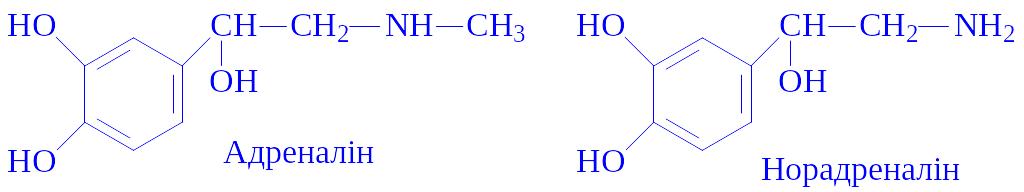
В органах і тканинах, особливо в наднирниках і симпатичній нервовій системі, міститься L-адреналін, який у 15 – 40 разів активніший за D-адреналін. Адреналін – кристалічна речовина білого кольору, гірка на смак, погано розчиняється у воді, оптично активна, нестійка, легко вступає в реакції окислення і заміщення.
Біосинтез. Основна маса обох гормонів синтезується в округлих або багатокутних клітинах мозкової речовини наднирників, частина – в симпатичних відділах нервової системи, оскільки ці гормони виконують функції медіаторів нервового збудження. Джерелом біосинтезу гормонів є амінокислота L-тирозин. В цих процесах бере участь ряд ферментів, АТФ, холін. Утворення гормонів протікає стадійно:
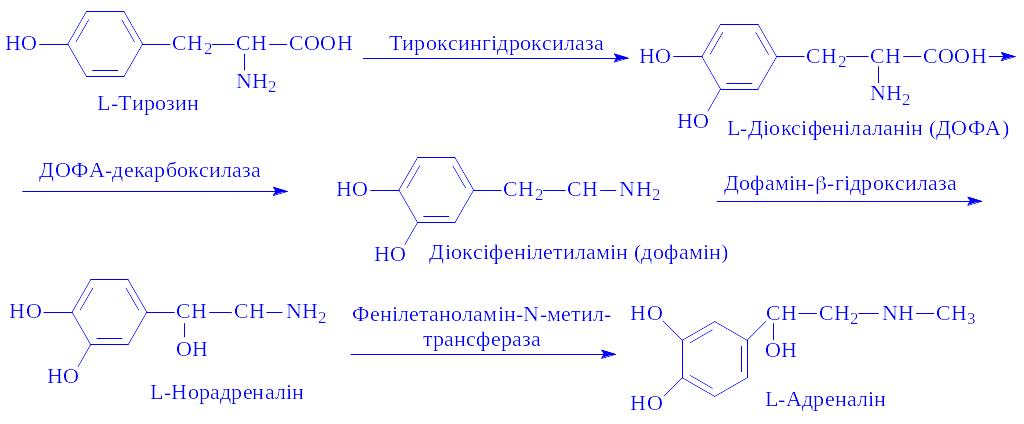
Остання реакція регулюється АКТГ і гормонами кори наднирників. У організмі адреналін і норадреналін знаходяться у вільному і зв'язаному стані.
Метаболізм. Синтезовані гормони поступають у кровоносну систему. Деякі гормони зв'язуються з білками крові, інші депонуються у вигляді солей з АТФ в симпатичних нервових закінченнях. Після виконання своїх функцій основна маса гормонів інактивується і виділяється з організму. Частина гормонів взаємодіє в печінці з сірчаною і оцтовою кислотами, утворюючи ефіри, які виділяються з сечею. Основна маса їх піддається складним перетворенням, у результаті яких утворюється меланін, або меланоїдний пігмент, який і видаляється з організму. Значна кількість гормонів інактивується метилюванням і дезамінуванням з утворенням продуктів, які у вигляді парних сполук з сірчаною і глюкуроновою кислотами виводяться з сечею з організму.
Біологічна дія. Гормони разом з простагландинами (див. нижче) впливають на обмін вуглеводів, білків, ліпідів і інших сполук (схема 4).
Молекула гормону з кровоносного русла поступає в міжклітинну рідину, а з неї – на поверхню клітини-мішені. Тут молекула адреналіну, як і інших гормонів, взаємодіє з рецепторами клітини, розміщеними на її поверхні. Рецептори взаємодіють з ферментом аденілатциклазою, яка знаходиться в неактивній формі. Під впливом ферменту з АТФ утворюється цАМФ. Він і є посередником між гормоном і відповідним ферментом. Якщо субстратом виявляється глікоген, через цАМФ гормон діє на молекулу неактивної фосфорилази, перетворюючи її на активну форму. Активна фосфорилаза і здійснює фосфороліз глікогену, перетворюючи його в глюкозо-1-фосфат.
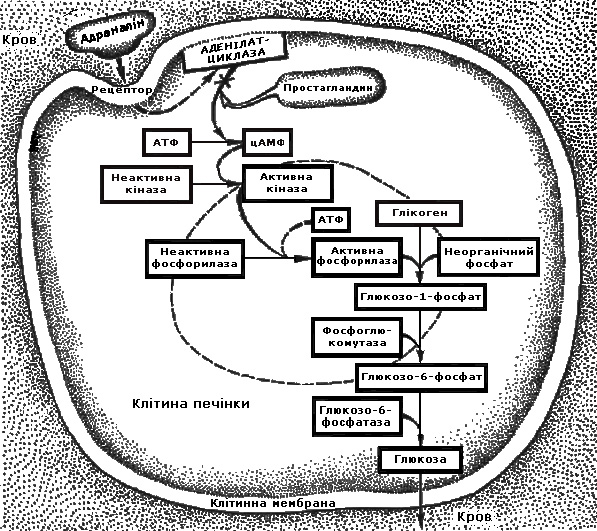
Схема 4. Механізм дії адреналіну на гепатоцит
Підвищене виділення гормонів або надмірне введення їх в організм викликає гіперглікемію і глюкозурію. Гормони збільшують швидкість розщеплення в тканинах білків і виділення азотних продуктів обміну з сечею, активують ліпазу жирових депо і прискорюють мобілізацію ліпідів. Дія адреналіну виявляється в дозах 0,0001 – 0,00001 мг на 1 кг живої маси. При цьому підвищується кров'яний тиск, частішає і посилюється серцебиття, швидшає ритм дихання, сповільнюється перистальтика кишок, збільшується температура тіла та ін. Адреналін підвищує тиск систоли, норадреналін – систоли і діастоли. Норадреналін не впливає на прискорення пульсу і не посилює споживання тканинами кисню. Фізіологічна дія гормонів пов'язана з їх взаємодією з адренорецепторами. a-Адренорецептори пов'язані із збудженням, а b-адренорецептори – з гальмуванням скорочень м'язових волокон гладеньких м'язів, частішанням і посиленням серцевих скорочень.
Патологія. Мозкова речовина наднирників вражається при багатьох інфекційних, незаразних і інвазивних хворобах, новоутвореннях, травмах і інших патологічних процесах. Атрофується хромафінна тканина, зменшується виділення гормонів, що призводить до гальмування всіх хімічних реакцій, в яких беруть участь катехоламіни. Іноді наступає гіперфункція мозкової речовини, коли вона вражається симпатикобластомою. Виникає надлишок гормонів і їх попередників, посилюються реакції обміну, в яких беруть участь адреналін і норадреналін. Виникає гіпертонія (з тахікардією), гіперглікемія, глюкозурія, розвивається атеросклероз, нефрит, порушується мозковий кровообіг, гальмується діяльність кори наднирників, може наступити смерть.
Застосування. Препарати гормонів застосовують при серцево-судинній недостатності, шоках, електротравмі, гіпоглікемічній комі, лікуванні бронхіальної астми. Застосування препаратів гормонів протипоказано при органічних ураженнях серця і високому кров'яному тиску.
Гормоноїди
Гормоноїди, або парагормони, – це різнорідні за хімічною будовою речовини, які проявляють сильну біологічну дію на багато фізіологічних процесів в організмі. На відміну від гормонів їх біосинтез не має суворої локалізації: вони утворюються в різних органах і тканинах. Гормоноїди володіють короткочасною біологічною дією. До них відносяться простагландини, гормоноїди харчового каналу і нейрогормони.
Простагландини. Простагландини вперше були знайдені в спермі людини. Ульф ван Ейлер у 1936 р. виділив ці речовини з витяжки передміхурової залози і назвав їх простагландинами. Зараз відомо понад 20 природних простагландинів.
Хімічна природа. Всі ці речовини за своїм агрегатним станом є рідинами або низькоплавкими кристалічними речовинами. За хімічною природою вони є ненасиченими жирними кислотами, що мають скелет з 20 вуглецевих атомів. Їх ділять на чотири основні групи: Е, А, В і F. Кожний з простагландинів в основі молекули має циклопентанове кільце, два бічні ланцюги, подвійний зв'язок між 13 і 14 вуглецевими атомами. Індивідуальні представники усередині кожної групи відрізняються між собою числом подвійних зв'язків в бічних ланцюгах. Ці зв'язки позначаються внизу букви цифровим індексом. Групи простагландинів мають таку будову:
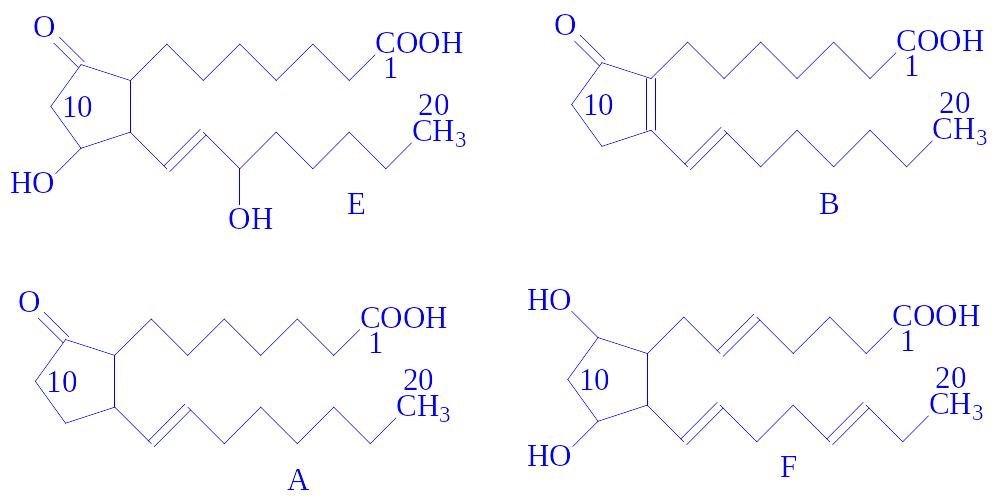
Найбільшою біологічною активністю володіють два простагландини: ПГ-E1 і ПГ-F3a.
Біосинтез. Простагландини утворюються в клітинах різних тканин. Їх попередниками є ненасичені жирні кислоти: лінолева, ліноленова, арахідонова та ін. При ендогенному походженні жирних кислот з фосфоліпідів під впливом фосфоліпаз вивільняються поліненасичені жирні кислоти, зазвичай з лінійним ланцюгом з 20 вуглецевих атомів. Надалі під впливом спеціалізованої ферментної системи в мікросомах відбувається окислювальна циклізація з утворенням молекули простагландина по типу:
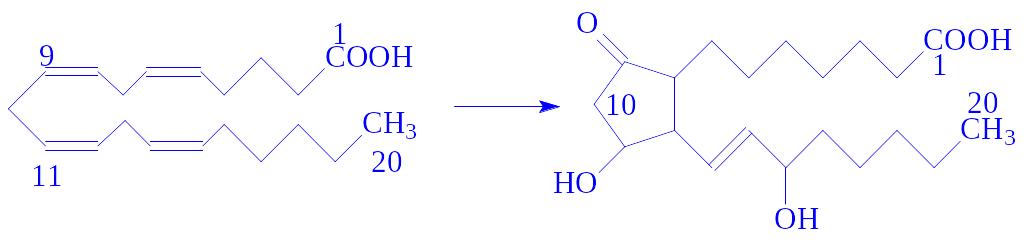
В організмі людини щодоби утворюється близько 100 мкг простагландинів. В окремих тканинах (наприклад, в тканинах передміхурової залози) їх вміст досягає 1 мкг на 1 г, в спермі міститься до 100 – 300 мкг на 1 мл.
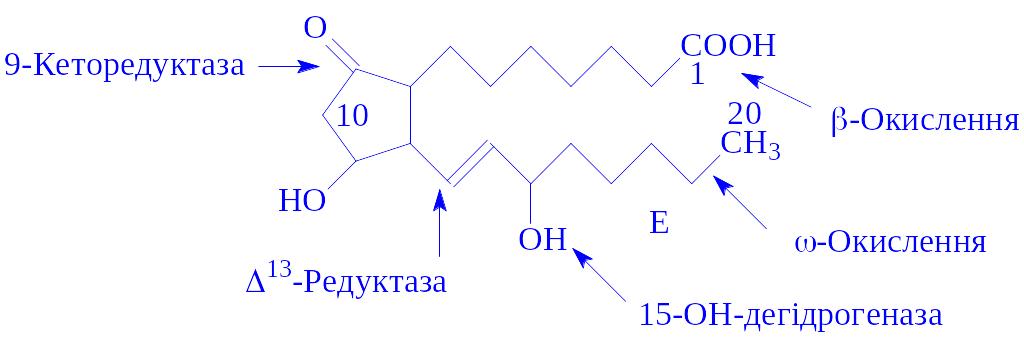
Метаболізм. Простагландини мають високий ступінь метаболізму. Найбільш інтенсивно вони розпадаються в тканинах легень, нирок і печінки. Так, після однократного проходження крові через легені і печінку інактивується відповідно 95% і 70% ПГ-Е2. Ці процеси включають окислення гідроксила у С15, відновлення D13-подвійного зв'язку, b-окислення, w-гідроксилування і w-окислення:
Біологічна дія. Простагландини за біологічною дією можна віднести до „місцевих”, або клітинних гормонів.
Перш за все вони впливають на активність аденілатциклази, яка регулює в клітинах вміст цАМФ – посередника між гормонами і ферментами. Так, у жировій тканині під впливом аденілатциклази посилюється ліполіз, у м'язовій – глікогеноліз, у кірковій речовині наднирників – стероїдогенез. У клітинах простагландини зазвичай знаходяться в зв'язаному стані. Їх дія активується адреналіном. Важливу роль в здійсненні дії простагландинів можуть також відігравати АТФ і іони Са2+:
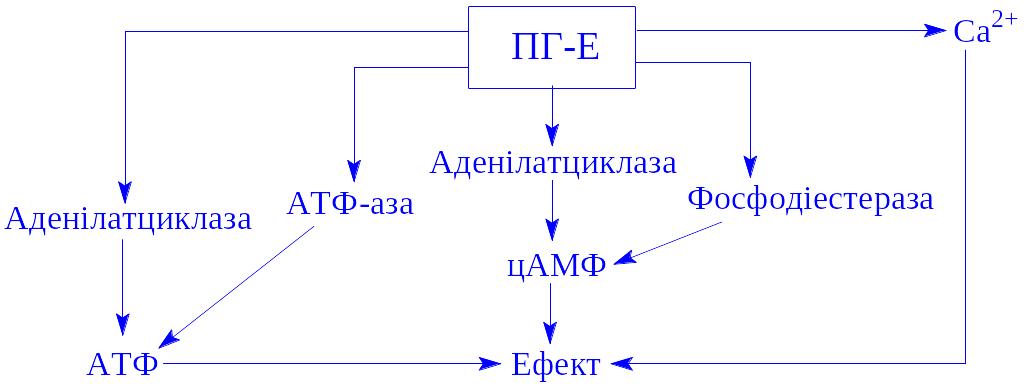
Патологія. Біосинтез гормоноїдів і їх обмін порушується при багатьох хворобах, особливо печінки, легень, нирок, центральної нервової системи, статевих залоз, а також при недостатній кількості і відсутності в раціоні ненасичених жирних кислот.
Застосування. Досвід застосування простагландинів на практиці свідчить про їх перспективне використовування для лікування бронхіальної астми, бронхітів, артритів, тромбозів, виразки шлунку та ін.
Гормоноїди харчового каналу. В слизовій оболонці харчового каналу синтезуються деякі біологічно активні речовини, які за своєю дією нагадують гормони.
Гастрин. Це речовина поліпептидної природи, що синтезується слизовою оболонкою привратника шлунку. Його молекула має таку будову:
Глі-Глі-Про-Три-Мет-Глу-Глу-Глу-Глу-Глу-Ала-Тир-Глі-Три-Мет-Асп-Фен-NH2.
Гастрин виділяється у відповідь на роздратування слизової оболонки при розтягуванні або дії речовин їжі. Сприяє виділенню шлункового соку, соку підшлункової залози, жовчі, підвищує тонус і моторику шлунку і кишок. Підвищення концентрації соляної кислоти у складі шлункового соку гальмує біосинтез гастрина.
Секретин. Цей гормоноїд виробляється клітинами слизової оболонки тонкої кишки під впливом соляної кислоти шлункового соку. За хімічною природою це поліпептид, молекула його була побудована з 27 амінокислотних залишків, причому 14 з них сполучені в такій послідовності, як і в молекулі глюкагона. Секретин був отриманий у чистому вигляді із слизової оболонки кишок. Спочатку він усмоктується слизовою оболонкою кишок, потрапляє в кровоносну систему, потім у підшлункову залозу, де і проявляє свою біологічну дію. Стимулює виділення підшлунковою залозою води і електролітів (в основному гідрокарбонатів).
Панкреозимін. Цей поліпептид синтезується слизовою оболонкою тонкої кишки. Структура його молекули вивчена недостатньо. Панкреозимін сприяє синтезу секреторною частиною підшлункової залози гідрокарбонатів і ферментів.
Холецистокінін. Речовина, що синтезується слизовою оболонкою тонкої кишки. Біосинтез холецистокініна стимулюється ліпідами, білками і мінеральними речовинами харчів. За хімічною природою гормоноїд є поліпептидом.
Структура молекули вивчена недостатньо. Викликає скорочення мускулатури жовчного міхура і виділення жовчі в дванадцятипалу кишку.
Нейрогормони. Нейрогормони синтезуються в нейросекреторних клітинах і утворюються в ендоплазматичному ретикулумі відповідних нейронів, упаковка в гранули відбувається в комплексі Гольджі. Потім вони поступають у нервові закінчення і міжклітинний простір. Якнайбільше нейрогормонів синтезується в клітинах ядер проміжного мозку. До них відносяться вазопресин і окситоцин, гормони гіпоталамуса, гістамін, серотонін, ацетилхолін, адреналін і норадреналін і деякі інші речовини.
Гістамін. Гістамін є похідним амінокислоти гістидина. Багато гістаміну синтезується тканинами шкіри, харчового каналу, легень. Гістамін виконує роль гуморального збудника шлункової секреції, підвищує тонус гладкої мускулатури, розширює капіляри. Знаходиться в зв'язаному стані з гепарином і іншими речовинами. Секреторна діяльність гормоноїда регулюється соматотропіном, адреналіном, норадреналіном, ацетилхоліном. Інактивується клітинними білками і гістаміназою. Вміст гістаміну в тканинах зростає при опіках, шокові та ін.
Серотонін. Біологічно активна речовина, міститься в різних тканинах тваринного організму. Утворюється з L-триптофана в центральній нервовій системі, клітинах слизової оболонки кишок і підшлункової залози. Володіє широким діапазоном дії на функції: нервової, серцево-судинної, м'язової, сечостатевої і ендокринної систем. Служить медіатором нервового імпульсу в нервових центрах (наприклад, в гіпоталамусі) і на периферії. В тканинах швидко руйнується під впливом ферменту моноамінооксидази, перетворюючись на 5-гідроксиіндолілоцтову кислоту, яка з сечею виводиться з організму. Серотонін впливає на скорочення гладкої мускулатури і передачу нервових імпульсів, бере участь у регуляції кров'яного тиску, температури тіла, дихання, сечовиділення, діяльності харчового каналу. Вважають, що порушення в організмі обміну серотоніна може бути однією з причин виникнення інфаркту міокарду, виразки, багатьох психічних захворювань.
Ацетилхолін. Ацетилхолін – один з найпоширеніших медіаторів нервового збудження. Синтезується в ендоплазматичній сітці багатьох нейронів центральної і периферичної нервової системи. Ним багаті нервові клітини парасимпатичних гангліїв. Виділяється закінченнями рухових і парасимпатичних нервових волокон у синаптичну щілину і викликає з боку органу який інервується відповідний ефект.
Біосинтез ацетілхоліну відбувається в результаті реакції між холіном і ацетил-КоА під впливом ферменту холін – ацетилтрансферази, іонів Mg2+, K+ і Са2+:
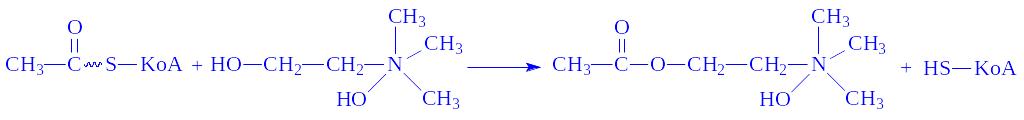
Інактивується АХЕ:
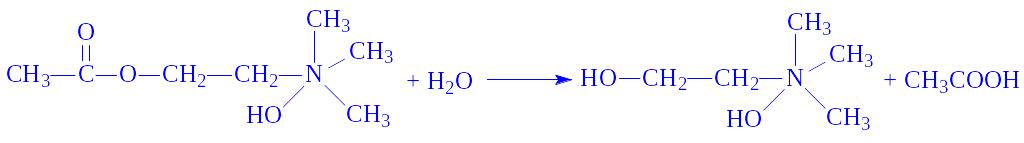
Деякі інші гормоноїди. Найбільший інтерес представляють ангіотензин і кініни.
Ангіотензин. За хімічною природою гормоноїд є поліпептидом, утворюється з b-глобулінів крові. При недостатній кількості в тканинах нирок кисню синтезується фермент ренін. Під впливом реніна і трипсину від молекули глобуліну відщеплюється декапептид – неактивний ангіотензин I. Коли він піддається дії ферменту ангіотензинази, то відщеплюється два амінокислотні залишки і утворюється ангіотензин II: Фен-Про-Гіс-Ілей-Тир-Вал-Арг-Асп. Гормоноїд є складовою частиною системи ренін-ангіотензин. Об'єктом дії ангіотензину є ниркові артеріоли. При гіперінкреції виникає ниркова гіпертонія.
Кініни. Ці поліпептиди беруть участь у регуляції швидкості кровотоку, зменшують кров'яний тиск, посилюють роботу серця і легень. Утворюються в тканинах і крові з кініногенів під впливом спеціалізованих ферментів. Найбільше значення мають два кініна:
брадикінін Арг-Про-Про-Глі-Фен-Сер-Про-Фен-Арг
і
каллідин – Арг-Про-Глі-Фен-Сер-Про-Фен-Арг-Три.
Лекція № 9. Обмін речовин.
Загальні уявлення про обмін речовин і енергії
Обмін речовин і енергії є однією з найважливіших і найсуттєвіших ознак живого організму. Живі організми – відкриті системи, для існування яких необхідний постійний двосторонній зв'язок (обмін) з навколишнім середовищем. З навколишнього середовища вони одержують поживні речовини та енергію, перетворюють їх, видозмінюють, використовуючи утворені сполуки для власних потреб, та повертають в навколишнє середовище кінцеві продукти обміну. Вся сукупність процесів поглинання, засвоєння речовин з навколишнього середовища та утворення і виділення кінцевих продуктів – суть обміну речовин.
Розглядаючи життя як вищу форму руху живої матерії, як спосіб існування біополімерних тіл та систем, здатних до самооновлення і самовідтворення в умовах постійного взаємозв'язку з навколишнім середовищем, незаперечним є те, що обмін речовин є основою всіх проявів життєдіяльності. Припинення обміну речовин рівнозначне припиненню життя. Обмін речовин відбувається і в неживій природі, однак цей процес значно відрізняється від обміну в живих системах. Ця відмінність зумовлена насамперед тим, що обмін речовин у живих організмах забезпечує постійне самооновлення та самовідтворення його складових частин і здійснюється завдяки злагодженій дії численних систем та специфічних факторів, що забезпечують процеси життєдіяльності. У неживій природі обмін відбувається в одному напрямі, що призводить до видозміни, а часто і руйнування неживих тіл. Оскільки обмін речовин між організмом та навколишнім середовищем зумовлює всі прояви життєдіяльності, його можна розглядати як своєрідну норму реагування організму на зміну умов середовища, тобто в процесі еволюції в живих організмах виникли і вдосконалились специфічні функції, що забезпечили виживання та їх розвиток. Отже, обмін речовин в живих організмах має багато суттєвих ознак. Насамперед для обміну речовин у живих організмах характерним є скоординованість біохімічних перетворень у просторі і часі, завдяки чому різні процеси, інколи прямо протилежні, здійснюються одночасно, не заважаючи один одному. Це значною мірою забезпечується за рахунок кампартменізації – окремі біохімічні перетворення відбуваються на певних ділянках клітин чи в специфічних органелах клітин. Досить важливим є і те, що перебіг процесів проходить у суворо визначеній послідовності, при цьому кожна попередня реакція створює умови для здійснення наступної. В цьому важлива роль належить біологічним каталізаторам – ферментам, які мають багато специфічних властивостей і забезпечують складні біохімічні перетворення численних субстратів та спряженість цих перетворень на метаболічному та енергетичному рівнях. Це створює умови для забезпечення саморегуляції та підтримання гомеостазу – необхідної умови існування живих організмів.
Умовно обмін речовин поділяють на загальний, проміжний та внутрішньоклітинний. Загальний обмін включає процеси надходження поживних речовин в організм, їх перетворення і виділення продуктів обміну. Проміжний обмін – це перетворення речовин в організмі з моменту надходження їх до утворення кінцевих продуктів обміну. Внутрішньоклітинний обмін – це перетворення речовин після всмоктування. Оскільки, за винятком процесів перетравлювання і всмоктування, а також утворення деяких міжклітинних рідин і мінеральних речовин у кістковій тканині, всі інші процеси відбуваються в клітинах організму, то поняття проміжного і внутрішньоклітинного обміну майже співпадають. Загальний обмін складається з проміжного і внутрішньоклітинного. Специфічними функціями обміну речовин є вбирання (акумуляція) енергії з навколишнього середовища, яка потрапляє у формі хімічних сполук або у вигляді енергії сонячного випромінювання і перетворення екзогенних сполук для синтезу біополімерів, властивих даному організму, та вилучення енергії. Енергія необхідна для процесів синтезу і виконання різних специфічних функцій, властивих живому, для росту, розвитку, руху, секреції, подразливості, скоротливості.
Обмін речовин складається з фізіологічних (травлення, всмоктування, виділення) і фізичних (сорбція, дифузія, осмос), хімічних (окислення, відновлення, гідроліз, фосфороліз) процесів, які здійснюються при проміжному та внутрішньоклітинному обміні. Особливе місце серед них належить хімічним перетворенням органічних сполук, різноманітність яких зводиться до двох основних реакцій – синтезу та розщеплення. Реакції синтезу відбуваються в напрямі ускладнення молекул, що призводить до перетворення простих сполук на складніші. Це так звані анаболічні реакції (від лат. anabole – синтез). Реакції розщеплення характеризуються протилежним процесом – розщепленням складних сполук з утворенням простіших. Це так звані катаболічні реакції (від лат. katabole – розклад), тобто обмін речовин можна розглядати як діалектичну єдність двох протилежних і взаємопов'язаних процесів – розщеплення і синтезу – асиміляції і дисиміляції.
Асиміляція – це частина загального обміну, що супроводжується поглинанням органічних сполук з навколишнього середовища, засвоєнням, перетворенням та синтезом за їх рахунок різних структур організму. Цей процес включає численні хімічні реакції та перетворення органічних сполук, які забезпечують використання організмом поживних речовин, що потрапляють з навколишнього середовища. За рахунок асиміляції забезпечуються процеси росту, розвитку, самооновлення організму. Асиміляція супроводжується анаболічними реакціями, які забезпечують синтез складних органічних сполук. Основними анаболічними реакціями є реакції відновлюючого синтезу, які супроводжуються використанням енергії, тобто є ендергонічними.
Дисиміляція – це частина загального обміну, в процесі якого відбувається руйнування та розщеплення складних органічних сполук, які потрапляють з продуктами харчування, та тих, що входять до складу власних структур організму – білків, вуглеводів, ліпідів з утворенням простіших сполук та кінцевих продуктів обміну. Органічні сполуки, що потрапляють з продуктами харчування, перетворюються за участю численних ферментів до простіших сполук. Певна послідовність ферментативних перетворень називається метаболізмом (від лат. metabole – перетворення). Речовини, що утворюються в процесі метаболізму, називаються метаболітами. Інколи поняття метаболізм ототожнюється з поняттям обміну, оскільки з хімічної точки зору метаболізм – це сукупність різноманітних ферментативних реакцій окислення, відновлення, гідролізу та ін.
Для дисиміляції характерні катаболічні реакції, які супроводжуються виділенням енергії, тобто є екзергонічними. Основними катаболічними реакціями, що здійснюються при дисиміляції, є гідроліз, фосфороліз та окислення. Гідроліз і фосфороліз складних органічних сполук до простіших здійнюються за участю певних ферментних систем. Реакції окислення характерні переважно для внутрішньоклітинного обміну і мають багато особливостей. В організмі процеси окислення відбуваються за рахунок таких процесів: приєднання атомів кисню до субстрату; відщеплення атомів водню з субстратів, що окислюються; віддачі електронів. Усі реакції каталізуються специфічними ферментними системами. Так, використання кисню в процесах окислення в організмі може забезпечуватись за рахунок кількох груп ферментів: оксидаз і оксигеназ, а відщеплення водню та електронів з субстрату, що окислюється, забезпечують ферменти дегідрогенази. Деякі реакції є спряженими – окислення однієї сполуки, як правило, супроводжується відновленням іншої (реакції оксидоредукції). Особливістю перебігу даних реакцій в живих організмах є те, що вони в більшості випадків складають ланцюги взаємопов'язаних послідовних перетворень, які забезпечують поетапне виділення енергії. Процеси асиміляції і дисиміляції в організмі відбуваються одночасно і є двома сторонами єдиного процесу обміну. Анаболічні реакції, що характерні для асиміляції, забезпечують утворення органічних сполук, необхідних для побудови структур організму, а катаболічні реакції, які характерні для дисиміляції,– виділення енергії, необхідної для синтезу складних органічних сполук та утворення кінцевих продуктів обміну.
Співвідношення між процесами асиміляції і дисиміляції є досить важливим показником функціонального стану організму. Найінтенсивніше процеси асиміляції проходять у період росту та розвитку організму. Переважання процесів дисиміляції над процесами асиміляції має місце при деяких патологічних процесах та при старінні організму. За нормальних фізіологічних умов в організмі забезпечується стабільна рівновага даних процесів. Разом з тим слід зазначити, що незважаючи на те, що процеси асиміляції і дисиміляції є взаємоузгодженими і відбуваються одночасно, анаболічні реакції, як правило, є не оборотними реакціями катаболізму, оскільки різні етапи їх каталізують різні ферментні системи та здійснюються в різних кампартментах клітини.
Так, процеси синтезу різних біополімерів клітини здійснюються в цитоплазмі, де локалізовані відповідні ферментні системи, а процеси розщеплення різних субстратів, спряжені із виділенням енергії, проходять у мітохондріях. Прикладом може бути розщеплення та синтез жирних кислот, вуглеводів, білків. Незважаючи на те що анаболічні і катаболічні реакції розмежовані в просторі і часі, їх об'єднують спільні стадії та проміжні продукти обміну (метаболіти). Динамічна єдність двох протилежних процесів – асиміляції та дисиміляції – є досить важливою ознакою обміну речовин у живих системах та необхідною умовою їх існування.
У процесі еволюції в живих організмах сформувались певні регуляторні механізми, які забезпечують високий ступінь упорядкованості та узгодженості процесів, що в них здійснюються. Дані регуляторні механізми діють на різних рівнях – клітинному, метаболічному, організменному – і є спільними для всіх живих організмів. Координація та взаємоузгодженість процесів асиміляції і дисиміляції, інтенсивність та направленість біохімічних перетворень переважно регулюються шляхом зміни активності ферментних систем та за участю інших регуляторних механізмів (нервових та гуморальних), що забезпечує динамічну рівновагу між організмом та навколишнім середовищем як важливу умову існування живих систем. Процеси асиміляції і дисиміляції можна проілюструвати схемою:
Енергетичний баланс організму. Макроергічні сполуки
Обмін речовин в організмі тісно пов’язаний з обміном енергії. Постійне надходження та використання енергії є необхідною умовою існування живих організмів як відкритих систем. За рахунок надходження енергії забезпечується підтримання стабільного, впорядкованого стану живої системи, що запобігає дезорганізації, хаосу та її загибелі. Енергія необхідна організму для забезпечення таких процесів: виконання різної роботи (механічної, осмотичної, фізичної); руху, скорочення та розслаблення м'язів; синтезу та розщеплення різних сполук; транспорту речовин та іонів; підтримання гомеостазу; виконання специфічних функцій, що забезпечують процеси життєдіяльності.
У процесі еволюції в живих організмах сформувались механізми, які забезпечують сприймання або вилучення енергії, генерацію, акумулювання її та використання організмом. Різні форми енергії, що існують у живих системах – хімічна, електрична, світлова, теплова, можуть взаємоперетворюватись одна в одну.
Залежно від способу вилучення енергії всі живі організми поділяють на фото- і хемотрофи. Фототрофи у вигляді джерела енергії використовують енергію квантів світла. До фототрофів належать зелені рослини, водорості, деякі бактерії. Дані організми синтезують складні органічні сполуки з неорганічних (CO2 і H2O) за рахунок енергії сонячного випромінювання, тобто вони здатні до сприймання і перетворення енергії електромагнітних коливань потоку сонячного випромінювання на енергію хімічних зв'язків органічних сполук. За типом живлення дані організми належать до аутотрофних (від грец. aytos – сам, trofos – живлення). Хемотрофні організми у вигляді джерела енергії використовують енергію окислення органічних чи неорганічних сполук. У першому випадку їх відносять до органотрофів, а в другому – до літотрофів. За типом живлення хемотрофні організми є гетеротрофами (від грец. heteros – інший і trofos – живлення). Гетеротрофи не можуть синтезувати складні органічні сполуки з неорганічних і використовувати їх в готовому вигляді. До гетеротрофів належать організми людини, тварин та деякі мікроорганізми. Слід зазначити, що поділ живих організмів на гетеро- та аутотрофи дещо умовний. Досить часто один і той самий організм може мати клітини обох типів. Так, у вищих рослин клітини листків – аутотрофи, а клітини коренів – гетеротрофи.
Для гетеротрофних організмів основним джерелом енергії, яка необхідна для забезпечення процесів життєдіяльності, є енергія хімічних зв'язків між атомами складних органічних сполук – білків, вуглеводів, ліпідів. Такі органічні сполуки гетеротрофні організми одержують з навколишнього середовища як компоненти їжі (поживні речовини). Поживні речовини гетеротрофними організмами використовуються у вигляді джерела енергії та джерела вуглецю. Енергія, яка акумульована в хімічних зв'язках органічних сполук, може бути виділена при розриві їх у результаті гідролізу, фосфоролізу. Так, при гідролітичному розщепленні пептидних зв’язків виділяється 2600 кДж/моль енергії, при розщепленні хімічних зв'язків у молекулі глюкози – відповідно 2881 кДж/моль, тобто кожна органічна сполука, що входить до складу живої матерії, має певний запас потенціальної енергії, акумульованої в хімічних зв'язках. Це так звана загальна внутрішня енергія системи, або енергія зв'язку. Загальна потенціальна енергія сполуки, яка при згоранні її перетворюється на теплоту, називається ентальпією і позначається буквою Н.
Під час перетворення зв'язків рівень загальної потенціальної енергії змінюється. При цьому енергія, що міститься в хімічних зв'язках, розсіюється у вигляді теплоти частково, тобто вивільнення енергії проходить не одномоментно, а поступово і частина її використовується для виконання роботи. В зв'язку з цим у клітині різких температурних змін не спостерігається. Зміна ентальпії (DН) при розриві хімічних зв'язків має такий вираз:
DН = DF + рDV
де DF – зміна загальної енергії системи; р – тиск; DV – зміна об'єму.
Оскільки в біологічних системах зміною об'єму можна знехтувати, то DH » DF.
Частина загальної енергії системи, за рахунок якої може бути виконана певна робота, називається вільною енергією G0. Отже, за рахунок вільної енергії підтримується стабільний стан біологічної системи. Зміна рівня стандартної вільної енергії позначається DG0. Під цим розуміють зміну вільної енергії за нормальних умов: тиск 101,3 кПа, концентрація 1 M і температура 25 °C. Зміну рівня стандартної вільної енергії при рН = 7,0 позначають DG0'. Зміна стандартної вільної енергії хімічної реакції визначається як різниця між вільною енергією вихідних сполук та вільною енергією кінцевих продуктів реакції, тобто зміна вільної енергії системи при переході її з одного стану в інший є критерієм, який дає змогу стверджувати можливість хімічного перетворення згідно з законами термодинаміки.
Зміну вільної енергії системи можна визначити як ту частину зміни загальної енергії, яка може бути використана для виконання роботи системою, що прагне до рівноваги за нормальних умов. Так, зміна вільної енергії в ході реакції А ® В дорівнює:
DG0’ = D H + TDS,
звідки DH = DG0' + TDS, де DG0' – зміна стандартної вільної енергії системи; DH – зміна загальної енергії системи; T – абсолютна температура; DS– зміна ентропії.
Ентропія – це частина загальної енергії системи, яка не використовується для виконання роботи і розсіюється у вигляді теплоти. При будь-якому перетворенні енергії значення ентропії збільшується. Виділення теплоти з точки зору термодинаміки слід розглядати як марну втрату енергії. З наведеного вище рівняння видно, що зміна загальної енергії системи (DH) складається з суми зміни стандартної вільної енергії DG0', яка використовується організмом, та зміни тієї частини загальної енергії, яка розсіюється у вигляді теплоти (TDS). Залежно від знака члена (плюс чи мінус) рівняння (TDS) вільна енергія може бути більшою чи меншою від теплоти реакції. DG0' може мати як додатне, так і від'ємне значення. Його використовують для кількісної характеристики хімічних реакцій, що дає змогу виразити енергетичний стан клітини. Так, у ході реакції A ® В від'ємне значення DG0' свідчить про те, що продукти реакцій містять менше вільної енергії, ніж вихідні сполуки (DG0'В < DG0'A), тобто реакція проходить з виділенням енергії і є екзергонічною. В цьому випадку рівновага реакції зміщується в бік утворення продуктів реакції (самовільні процеси). Якщо DG0' мaє додатне значення, тобто енергоємність продуктів реакції більша, ніж вихідних сполук (DG0'В > DG0'A), реакція без додаткового надходження енергії не відбувається. Дані реакції є ендергонічними і проходять з поглинанням енергії, що надходить ззовні (світлова, теплова, електрична), чи від інших екзергонічних реакцій окислення. Отже, перетворення енергії в організмі підкоряється законам термодинаміки: енергія не зникає і не виникає, а перетворюється з одного виду на інший без зміни загального рівня енергії, тобто організм виграшу в енергії не має. При будь-якому перетворенні енергії відбувається зростання ентропії системи і навколишнього середовища. Ця тенденція зберігається доти, поки не настане стан рівноваги, при якому ентропія має максимальне значення для даних умов. Процес проходить спонтанно за умов збільшення суми ентропії системи (DSc) і навколишнього середовища (DSH.C.)
DSc + DSH.C. > 0.
Зміна ентропії кількісно пов'язана із зміною загальної енергії системи, яку можна виразити як функцію DG0'. Обмін енергії включає такі процеси, як виділення, перетворення, акумулювання та використання енергії організмом, тобто обмін речовин в організмі супроводжується постійним обміном енергії завдяки тісному взаємозв'язку анаболічних реакцій, характерних для асиміляції, та катаболічних реакцій, характерних для дисиміляції. Слід зазначити, що для енергетичних процесів, які здійснюються в живих організмах, властиві певні особливості, наприклад вивільнення, акумулювання та використання енергії. Так, виділення енергії, що міститься в хімічних зв'язках органічних сполук, здійснюється в процесі дисиміляції на певних етапах проміжного обміну. При цьому процес вивільнення енергії здійснюється не одномоментно, а поступово і включає три основні етапи: підготовчий, анаеробне та аеробне окислення.
Підготовчий етап – перетравлювання та всмоктування поживних речовин. На цьому етапі відбувається ферментативне розщеплення високомолекулярних біополімерів (білків, вуглеводів, ліпідів) до мономерних сполук. Так, білки розщеплюються до амінокислот, вуглеводи – до моносахаридів, ліпіди – до гліцерину та жирних кислот. На даному етапі виділяється незначна кількість енергії – менш як 1 %, яка переважно розсіюється у вигляді теплоти. Катаболічними реакціями, що забезпечують виділення енергії на даному етапі, є гідроліз і фосфороліз.
Наступний етап виділення енергії включає анаеробне окислення продуктів гідролітичного розщеплення біополімерів (амінокислот, моносахаридів, жирних кислот) до метаболітів, таких як ацетил-КоА, a-кетоглутарова та щавелевооцтова кислоти. На даному етапі виділяється близько 1/3 енергії, акумульованої в хімічних зв'язках органічних сполук.
Утворені метаболіти включаються далі в наступний етап виділення енергії – аеробне окислення до кінцевих продуктів. При цьому виділяється 2/3 енергії. Аеробне окислення метаболітів здійснюється у циклі Кребса, в якому поєднуються анаболічні та катаболічні реакції, тобто в даному циклі проходить інтеграція анаболічних реакцій, характерних для асиміляції, та катаболічних реакцій, характерних для дисиміляції. Субстрати, що утворюються в циклі Кребса, можуть бути використані як при розщепленні, так і підчас синтезу різних речовин. Як правило, завершальна фаза катаболізму стикується з початковою фазою анаболізму, тобто кінцеві продукти розщеплення можуть бути використані як вихідні продукти синтезу.
У процесі аеробного окислення в циклі Кребса нагромаджуються відновні еквіваленти у вигляді НАД×H2, НАДФ×H2, ФАД×H2, які є генераторами енергії і забезпечують синтез АТФ у процесі тканинного дихання.
Анаболічні реакції, як і катаболічні, складаються з кількох стадій. Синтез складних органічних сполук починається з простих метаболітів, що утворюються в процесі розкладання. При цьому спочатку синтезуються прості сполуки (мономери), які далі перетворюються під час складних ферментативних реакцій на важливі біополімери клітини – білки, вуглеводи, ліпіди. Синтез складних органічних сполук відбувається з використанням енергії АТФ. Тісний взаємозв'язок між анаболічними і катаболічними реакціями здійснюється на кількох рівнях:
1) на рівні джерел вуглецю (кінцеві продукти катаболізму часто є вихідними сполуками анаболічних реакцій);
2) на рівні відновних еквівалентів (при аеробному окисленні нагромаджуються відновні еквіваленти, які використовуються для відновлюючого синтезу складних органічних сполук);
3) на енергетичному рівні (при катаболізмі виділяється та нагромаджується (акумулюється) енергія, яка може бути використана для процесів синтезу).
Анаболічні та катаболічні реакції спряжені за рахунок так званих амфіболічних (об'єднуючих) шляхів метаболізму, одним з яких є цикл Кребса. Треба зазначити, що анаболічні та катаболічні реакції на окремих етапах не співпадають і каталізуються різними ферментними системами. Отже, реакції синтезу не завжди є оборотними реакціями розщеплення. Так, розщеплення та синтез вуглеводів відрізняються трьома суворо специфічними реакціями, які каталізуються різними ферментами. При цьому процеси синтезу часто проходять обхідними шляхами, спряженими з меншими енерговитратами. Використання специфічних шляхів розщеплення і синтезу різних сполук у живих організмах є досить доцільним з багатьох точок зору. Насамперед це дає змогу здійснювати процеси розщеплення і синтезу одночасно і незалежно один від одного.
В організмі існує тісний взаємозв'язок між процесами звільнення та використання енергії. Основна маса енергії, акумульованої в хімічних зв'язках органічних сполук, виділяється при катаболізмі на другому і третьому етапах (анаеробне та аеробне окислення). Однак виділена енергія не використовується безпосередньо для потреб організму, а попередньо перетворюється на доступну форму. Такою універсальною сполукою є ATФ, яка може бути в ролі донора, акцептора та трансформатора енергії. Однак енергія окислення органічних сполук на АТФ не передається, оскільки в клітині безпосередня передача енергії від низько- до високоенергетичних сполук не відбувається. Цей процес здійснюється за участю посередників – макроергічних сполук, які утворюються під час окислення субстратів, і нагромаджують енергію окислення в макроергічних зв'язках.
Макроергічні зв'язки – це зв'язки, при перетворенні яких рівень зміни вільної енергії становить понад 20 кДж/моль. Макроергічні зв'язки позначають знаком тільда (~). Якщо при перетворенні зв'язків рівень зміни вільної енергії становить 12 – 20 кДж/моль, такі сполуки є нормальними в енергетичному відношенні. Таку розмірність зміни рівня стандартної вільної енергії мають більшість органічних сполук. Слід мати на увазі, що поняття „макроергічні зв'язки” не треба плутати з поняттям „енергія зв'язку”. Поняття „енергія зв'язку” включає характеристику енергетичного рівня хімічного зв'язку з точки зору фізичної хімії, тобто величини енергії, необхідної для розриву зв'язку між атомами. Поняття макроергічні зв'язки полягає у врахуванні енергетичного ефекту в результаті перетворення зв'язку через хімічну реакцію. Отже, в розумінні „енергія зв'язку” обидва види зв'язку близькі між собою. Основна відмінність між ними полягає в тому, що при перетворенні макроергічних зв'язків виділяється значно більше енергії, ніж при перетворенні звичайних зв'язків. Так, енергія хімічного зв'язку між двома кінцевими залишками фосфату в молекулі макроергічної сполуки (АТФ) і енергія зв'язку між залишком фосфорної кислоти і глюкози в молекулі глюкозо-6-фосфату приблизно однакові, тобто для розриву зв'язків в першому і другому випадках необхідно витратити однакову кількість енергії. Однак при дослідженні енергетичного ефекту гідролітичного розриву даних зв'язків є суттєва відмінність. Для АТФ зміна рівня стандартної вільної енергії становить 37 – 42 кДж/моль, а для глюкозо-6-фосфату – 13,1 кДж/моль, тобто АТФ є макроергічною сполукою, а глюкозо-6-фосфат – нормальною в енергетичному відношенні.
Макроергічні сполуки, як правило, містять фосфатну групу в a-положенні, яка при розриві макроергічного зв'язку може переноситись на інші сполуки у вигляді радикалу – активного фосфорилу: –PО3Н2.
Залежно від того, між якими атомами виникають макроергічні зв'язки, розрізняють п'ять груп макроергічних сполук: нуклеозидфосфати (АТФ, ГТФ, УТФ); карбоксилфосфати (ацетилфосфат); ацилтіолові ефіри (ацетил KoA); фосфоамідні ефіри (кретинфосфат); енолфосфати (фосфоенолпіровиноградна кислота). У цих сполуках макроергічні зв'язки найчастіше виникають між атомами фосфору і сірки, фосфору і кисню, фосфору і вуглецю, фосфору і водню.
Отже, енергія, що виділяється при окисленні органічних сполук, акумулюється в макроергічних зв'язках, з яких вона разом з активними фосфорними групами передається на АДФ, внаслідок чого синтезується ATФ.
У загальному цей процес можна записати так:
![]()
Макроергічні сполуки виконують роль посередників передачі енергії від низькоенергетичних сполук до АТФ. Постійний вміст АТФ у клітинах забезпечується фосфорилюванням АДФ як за рахунок енергії сонячного випромінювання (аутотрофні організми), так і за рахунок аеробного та анаеробного окислення біополімерів (гетеротрофні організми). Крім того синтез АТФ забезпечується за рахунок внутрішньоклітинних систем, що виконують резервну роль. Такою є система креатин-фосфат D креатин, яка може вступати в обмінну реакцію з нуклеозидфосфатами.
Біологічне окислення
Вивчення процесів окислення було започатковано M.В. Ломоносовим та А. Лавуазьє на основі дослідження продуктів згорання. А. Лавуазьє, співставляючи процеси горіння з процесами дихання в живих організмах, звернув увагу на подібність між ними.
При диханні, як і при згоранні, відбувається поглинання кисню і утворення CO2 і H2O. Енергетичний ефект окислення органічних сполук в організмі та згорання їх також виявились тотожними. Так, при окисленні глюкози до кінцевих продуктів і при згоранні її в колориметрі виділяється однакова кількість енергії 2881 кДж/моль. В зв’язку з цим А. Лавуазье висловив припущення, що сполуки в організмі окислюються в результаті їх повільного згорання. Не зрозумілим було ще те, чому „горіння” різних сполук в організмі відбувається при низькій температурі, без полум'я і за наявності води.
Перші спроби з'ясувати особливості та механізм окислення сполук в організмі (біологічного окислення) зробив Ф. Шенбайн, який висловив припущення, що біологічне окислення – це каталітичний процес, необхідною умовою перебігу якого є активація кисню.
На початку XX cт. O.H. Бах та K. Енглер одночасно і незалежно один від одного запропонували гіпотезу, згідно з якою біологічне окислення проходить за рахунок активування кисню і першим етапом даного процесу є утворення пероксидних сполук. Активування кисню здійснюється за рахунок енергії сполук, здатних до самоокислення, та ферментів оксидаз. Такими сполуками є каротини, терпени, полієнові вищі жирні кислоти, в молекулах яких є кратні подвійні зв'язки, внаслідок чого вони легко взаємодіють з молекулярним киснем, утворюючи пероксидні сполуки, які розщеплюються за участю ферментів пероксидаз і утворюють активний кисень. Останній окислює молекули інших органічних сполук, які з молекулярним киснем не реагують.
Оскільки окислення проходить через утворення пероксидних сполук, то теорія O.M. Баха дістала назву пероксидної теорії окислення.
Значний внесок у розуміння процесів біологічного окислення зробив російський біохімік В.І. Палладін. Вивчаючи окислення речовин у рослинах, він встановив, що воно може відбуватися і при відсутності кисню, якщо в реакційному середовищі є речовини, які здатні приєднувати водень. Такими речовинами виявились пігменти – хромогени. Приєднуючи водень від субстратів, які окислюються, вони відновлюються і стають безбарвними. Потім – віддають водень, тобто окислюються, знову набувають забарвлення, перетворюючись на хінони, причому, перетворення проходить за участю кисню повітря.
Слід зазначити, що В.І. Палладін надавав великого значення кисню як акцептора водню і цим самим показав важливу роль кисню в процесах біологічного окислення. Дослідження В.І. Палладіна були підтверджені працями Віланда. Він висловив думку, що дегідрування субстратів є основним процесом, який лежить в основі біологічного окислення, і що кисень взаємодіє вже з активованими атомами водню. Отже, була створена теорія окислення речовин шляхом їх дегідрування, яка дістала назву теорії Палладіна-Віланда.
Основою в підтвердженні даної теорії було відкриття і вивчення цілого ряду дегідрогеназ – ферментів, які каталізують відщеплення атомів водню від різних субстратів. Було доведено, що процеси окислення субстратів – це цілий ланцюг послідовних реакцій, які починаються з дегідрування субстратів і закінчуються перенесенням електронів на кисень та взаємодією останнього з протонами водню з утворенням води. Оскільки при такому окисленні постійно має місце поглинання кисню, то його ще називають тканинним диханням.
Отже, на основі вищенаведених теорій і досліджень створено сучасні уявлення про механізм біологічного окислення, в основі якого лежить пероксидна теорія Баха і теорія Палладіна-Віланда про дегідрування субстратів.
Суть біологічного окислення. Біологічне окислення, яке проходить в організмах людини і тварин, є досить складним процесом. У ньому беруть участь десятки і сотні різних ферментів, внаслідок чого потенціальна енергія, яка міститься в молекулах органічних речовин, вивільняється і використовується в найрізноманітніших процесах життєдіяльності організму.
Процес біологічного окислення проходить поетапно. У ньому беруть участь ферментні системи, які містять у вигляді: небілкової частини НАД+, НАДФ+; ФМН, ФАД, убіхінони і залізопорфіринові комплекси.
На першому етапі біологічного окислення здійснюється дегідрування субстратів – продуктів розщеплення білків, жирів і вуглеводів. Цей процес відбувається за участю ферментів дегідрогеназ (оксидоредуктаз), які містять коферменти НАД+ і НАДФ+. Вони є майже універсальними акцепторами водню для багатьох субстратів – спиртів, альдегідів, дикарбонових і кетокислот, амінів тощо. Віднімаючи від субстратів атоми водню (електрони і протони), вони самі відновлюються, а субстрати при цьому окислюються.
Прикладом дегідрогеназ може бути лактатдегідрогеназа, яка каталізує реакцію дегідрування молочної кислоти.
Далі, на наступному етапі, акцептором атомів водню є група флавінових ферментів, які у вигляді небілкової частини містять ФМН. Вони здійснюють перенесення атомів водню від відновлених НАД або НАДФ.
Наступним етапом є перенесення електронів і протонів від відновлених форм ФМН на убіхінони (коензим Q).
На наступному етапі з коензиму Q протони атомів водню переходять у навколишнє середовище, а електрони поступають на цитохромну систему. Цитохромна система складається з ряду оксидоредуктаз, небілковою частиною яких є залізопорфірини, близькі за своєю будовою до гему. Відомо понад 20 різних цитохромів. Вони позначаються латинськими буквами – а, в, с, d і т.д. В цитохромну систему входять цитохроми і фермент – цитохромоксидаза (аа3). Характерною особливістю цієї системи ферментів є те, що вони переносять електрони з відновленого коензиму Q на кисень, а останній, сполучаючись з іонізованими атомами водню, утворює воду.
Отже, на завершальному етапі дихання здійснюються два процеси – приєднання до кисню електронів і перетворення його на негативно заряджений іон (іонізація), а потім приєднання до іонізованого кисню протонів з утворенням молекули води. Молекулярний кисень O2 приєднує до себе 4 електрони і 4 протони, а оскільки через систему цитохромів переноситься лише 2 електрони, використовується ½ O2 (див. нижче).
У процесі перенесення електронів через систему дихального ланцюга проходить поступове вивільнення акумульованої в них енергії і до кисню вони переносяться вже енергетично бідними, тому утворення води в організмі не супроводжується вибухом, як у випадку утворення гримучого газу.
Отже, в ланцюгу окисно-відновних процесів створюється своєрідний електронний каскад. Послідовність розміщення основних компонентів дихального ланцюга визначається співвідношенням швидкості окислення і відновлення окремих компонентів системи, а також величиною редокс-потенціалів, що виникають між сусідніми компонентами. Перенесення електронів здійснюється завжди від меншого потенціалу до більшого. Для більшості органічних субстратів нормальні редокс-потенціали окисно-відновних систем дорівнюють – 0,6 В.
Окисно-відновна рівновага, окисно-відновний потенціал. Зміна вільної енергії, яка характеризує реакції окислення і відновлення, пропорційна здатності реактантів віддавати або приєднувати електрони. Відповідно, зміну вільної енергії окисно-відновного процесу можна характеризувати не тільки величиною DG, але і величиною окисно-відновного потенціалу системи (Е0). За звичай окисно-відновний потенціал системи (Е0) порівнюють з потенціалом водневого електрону, приймаючи останній за 0,00 В при рН = 0. Однак, для біологічних систем правильніше використовувати окисно-відновний потенціал при рН = 7 (Е0'); при такому рН потенціал водневого електрону дорівнює – 0,42 В. Окисно-відновні потенціали деяких систем, які представляють особливий інтерес для біохімії ссавців, наведені в таблиці 1. Використовуючи цю таблицю, можна передбачити, в якому напрямку піде потік електронів при спряженні однієї окисно-відновної системи з іншою.
Ферменти і коферменти, які приймають участь в окисно-відновних процесах. Ферменти, які каталізують окисно-відновні процеси, називаються оксидоредуктазами. Їх ділять на 5 груп.
Таблиця 1
Стандартні потенціали деяких окисно-відновних систем
Система |
Е’0, вольт |
Кисень / вода |
+ 0,82 |
Цитохром a: Fe3+ / Fe2+ |
+ 0,29 |
Цитохром с: Fe3+ / Fe2+ |
+ 0,22 |
Убіхінон: окислений / відновлений |
+ 0,10 |
Цитохром b: Fe3+ / Fe2- |
+ 0,08 |
Фумарат / сукцинат |
+ 0,03 |
Флавопротеїн («жовтий фермент»): окислений / відновлений |
– 0,12 |
Оксалоацетат / малат |
– 0,17 |
Піруват / лактат |
– 0,19 |
Ацетоацетат / b-гідроксибутират |
– 0,27 |
Ліпоат: окислений / відновлений |
– 0,29 |
НАД+ / НАДН |
– 0,32 |
Н+ / Н2 |
– 0,42 |
Сукцинат / a-кетоглутарат |
– 0,67 |
1) Оксидази. Істинні оксидази каталізують видалення водню із субстрату, використовують як акцептор тільки кисень. Вони обов’язково містять мідь, продуктом реакції є вода (виключення складають реакції, які каталізуються уриказою і монооксидазою, в результаті яких утворюється Н2О2 ):
Цитохромоксидаза – гемопротеїн, широко розповсюджений в рослинних і тваринних тканинах. Вона служить кінцевим компонентом ланцюга дихальних переносників, локалізованих в мітохондріях, і каталізує реакцію, в результаті якої електрони, вивільняються із молекул субстрату при їх окисленні дегідрогеназами, переносяться на кінцевий акцептор – кисень. Даний фермент отруюється оксидом вуглецю, ціанідом сірководнем. Інколи цитохромоксидазу називають цитохромом аа3. Спочатку припускали, що цитохром а і цитохром а3 – це автономні гемопротеїни, оскільки кожний з них характеризується визначеним спектром, крім того, вони виявляють різну чутливість до дії оксиду вуглецю і ціаніду. Однак було доведено, що вони входять до складу комплексу, який одержав назву цитохром аа3. Він містить дві молекули гема, у кожній з який атом заліза може переходити зі стану Fe2+ у стан Fe3+ і назад у ході окислення і відновлення, а також два атоми Сu, кожний з яких взаємодіє з одним з гемів.
Фенолаза (тирозиназа, поліфенолоксидаза, катехолоксидаза) – це мідьвмісний фермент із широкою специфічністю. Він каталізує перетворення монофенолу (у присутності о-дифенолу) у о-хінон. Мідь виявлена в ряді інших ферментів, зокрема в уриказі, яка каталізує окислення сечової кислоти в алантоїн, і в моноамінооксидазі, яка окислює адреналін і тирамін у мітохондріях.
2) Аеробні дегідрогенази – ферменти, які каталізують видалення водню із субстрату; на відміну від оксидаз вони як акцептор водню можуть використовувати не тільки кисень, а і штучні акцептори, такі, як метиленовий синій. Ці дегідрогенази відносяться до флавопротеїнів, і продуктом реакції, яку вони каталізують є пероксид водню, а не вода:
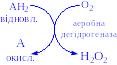 ,
,
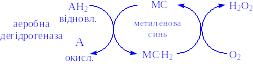
Аеробні дегідрогенази – флавопротеїни; містять простетичні групи – флавінмононуклеотид (ФМН) або флавінаденіндинуклеотид (ФАД).
До ферментів групи аеробних дегідрогеназ відноситься дегідрогеназа L-амінокислот (оксидаза L-амінокислот) ФМН-вмісний фермент, який знаходиться в нирках і володіє широкою специфічністю, каталізує окисне дезамінування природних L-амінокислот. Широко поширена ксантиндегідрогеназа (ксантиноксидаза); вона виявлена в молоці, у тонкому кишечнику, нирках і печінці.
Ксантиндегідрогеназа містить молібден; відіграє важливу роль у перетворенні пуринових основ у сечову кислоту в печінці і нирках. Особливе значення має для птахів, які екскретують сечову кислоту як головний кінцевий азотовмісний продукт метаболізму пуринів, а також катаболізму білків і амінокислот.
Альдегіддегідрогеназа – ФАД-вмісний фермент, що знаходиться в печінці. Це – металофлавопротеїн – містить молібден і негемове залізо, окислює альдегіди і N-гетероциклічні субстрати.
Глюкозооксидаза – ФАД-специфічний фермент, який одержують із грибів. Вона важлива тим, що використовується при визначенні глюкози.
Механізм окислення і відновлення, що здійснюється цими ферментами, дуже складний. Судячи з наявних даних, відбувається двостадійне відновлення ізоаллоксазонового кільця з проміжним утворенням семіхінона (вільного радикала):
3) Анаеробні дегідрогенази – ферменти, які каталізують видалення водню із субстрату, але не здатні використовувати кисень як акцептор водню. До цього класу належить велике число ферментів. Вони виконують дві функції:
а) перенесення водню з одного субстрату на інший в спряженій окисно-відновній реакції:
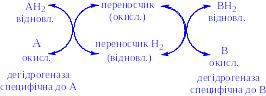
Ці дегідрогенази специфічні до субстратів, але часто використовують один і той же кофермент або переносник водню. Оскільки реакції, які розглядаються оборотні, то вони забезпечують у клітині вільне перенесення відновних еквівалентів. Реакції цього типу призводять до окислення одного субстрату за рахунок відновлення іншого, особливо важливі для здійснення окисних процесів за відсутності кисню.
б) функцію компонентів дихального ланцюга забезпечуючи транспорт електронів від субстрату на кисень:

Поділяються на:
Дегідрогенази, залежні від нікотинамідних коферментів. До цієї категорії належить багато дегідрогеназ. Вони специфічні або до нікотинамідаденіндинуклеотиду (НАД+), або до нікотинамідаденіндинуклеотидфосфату (НАДФ+), які виконують роль коферментів (рис. 1). НАД+ і НАДФ+ утворюються в організмі людини з вітаміну В5. Для синтезу НАД+ чи НАДФ+ ферменти, які знаходяться в цитозолі більшості клітин, використовують тільки нікотинову кислоту, але не нікотинамід. Нікотинамідний фрагмент НАД+ утворюється з нікотинатного фрагмента, коли останній знаходиться в складі нуклеотиду; амідна група надходить від глутаміну (рис. 1).
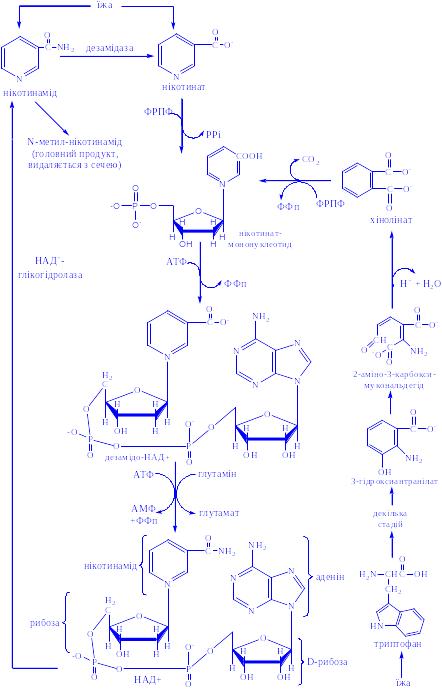
Рис 1. Синтез і розклад нікотинамідаденіндинуклеотиду (НАД).
Є дані про те, що в мітохондріях для синтезу НАД+ використовується нікотинамід. Коферменти відновлюються специфічними субстратами дегідрогеназ і окислюються адекватним акцептором електронів (рис. 2).
НАД+ + AH2 D НАДH + H+ + A
Рис 2. Механізм окислення і відновлення нікотинамідних коферментів.
У загальному випадку НАД-залежні дегідрогенази каталізують окисно-відновні реакції окисних шляхів метаболізму – гліколізу, циклу лимонної кислоти, дихального ланцюга мітохондрій. НАДФ-залежні дегідрогенази беруть участь у процесах відновного синтезу, зокрема у позамітохондріальному синтезі жирних кислот і стероїдів; вони також є коферментами дегідрогеназ пентозофосфатного шляху. Деякі дегідрогенази, які функціонують з нікотинамідними коферментами, містять іон цинку, зокрема алкогольдегідрогеназа печінки і гліцеральдегід-3-фосфатдегідрогеназа скелетних м'язів. Припускають, що іони цинку не беруть участь безпосередньо в процесах окислення і відновлення.
Рибофлавінзалежні дегідрогенази. Флавінові групи цих дегідрогеназ ті ж, що й в аеробних дегідрогеназ, ФМН і ФАД. Більшість рибофлавін-залежних анаеробних дегідрогеназ або бере участь у транспорті електронів по дихальному ланцюзі, або поставляє електрони для цього ланцюга. НАДФ-дегідрогеназа – компонент дихального ланцюга, яка переносить електрони від НАДН до більш електропозитивних компонентів. Інші дегідрогенази, наприклад сукцинатдегідрогеназа, ацил-СоА-дегідрогеназа і мітохондріальна гліцерол-3-фосфат-дегідрогеназа переносять відновні еквіваленти від субстрату безпосередньо на дихальний ланцюг. Ще одна функція флавін-залежних дегідрогеназ – каталіз дигідроліпоїл-дегідрогеназою дегідрування відновленого ліпоату (інтермедіату при окисному декарбоксилуванні пірувату й a-кетоглутарату). У цьому випадку внаслідок низького значення окисно-відновного потенціалу системи ліпоату переносником водню від відновленого ліпоату до НАД+ є флавопротеїн (ФАД). Електрон-переносний флавопротеїн є проміжним переносником електронів між ацил-СоА-дегідрогеназою і дихальним ланцюгом.
в) Цитохроми. За винятком розглянутої вище цитохромоксидази, цитохроми класифікуються як анаеробні дегідрогенази. Їх ідентифікація і вивчення полегшуються тією обставиною, що у відновленому стані вони мають характерні смуги в спектрі поглинання, які зникають при окисленні. У дихальному ланцюзі вони служать переносниками електронів від флавопротеїнів до цитохромоксидази. Цитохроми є залізовмісними гемопротеїнами, у яких атом заліза переходить зі стану Fe2+ у Fe3+ і назад у процесі окислення і відновлення. До складу дихального ланцюга входять цитохроми b, с1, с, а і а3 (цитохромоксидаза). З них розчинним є тільки цитохром с. Крім дихального ланцюга цитохроми містяться в ендоплазматичному ретикулумі (цитохроми Р450 і b5), у рослинних клітинах, бактеріях і дріжджах.
Відновлення нікотинаміду субстратом (АН2) по положенню 4 відбувається стереоспецифічно. Один з атомів водню переноситься від субстрату в положення 4 у виді ядра водню з двома електронами (гідрид-іон, Н- ): він може приєднатися або в А-, або у В-положенні в залежності від специфічності дегідрогенази, яка каталізує дану реакції. Інший водень, який відщеплюється від субстрату, залишається вільним у виді іона водню.
4) Гідроксипероксидази – ферменти, які використовують як акцептор перекис водню або органічні перекиси. До цієї категорії відносяться два типи ферментів: пероксидази, які знаходяться в складі молока, в рослинах, лейкоцитах, тромбоцитах, еритроцитах і т.д., і каталаза, яка функціонує в тканинах тварин і рослин.
Пероксидаза. Спочатку пероксидази вважалися рослинними ферментами, пізніше вони були виявлені також у молоці, лейкоцитах, тромбоцитах, а також у тканинах, у яких відбувається метаболізм ейкозаноїдів. Простетичною групою є протогем, який на відміну від гемових груп більшості гемопротеїнів дуже слабко зв'язаний з апоферментом. У реакції, яку каталізує пероксидаза, перекис водню відновлюється за рахунок сполук, що виступають як донори електронів, таких, як аскорбат, хінони чи цитохром с. Реакція, яку каталізує пероксидаза, має складний характер; сумарна реакція виглядає в такий спосіб:
Н2О2
+ АН2
![]() 2Н2О
+ А
2Н2О
+ А
В еритроцитах глутатіонпероксидаза, яка містить як простетичну групу – селен, каталізує розклад Н2О2 і гідроперекисів ліпідів відновленим глутатіоном і в такий спосіб захищає ліпіди мембран і гемоглобін від окислення перекисами.
Каталаза. Гемопротеїн, який містить чотири гемові групи. Поряд з пероксидазною активністю каталаза здатна використовувати одну молекулу Н2О2 як донор електронів, а іншу – як окислювач, тобто акцептор електронів. In vivo у більшості випадків каталаза розкладає пероксид водню:
2Н2О2
![]() 2Н2О
+ О2
2Н2О
+ О2
Каталаза міститься у крові, кістковому мозку, мембранах слизових оболонок, нирках і печінці. Її функція – розкладання перекису водню, що утворюється при дії аеробних дегідрогеназ. У багатьох тканинах, включаючи і печінку, виявлені мікротільця, пероксисоми, які багаті аеробними дегідрогеназами і каталазою. Очевидно, біологічно вигідно групувати як ферменти, що призводять до утворення Н2О2, так і ферменти, що розкладають його в одному місці:
До ферментів, що забезпечують утворення Н2О2, крім пероксисомних ферментів відносяться також мітохондріальні і мікросомні системи транспорту електронів.
5) Оксигенази – ферменти, які каталізують пряме введення кисню в молекулу субстрату.
Оксигенази не належать до ферментів, що каталізують реакції, які збагачують клітину енергією; вони беруть участь у синтезі і розкладі багатьох типів метаболітів. Ферменти цієї групи каталізують включення кисню в молекулу субстрату.
Воно відбувається в дві стадії: 1) кисень зв'язується з активним центром ферменту; 2) відбувається реакція, у результаті якої зв'язаний кисень відновлюється чи переноситься на субстрат. Оксигенази діляться на дві підгрупи.
а) Діоксігенази (кисень-трансферази, істинні оксигенази). Ці ферменти каталізують включення в молекулу субстрату обох атомів молекули кисню:
А + О2 ® АО2.
Приклад – залізовмісні ферменти гомогентизатдіоксігеназа і 3-гідроксиантранілат-діоксігеназа із супернатантної фракції гомогенату печінки, а також гемвмісні ферменти, зокрема L-триптофандіоксігеназа (триптофанпіролаза) з печінки.
б) Монооксигенази (оксидази зі змішаною функцією, гідроксилази). Ці ферменти каталізують включення в субстрат тільки одного з атомів молекули кисню. Інший атом кисню відновлюється до води; для цього необхідний додатковий донор електронів (косубстрат):
А–Н + О2 + ZH2 ® А–ОН + Н2О + Z
Мікросомні цитохром Р450-вмісні монооксигеназні системи. До цієї групи належать ферменти, які беруть участь у метаболізмі багатьох лікарських речовин шляхом їх гідроксилювання. Вони знаходяться в мікросомах печінки разом з цитохромом Р450 і цитохромом b5. Відновниками цих цитохромів є НАДН і НАДФН (рис. 3); цитохроми окислюються субстратами в результаті серії ферментативних реакцій, які складають так званий гідроксилазний цикл (рис. 4):
Лік–Н
+ О2
+ 2Fe2+(P450)
+ Н+
![]() Лік–ОН + Н2О
+ 2Fe3+
Лік–ОН + Н2О
+ 2Fe3+
(Лік – лікарська речовина).
Рис 3. Ланцюг транспорту електронів в мікросомах.
Ціанід (CN-) гальмує стадію, вказану на рисунку.
Рис 4. Цитохром Р450-гідроксилазний цикл у мікросомах.
До лікарських речовин, метаболізм яких відбувається за участю розглянутих систем, відносяться: бенз[a]пірен, амінопірин, анілін, морфін і бензофетамін. Багато лікарських речовин, наприклад фенобарбітал, здатний індукувати синтез мікросомних ферментів і цитохрому Р450.
Мітохондріальні цитохром Р450-вмісні монооксигеназні системи. Ці системи знаходяться в стероїдогенних тканинах – у корі наднирників, у сім’яниках, яєчниках і плаценті; вони беруть участь у біосинтезі стероїдних гормонів з холестеролу (гідроксилювання по С22 і С20 при відщепленні бічного ланцюга і по положеннях 11b і 18). Ферменти ниркової системи каталізують гідроксилювання 25-гідроксихолекальциферолу по положеннях 1a і 24; у печінці відбувається гідроксилювання холестеролу по положенню 26 при біосинтезі жовчних кислот. У корі наднирників вміст мітохондріального цитохрома Р450 у шість разів вище, ніж вміст цитохромів дихального ланцюга. Монооксигеназна система складається з трьох компонентів, локалізованих у внутрішній мітохондріальній мембрані на границі з матриксом: НАДФ-специфічного ФАД-вмісного флавопротеїну, Fе2S2-білка (адренодоксину) і цитохрома Р450 (рис. 5).
Рис 5. Мітохондріальна цитохром Р450-монооксигеназна система.
Наведена система типова для гідроксилаз стероїдів у корі наднирників. Мікросомна цитохром Р450-гідроксилаза печінки не має потреби в присутності залізо-сірчаного білка Fe2S2. Оксид вуглецю (СО) гальмує зазначену на рисунку стадію.
Fe2S2 – залізо-сірчаний білок (адренодоксин). Оскільки НАДФ(H) не може проникати в мітохондріальну мембрану, джерелами відновних еквівалентів є такі субстрати, як малат і ізоцитрат, для яких усередині мітохондрій є специфічні НАДФ-залежні дегідрогенази.
Метаболізм супероксид-радикала. Кисень є потенційно токсичною речовиною. Донедавна його токсичність пов'язували з утворенням Н2О2. Однак останнім часом, приймаючи на увагу, по-перше, ту обставину, що кисень у тканинах легко відновлюється в супероксидний аніон-радикал (O2-.), і, по-друге, наявність в аеробних організмів супероксиддисмутази (СОД) (її немає в облігатних анаеробів), було висунуто припущення про те, що токсичність кисню обумовлена його перетворенням у супероксид. Однак прямих даних про токсичність супероксид-радикала поки не отримано.
Супероксид утворюється в ході одноелектронного окислення молекулярним киснем відновленого флавіну, наприклад флавіну в складі ксантиндегідрогенази. Він утворюється також при одноелектронному окисленні молекулярним киснем відновленого компонента дихального ланцюга:
Enz–H2 + O2 ® Enz–H + O2-. + H+.
Супероксид може відновлювати окислений цитохром с:
О2-. + Цит с (Fе3+) ® О2 + Цит с (Fе2+).
Він відщеплюється також специфічним ферментом – супероксиддисмутазою:
О2-.
+ О2-. + 2Н+
![]() Н2О2 + О2
Н2О2 + О2
У цій реакції супероксид виступає одночасно як окислювач, так відновник. Хімічна дія супероксиду в тканинах підсилюється в результаті ініціювання ланцюгової реакції утворення вільних радикалів. Було висловлено припущення, що О2-., зв'язаний з цитохромом Р450, є інтермедіатом при активації кисню в процесі реакцій гідроксилювання (рис 4).
Функцією супероксиддисмутази є, очевидно, захист аеробних організмів від ушкоджуючої дії супероксиду. Фермент виявляється в декількох внутрішньоклітинних кампартментах. Цитозольний фермент складається з двох подібних субодиниць, які містять по одному іонові Сu2+ і Zn2+; мітохондріальний фермент, так само як і фермент, виявлений у бактерій, містить іон Мn2+. Ця обставина служить ще одним доказом на користь гіпотези про походження мітохондрій із прокаріот, що вступили в симбіоз із протоеукаріотами. Дисмутаза присутня у всіх основних тканинах аеробів. Перебування тварин в атмосфері 100%-ного кисню викликає адаптивне підвищення вмісту дисмутази, особливо в легенях; тривале перебування в такій атмосфері призводить до ушкодження легень і летальному результату. Антиоксиданти, наприклад a-токоферол (вітамін Е), здатні вловлювати вільні радикали, такі, як О2-., знижуючи тим самим токсичність кисню.
Окислювальне фосфорилювання
Розглянуті вище реакції окислення – відновлення різних субстратів, що здійснюються в живих організмах у процесі внутрішньоклітинного обміну, дістали назву біологічного окислення. Процеси біологічного окислення, що проходять у клітинах гетеротрофних організмів, є основним джерелом енергії, необхідної для забезпечення їхньої життєдіяльності. Енергія, що виділяється при анаеробному та аеробному окисленні різних субстратів, нагромаджується в макроергічних зв'язках АТФ – універсальної сполуки, яка може виступати в ролі акумулятора, трансформатора та донора енергії. Близько 50 % енергії окислення органічних сполук резервується в макроергічних зв'язках АТФ. Утворюється АТФ з АДФ і активного фосфату, причому активація останнього і перетворення його на активний фосфорил відбуваються за рахунок енергії окислення органічних сполук. Синтез АТФ з АДФ і неорганічного фосфату, активація якого спряжена з процесами окислення в організмі, називається фосфорилюючим окисленням. Залежно від принципу енергетичного спряження розрізняють фосфорилююче окислення на рівні субстрату та на рівні електронно-транспортного ланцюга. Фосфорилююче окислення на рівні субстрату – це синтез АТФ з АДФ і активного фосфорилу внаслідок перенесення його з продукту окислення субстрату на АДФ. Так синтезується незначна кількість АТФ. Реакції фосфорилюючого окислення на рівні субстрату здійснюються зокрема в процесі анаеробного окислення вуглеводів. Так, у процесі окислення глюкозо-6-фосфату утворюється субстрат, що має макроергічний зв'язок – 1,3-дифосфогліцеринова кислота, яка може передавати активний фосфорил на АДФ, внаслідок чого утворюється молекула АТФ (див. обмін вуглеводів).
У процесі гліколізу проходить ще одна реакція фосфорилюючого окислення (на рівні субстрату) – при перенесенні активного фосфорилу з фосфоенолпірувату, продукту окислення глюкозо-6-фосфату на АДФ (див. обмін вуглеводів).
На третьому етапі виділення енергії (під час аеробного окислення в циклі Кребса) також відбувається реакція фосфорилюючого окислення на рівні субстрату – під час перенесення активного фосфорилу з сукцинілфосфату на ГДФ (див. обмін вуглеводів). Утворена молекула ГТФ вступає в обмінну реакцію АДФ, внаслідок чого утворюється молекула АТФ:
ІТФ + АДФ ® АТФ + ГДФ.
Другий вид енергетичного спряження – фосфорилююче окислення на рівні електронно-транспортного ланцюга – здійснюється в процесі тканинного дихання або біологічного окислення на рівні електронно-транспортного ланцюга.
Значний внесок у з'ясування цього механізму зробили В.П. Скулачов, С.Є. Северин, П. Мітчелл. Дослідженнями було встановлено, що в процесі біологічного окислення під час перенесення протонів та електронів по системі дихального ланцюга, спряжених з процесами окислення, на певних його ділянках відбувається активація неорганічного фосфату і перетворення його на активний фосфорил, який взаємодіє з АДФ і забезпечує синтез АТФ. При перенесенні електронів по системі дихального ланцюга вільна енергія системи поступово зменшується. Згідно з розрахунками, стандартна зміна вільної енергії системи при перенесенні двох електронів по системі дихального ланцюга становить 220 кДж, що достатньо для синтезу 6 – 7 молекул АТФ (враховуючи, що вільна енергія гідролізу АТФ в середньому дорівнює 30,6 кДж; 220 : 30,6 = 7). Однак дослідженнями було встановлено, що при перенесенні двох електронів по системі дихального ланцюга синтезується лише три молекули АТФ, тобто існує три пункти спряження, на яких процес окислення забезпечує активацію неорганічного фосфату і перенесення активного фосфорилу на АДФ. Саме на цих ділянках рівень зміни вільної енергії системи достатній для синтезу АТФ:
Перша молекула АТФ синтезується при перенесенні електронів і протонів від нікотинамідних до флавінових коферментів, друга – при перенесенні електронів від цитохрому b до цитохрому с, третя – утворюється на ділянці перенесення електронів з цитохромоксидази (аа3) на кисень. Отже, під час окислення двох атомів водню в дихальному ланцюгу утворюється три молекули АТФ.
Ступінь спряження окислення і фосфорилювання може бути різний, залежно від умов та стану клітини. Показником спряження окислення і фосфорилювання є коефцієнт Р/О (коефіцієнт фосфорилювання) або відношення зв'язаного неорганічного фосфату до поглиненого в процесі дихання кисню (Р/О = 3, якщо первинною дегідрогеназою є НАД+ і Р/О = 2, якщо водень з субстрату відщеплюють флавінові дегідрогенази). Інтенсивність процесу фосфорилюючого окислення регулюється співвідношенням АТФ/АДФ. Чим менше це співвідношення, тим інтенсивніше відбувається дихання та утворення АТФ.
Фосфорилююче окислення на рівні електронно-транспортного ланцюга відбувається в мітохондріях. Ферментні системи, що каталізують даний процес, локалізовані у внутрішніх мембранах мітохондрій:
Враховуючи їхні функції в спряженні процесів окислення і фосфорилювання, В.П. Скулачов назвав їх „спряжуючими”. Оскільки в процесі фосфорилюючого окислення на рівні електронно-транспортного ланцюга утворюється основна маса АТФ – сполуки, якій належить центральна роль в енергозабезпеченні організму, мітохондрії дістали назву „енергетичних станцій” клітини. Існує кілька гіпотез щодо пояснення механізму фосфорилюючого окислення в процесі біологічного окислення на рівні електронно-транспортного ланцюга.
Хімічна гіпотеза. В основу всіх хімічних гіпотез покладено уявлення про те, що окислення субстратів сприяє утворенню макроергічних зв'язків між неорганічним фосфатом та певними органічними сполуками, з яких він переноситься на АДФ. Хімічна гіпотеза була запропонована Ліпманом. Суть її полягає в тому, що енергія, яка виділяється при перенесенні електронів у дихальному ланцюгу, спочатку використовується для утворення певних гіпотетичних, багатих на енергію сполук, а потім передається для синтезу АТФ. Схематично цей процес можна показати так:
А-Н2 + Х + Б D А~X + Б-Н2; А~Х + Фн = А + Х~Ф; X~Ф + АДФ = X + АТФ,
де А і Б – речовини, що переносять електрони; Фн – неорганічний фосфат; X – невідома, гіпотетична речовина.
Однак хімічна гіпотеза до цього часу не дістала експериментального підтвердження.
Конформаційні гіпотези. Ці гіпотези пояснюють синтез АТФ з АДФ і неорганічного фосфату внаслідок конформаційних переходів, які виникають під час окислення. Проте гіпотези експериментального підтвердження не знайшли, хоча окремі моменти їх були використані П. Мітчеллом при розробці хеміосмотичної концепції спряження процесів окислення та фосфорилювання на рівні електронно-транспортного ланцюга, яка нині є загальноприйнятою. Основним постулатом гіпотези є те, що під час функціонування електронно-транспортних ланцюгів виникає осмотична енергія (енергія концентраційного градієнта), яка використовується для здійснення хімічної роботи – синтезу АТФ (звідки і назва – хеміосмотична гіпотеза), тобто гіпотеза передбачає перехід хімічної енергії, що виділяється під час транспорту електронів, на градієнт мембранного електрохімічного потенціалу іонів водню та перетворення останнього на стабільну енергію макроергічних зв'язків АТФ. Рушійною силою процесу фосфорилювання є градієнт електрохімічного потенціалу протонів водню (D`mН+), що виникає на спряжуючій мембрані, яка має високий електричний опір та низьку проникність для заряджених часточок (іонів Н+ та ОН–). Перенесення їх забезпечується протонними насосами, які відкачують протони з матрикса в міжмембранний простір (проти градієнта концентрації), внаслідок чого відбувається закислення міжмембранного простору. Зовнішня частина спряжуючої мембрани при цьому набуває позитивного заряду. Однак у матриксі створюється надлишок іонів ОН–, що призводить до підлуження середовища та появи негативного заряду на внутрішній частині спряжуючої мембрани (збоку матрикса). Отже, електрохімічний потенціал (D`mН+), який виникає на спряжуючій мембрані, складається з двох компонентів – електричного (різниці електричних потенціалів – DY) та осмотичного (концентраційного – DрН):
D`mН+ = DY + DрН.
Зворотний потік протонів (за градієнтом концентрації) відбувається через Н+–АТФ-азний комплекс. Саме цей потік протонів забезпечує синтез АТФ. Н+–АТФ-азний комплекс спряжуючої мембрани – це фермент АТФ-синтетаза, який складається з фактора F1 та мембранних компонентів (комплексу F0). Фактор F1-мультимер з молекулярною масою 360 тис., складається з п'яти типів субодиниць – a, b, g, t, e. Основні каталітичні функції даного комплексу забезпечуються a- і b-субодиницями. На a-субодиниці локалізується активний центр фактора, а на b-субодиниці – центр зв'язування субстрату (АДФ, Фн). До складу комплексу F0 входять кілька видів білків з молекулярною масою 19 – 30 тис., які забезпечують утворення протонпровідного каналу та спрямованість потоку протонів. Комплекс F0 виконує роль рецепторної та спряжуючої ділянок ферменту, а фактор F1 – каталітичної. Н+–АТФ-азний комплекс локалізується в спряжуючій мембрані мітохондрій так, що комплекс F0 пронизує всю мембрану, а фактор F1 – локалізується на внутрішньому боці мембрани мітохондрій (з боку матрикса). Цей комплекс нагадує грибоподібні вирости, в яких ніжка гриба пронизує товщу мембрани, а головка – локалізується на поверхні крист.
Нині існує кілька пояснень механізму спряження окислення і фосфорилювання. Суть більшості з них полягає в тому, що процес спряження здійснюється внаслідок використання енергії (D`mН+) при нагромадженні протонів (Н+) в активному центрі Н+–АТФ-азної системи, розміщеної у факторі F1. Нагромадження їх призводить до активації неорганічного фосфату, утворення активного фосфорилу, зв'язаного b-субодиницею фактора F1 внаслідок зняття з нього групи ОН та елімінації (видалення) води у матрикс. Одночасно відбувається й активація АДФ, зв'язаного з цією самою субодиницею фактора F1 після втрати протона при взаємодії з групою ОН матрикса. Активований фосфат і АДФ, сполучаючись, утворюють молекулу АТФ. Згідно з іншою концепцією, утворення АТФ відбувається так: протони Н+ в активному центрі спряжуючого фактора активують фосфат і карбоксильну групу однієї з субодиниць фактора F1, внаслідок чого утворюється фосфоензим з макроергічним зв'язком. При взаємодії АДФ з фосфоензимом утворюється АТФ. Існує також припущення, що роль протонів Н+ полягає у зміні конформації фактора F1 і що саме конформаційні видозміни активного центру Н+–АТФ-азного комплексу є рушійною силою для синтезу АТФ.
В результаті досліджень П. Бойєра було встановлено, що швидкий і зворотний синтез АТФ може відбуватися в активному центрі АТФ-ази без затрат енергії (D`mН+). Стадією, що лімітує дану реакцію, є виділення синтезованої АТФ з активного центру ферменту в матрикс, тобто з гідрофобної фази у водну.
Саме цей процес прискорюється при енергизації мембрани. Згідно з гіпотезою П. Мітчелла, на кожній мембрані є два протони, що транспортуються по електронно-транспортнсму ланцюгу крізь мембрану, внаслідок чого синтезується одна молекула АТФ. Отже, ланцюг перенесення електронів має три протонних насоси, що відповідають трьом ділянкам спряження. Дихальний ланцюг тричі перетинає внутрішню мембрану, при цьому кожна пара електронів, що переносяться від НАД×Н2 до кисню, виділяє три пари протонів із внутрішнього матрикса і переносить у міжмембранний простір. Цим зумовлене чергування в дихальному ланцюгу переносників протонів і електронів.
Крім окислення, спряженого з процесами фосфорилювання та синтезом АТФ, існує так зване вільне або нефосфорилююче окислення. Ферментні системи вільного окислення локалізовані на зовнішньому боці внутрішньої мембрани мітохондрій, а також на мембранах ендоплазматичного ретикулуму та інших клітинних органел. Вільне окислення, як правило, процесами фосфорилювання та спряженими з ними процесами синтезу АТФ не супроводжується. Енергія, що утворюється в процесі вільного окислення, розсіюється у вигляді теплоти. Вважають, що система дихального ланцюга, яка забезпечує фосфорилююче окислення, може переключатись на процеси вільного окислення, що відіграє важливу роль у процесах адаптації організму до умов навколишнього середовища. Зокрема, досліджено, що при охолодженні організму фосфорилююче окислення послаблюється, а вільне окислення, навпаки, посилюється. Внаслідок цього енергія окислення органічних сполук генерується на теплоту тіла, тобто в організмі існують механізми, що забезпечують зміну співвідношення між фосфорилюючим та вільним окисленням. Сполуки, що гальмують спряженість процесів окислення та фосфорилювання, називаються роз'єднуючими факторами.
У ролі роз'єднувачів можуть виступати різні метаболіти, біологічно активні сполуки, хімічні агенти, лікарські препарати тощо. Так, гормон тироксин послаблює спряженість процесів окислення і фосфорилювання, а інсулін, навпаки, посилює даний процес. У зв'язку з цим при надмірній секреції тироксину внаслідок гіперфункції щитовидної залози, як правило, спостерігається підвищення температури, хворі погано переносять тепло. Із хімічних агентів у ролі роз'єднувачів виступають такі сполуки, як динітрофенол, дикумарини та ін. Значно послаблюють спряженість процесів окислення і фосфорилювання також токсини патогенних мікроорганізмів, які викликають інфекційні захворювання, що супроводжуються підвищенням температури. За цих умов лікарські препарати, такі як ацетилсаліцилова кислота, фенацетин та інші, згубно діють на збудників захворювань і сприяють відновленню спряження між процесами окислення та фосфорилювання, в результаті чого знижується температура організму.
Зміна співвідношення між процесами фосфорилюючого та вільного окислення досить важлива для тварин, які впадають в анабіоз. Процеси життєдіяльності в цих тварин підтримуються на низькому рівні й енергетичні витрати мінімальні, тому в них процеси вільного окислення переважають над фосфорилюючим окисленням. Такі тварини мають запаси бурого жиру, що містить велику кількість мітохондрій, які спеціалізуються на продукуванні теплоти, що зігріває кров. У вигляді роз'єднувачів у даному випадку є жирні кислоти, що утворюються при розщепленні жирів і надходять у кров. Як тільки запаси жиру вичерпуються, процеси фосфорилювання поновлюються і тварини виходять з анабіозу. Це досить часто трапляється з тваринами, в яких запаси жиру недостатні, внаслідок чого стан анабіозу припиняється серед зими.
Зміна співвідношення між процесами фосфорилюючого та вільного окислення відіграє важливу роль в адаптації організмів до зміни умов навколишнього середовища. Отже, основною сполукою, що відіграє вирішальну роль в енергозабезпеченні організму, є АТФ, синтез якої здійснюється спряжено з процесами окислення в організмі. Енергія, що акумулюється в макроергічних зв'язках АТФ, може бути використана для різних потреб організму, процесів синтезу, руху, транспорту іонів, виконання роботи. Це зумовлено тим, що АТФ може виступати не лише в ролі акумулятора енергії, але і її трансформатора та донора. АТФ відіграє провідну роль в енергообміні, що пов'язано з особливостями її будови. Завдяки наявності сильного негативного заряду, за рахунок іонізованих фосфатних груп, відбувається зближення пуринового циклу з залишками фосфату. При цьому стабільна енергія, що вивільнюється під час розриву макроергічних зв'язків у молекулі АТФ, передається на пуриновий цикл і трансформується на мобільну енергію збудження електронів системи спряжених подвійних зв'язків пуринового циклу. Це викликає перехід у збуджений стан електронів хімічних сполук, що підлягають перетворенню, і надає їм підвищену реакційну здатність, створюючи потенційну можливість для зворотного перетворення мобільної енергії збуджених електронів на стабільну енергію хімічних зв'язків. Трансформація стабільної енергії фосфоангідридних зв'язків на мобільну енергію збуджених електронів пуринового циклу та зворотній процес – перетворення мобільної енергії збуджених електронів в стабільну енергію хімічних зв'язків органічних сполук є першим етапом перетворення енергії в організмах.
При енергетичному обміні в організмі основною ланкою є аденілатна система: АТФ та продукти її гідролізу – АДФ, АМФ, Фн і пірофосфат. Ця система подібно до акумулятора може заряджатись енергією від певних генераторів і передавати її на інші сполуки, забезпечуючи процеси енергетичного обміну, тобто в організмі проходить постійне утворення АТФ (нагромадження енергії) та її розщеплення, що супроводжується вивільненням енергії:
АДФ + Фн ® АТФ; АТФ ® АДФ + Фн.
При гідролізі АТФ утворюються молекула АДФ і неорганічний фосфат. Рівень зміни стандартної вільної енергії при цьому становить 37 – 42 кДж/моль. Під час гідролізу кінцевої фосфатної групи АДФ спостерігається близька величина зміни рівня стандартної вільної енергії, однак АДФ не є макроергічною сполукою, оскільки виділена енергія розсіюється у вигляді теплоти. При гідролізі АМФ рівень зміни стандартної вільної енергії становить 9,6 кДж/моль, тобто АМФ і АДФ не є макроергічними сполуками.
Крім схеми, наведеної вище, гідроліз АТФ може проходити з відщепленням двох залишків фосфату:
АТФ ® АМФ + Н4Р2О7
Пірофосфат, що утворюється при цьому, є макроергічною сполукою, однак його використання в обмінних процесах обмежене в зв'язку з тим, що під час гідролізу його макроергічних зв'язків вивільнюється теплова енергія.
Лекція № 10. Обмін вуглеводів.
Обмін вуглеводів є складовою частиною загального обміну речовин і енергії в організмах людини і тварини. Він складається з чотирьох етапів: перетравлювання, всмоктування, проміжного і кінцевого обмінів.
Перетравлювання вуглеводів
Вуглеводи складають основу рослинних кормів. У більшості з них вони знаходяться у вигляді оліго-, гомо- і гетерополісахаридів, складових частин глюко- і мукопротеїдів, нуклеїнових кислот, біокомплексних сполук. Для засвоєння таких вуглеводів організмом необхідне їх попереднє гідролітичне розщеплення до простих цукрів: глюкози, фруктози, манози, галактози, рибози, дезоксирибози, арабінози, ксилози і т.д. Таке розщеплення починається з моменту попадання їжі в ротову порожнину.
У ротовій порожнині їжа механічно подрібнюється, змочується слиною, перемішується і перетворюється на харчову грудку.
Слина – змішаний секрет трьох залоз: привушної, підщелепної і під'язикової. Це мутнувата рідина (інколи – прозора), з r = 1,002 – 1,010 і D – 0,25 – 0,50. Значення рН коливається від 7,2 – 7,6 до 8,2 – 8,5. Містить до 99,4% води і 0,6% нерозчинного залишку, до складу якого входять муцини, альбуміни, глобуліни, амінокислоти, ферменти (амілаза, мальтаза, лактаза, ін.), холестерин, глюкоза, молочна кислота, вітаміни та ін. Мінеральний склад слини представлений аніонами хлоридів, гідрокарбонатів, фосфатів, роданідів, сульфатів, йодидів, бромідів і катіонами Na+, K+, Ca2+, Mg2+, Fe3+, Cu2+, Mn2+, Ni2+, Li+, Zn2+, ін.
Їжа, що містить крохмаль, інулін і глікоген, під впливом ферменту амілази піддається гідролітичному розщепленню:
(C6H10O5)n
+ nH2O
![]() nС12Н22O11.
nС12Н22O11.
Цей процес починається у порожнині рота під впливом ферменту амілази слини, яка належить до класу гідролаз, підкласу мікозидаз.
У природі виявлено a-, b-, g-амілази, кожна з яких вузько специфічна. Так, g-амілаза каталізує гідроліз 1,4-зв’язків у молекулах полісахаридів, послідовно відщеплюючи залишки глюкози від кінця їх молекул. Цей фермент досить поширений у тканинах тварин. b-Амілаза інтенсифікує гідроліз 1,4-зв’язків, послідовно відщеплюючи від кінця молекули полісахариду по два залишки глюкози, тобто молекули мальтози. Цей фермент поширений в основному в рослинних організмах. a-Амілаза належить до ендоамілаз. Вона каталізує гідролітичне розщеплення внутрішніх 1,4-зв’язків у молекулах полісахаридів. За цих умов утворюються відносно великі уламки молекул полісахаридів (декстрини), олігосахариди, а також частково дисахарид мальтоза.
a-Амілаза містить у своїх активних центрах іони кальцію, які забезпечують її каталітичну дію.
Амілаза слини складається в основному з a-амілази. Її ще називають птіаліном, або діастазою. Крім a-амілази у слині міститься також фермент мальтаза (a-глюкозидаза), яка розщеплює мальтозу на дві молекули глюкози. Тому при тривалому перебуванні вуглеводної їжі у порожнині рота відчувається солодкий смак.
Цікавим є той факт, що на вміст ферментів у слині впливає склад їжі. Так, вміст амілази у слині хижаків, які харчуються м’ясом, практично відсутній. У людей, які споживають їжу, багату на вуглеводи, вміст амілази у слині вищий, ніж у тих, які споживають бідну на вуглеводи їжу.
Амілаза найбільш активно впливає на крохмаль вареної їжі, розщеплюючи його до мальтози. Під впливом мальтази мальтоза може розщеплюватися до глюкози:
С12Н22O11 + Н2O ® 2C6H12O6.
Їжа у ротовій порожнині знаходяться недовго (1 – 5 хв.), де ферменти частково розщеплюють вуглеводи. Більшість полісахаридів залишаються незмінними і у такому вигляді поступають у шлунок або передшлунки. Найбільша активність амілази і мальтази – в слині людини і мавп, найнижча – в слині собак і кішок.
Після ротової порожнини харчова грудка по стравоходу проходить у шлунок. Тут розщеплення вуглеводів поступово припиняється. У міру просочення кормових мас шлунковим соком амілаза і мальтаза слини інактивуються, (через 20 – 30 хв.) унаслідок різкої зміни реакції середовища. Зміна рН середовища (рН шлункового соку дорівнює 1,5 – 2) повністю інактивує ферменти, оптимальна каталітична дія яких виявляється при рН – 6,8...7,2.
На відміну від інших вуглеводів, перетравлювання клітковини має свої особливості. У травному каналі організмів людини і тварин відсутні ферменти, які здійснюють гідролітичне розщеплення клітковини, зокрема b-амілаза. Цей фермент продукується в основному симбіотичними з організмом тварини мікроорганізмами. Симбіоз починається з перших днів постнатального онтогенезу і якнайповніше виражений під час переходу тварин на рослинне живлення.
Основним місцем перетравлювання клітковини є нижні відділи тонкої і особливо товста кишка у людини і рубець у жуйних тварин, де під впливом ферментів мікрофлори проходить її ферментативний гідроліз. Наявність мікроорганізмів, здатних гідролізувати клітковину, має особливо важливе значення для жуйних тварин, для яких клітковина є основою харчового раціону. Наприклад, у 1 г вмісту рубця міститься до 1010 мікроорганізмів, в основному, інфузорій, а також різних видів бактерій, актиноміцетів, дріжджів, мікроскопічних грибів і водоростей. Під впливом ферментів, що виробляються цими мікроорганізмами, клітковина гідролізується до a- і b-глюкоз:
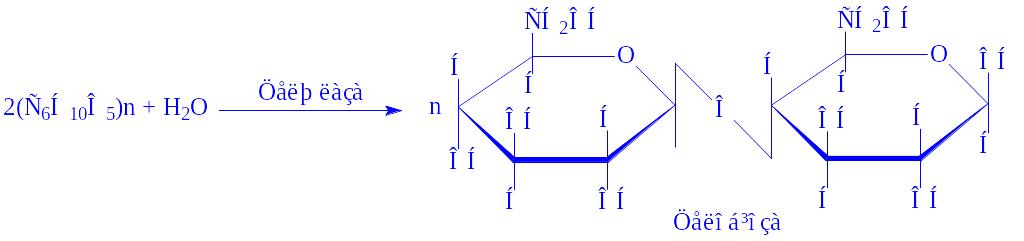
C12H22O11
+ H2O
![]() C6H12О6
+ C6H12О6.
C6H12О6
+ C6H12О6.
Надалі під впливом ферментів мікроорганізмів a- і b-глюкоза піддається різним видам бродіння. Продуктами бродіння є жирні кислоти (оцтова, пропіонова, масляна, валеріанова, капронова, молочна, ін.), альдегіди і кетони, спирти, гази. Так, під впливом Вact. lactis з глюкози утворюється молочна кислота:
C6H12O6 ® 2CH3CHOH–COOH.
Основна маса жирних кислот всмоктується слизовою оболонкою шлунку. Частина з них витрачається на живлення мікроорганізмів і є матеріалом для синтезу ними амінокислот, білків, нуклеїнових кислот, ліпідів та інших речовин. Мікроорганізми, перетравлюючись в нижніх відділах харчового каналу, служать джерелом для отримання організмом-господарем біологічно важливих сполук.
Перетравлювання вуглеводів закінчується в тонкій кишці (дванадцятипалій і клубовій). Тут кормові маси піддаються дії соку підшлункової залози і кишкового соку.
Сік підшлункової залози – безбарвна рідина, без запаху, рН > 7,5, r » 1,010. У людини за добу виділяється 1,5 – 2 л, корови – 3 – 4, свині – 8, собаки – 0,2 л соку. Сік складається з води (90%) і нерозчинного залишку (10%), який містить білки, в основному ферменти (амілазу, мальтазу, лактазу, інвертазу, протеази, нуклеази), а також ліпіди і мінеральні солі, основу яких складає гідрокарбонат натрію. Найбільше соку виділяється під час надходження вуглеводного корму, менше – під час надходження м’ясного корму.
Кишковий сік – безбарвна або жовта рідина, з r = 1,007 – 1,010 і рН > 7,5. Складається з води (98,5 – 98,8%) і нерозчинного залишку (1,5 – 1,2%). Залишок за хімічним складом схожий із складом злущених епітеліальних клітин стінок кишки. В кишковому сокові містяться муцин, ферменти, сироваткові білки, ліпіди, мінеральні речовини, ін. Сік виробляється кишковими, а в дванадцятипалій кишці ще і дуоденальними залозами.
Кормові маси, що поступили з шлунку в тонку кишку, просочуються соком підшлункової залози і кишковим соком і ретельно перемішуються, перетворюючись на рідку кашку – химус. Полісахариди (глікоген, крохмаль, інулін) та їх похідні (декстрини) під впливом a-амілази розщеплюються до дисахаридів:
2(C6H10О5)n + nН2O ® 2nС12Н22О11.
Подальше розщеплення дисахаридів здійснюється різними ферментами. Наприклад, мальтоза розщеплюється під впливом ферменту мальтази:
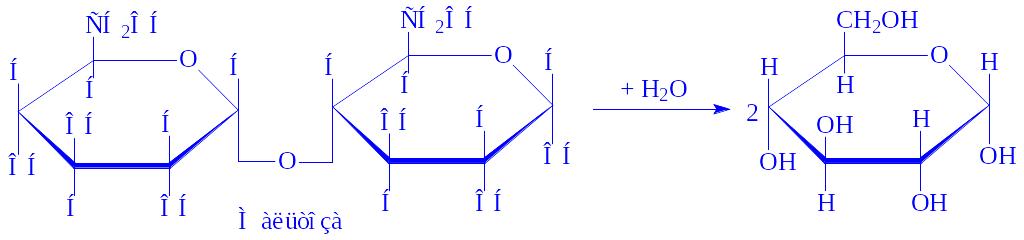
Лактоза і сахароза розщеплюються лактазою (b-галактозидазою) і сахаразою або інвертазою (b-фруктофуранозидазою):
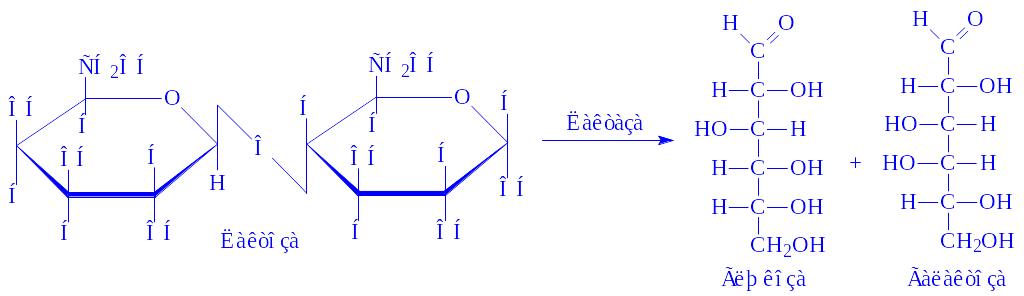
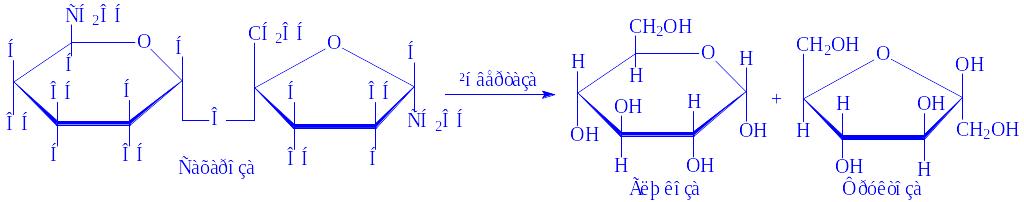
Розщеплення дисахаридів відбувається в основному на поверхні кишкового епітелію на його мікроворсинках і між ними. Деяка частина моносахаридів утворюється також у результаті гідролітичного розщеплення нуклеїнових кислот, глікопротеїдів, гліколіпідів та інших сполук.
Що стосується клітковини, то в організмах людини і хижих тварин значна частина її не розщеплюється, а виводиться з організму. Однак клітковина повинна бути обов’язковим компонентом харчового раціону, оскільки вона є важливим стимулятором секреторної і моторної функцій кишок і необхідна для формування калу. При тривалій відсутності в харчовому раціоні клітковини в організмах людини і жуйних тварин розвивається атонія кишок.
Крім клітковини в овочах і фруктах, які споживає людина, міститься певна кількість пектинових речовин, що позитивно впливають на процеси травлення, пригнічують процеси гниття в кишках, поліпшують умови життєдіяльності корисної мікрофлори. Пектинові речовини виявляють також антитоксичні властивості і здатні знешкоджувати деякі отруйні речовини. Отже, споживання овочів і фруктів сприяє не лише збалансуванню дієти за окремими вуглеводами, а й має важливе значення для нормального функціонування травного апарата і протікання процесів травлення.
Всмоктування вуглеводів
Всмоктування – це складний біохімічний процес переходу молекул моносахаридів і їх ефірів через епітелій слизової оболонки тонкої кишки в кров і лімфу. Слід зазначити, що деяка кількість моносахаридів (до 10%) всмоктується слизовою оболонкою шлунку. Тонка кишка має величезну всмоктуючу поверхню (у людини вона досягає 500 м2). Збільшенню такої поверхні сприяє наявність в слизовій оболонці ворсинок (2 – 2,5 тис. на 1 см2) і мікроворсинок (2 – 3 тис. на 1 клітину). Тут кормові маси перебувають в середньому 8 – 9 год. За такий проміжок часу практично всі моносахариди які є в химусі всмоктуються через слизову оболонку в кров.
Пентози всмоктуються повільніше, ніж гексози. Гексози всмоктуються, головним чином, у вигляді гексозофосфатів, що перешкоджає вирівнюванню осмотичної концентрації в епітелії у міру всмоктування і забезпечує безперервне надходження гексоз. На швидкість всмоктування впливає лише структура молекули гексози. Наприклад, якщо швидкість всмоктування глюкози прийняти за 100, то швидкість всмоктування галактози буде 110, фруктози – 43, манози – 19. Після переходу через кишкову стінку гексозофосфати гідролізуються: моносахариди поступають в кровоток, а H3PO4 використовується для фосфорилювання нових порцій вуглеводів, що всмоктуються. Під час всмоктування частина моносахаридів (фруктоза, галактоза, маноза) таутомеризуються в глюкозу. Зокрема, фруктоза:
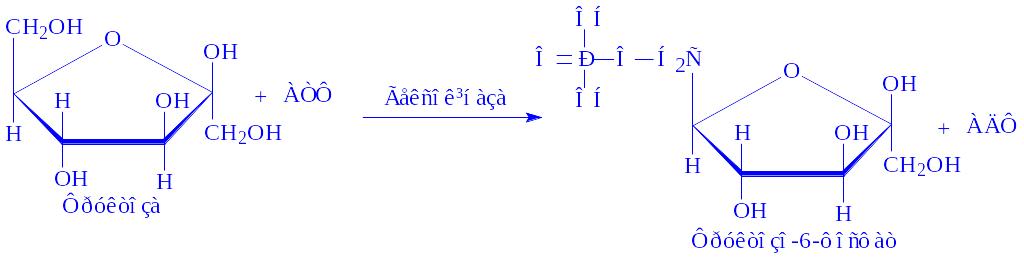 ,
,
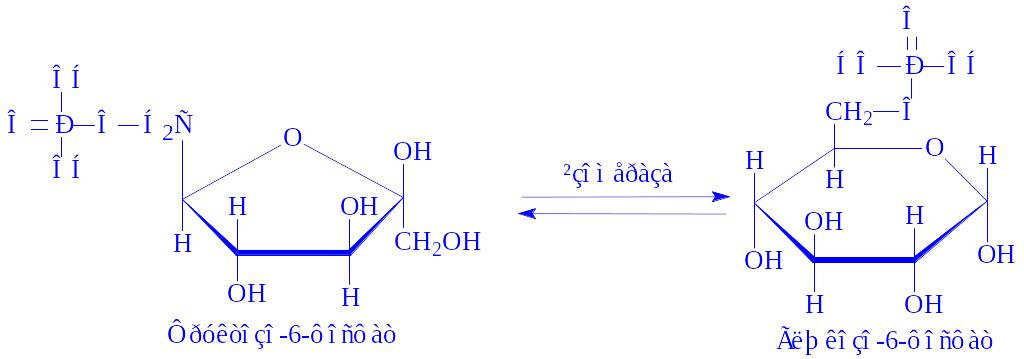 ,
,
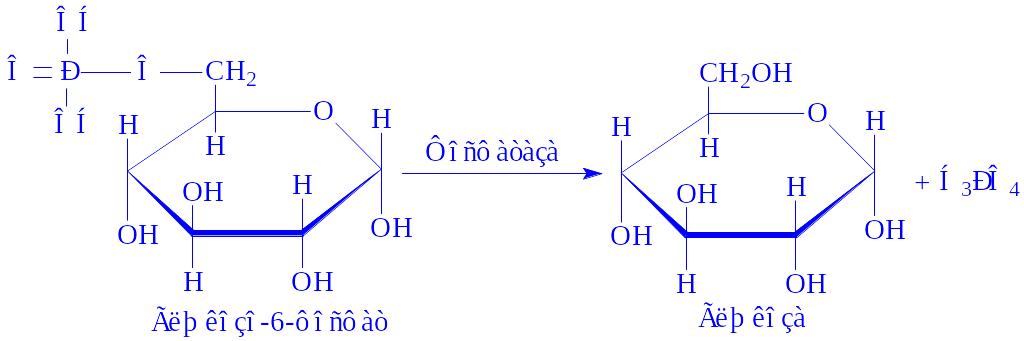 .
.
Перетворення галактози в глюкозу відбувається дещо складніше:

Використання сучасних методів дослідження розширило уявлення про механізм всмоктування моносахаридів та інших речовин. Механізм всмоктування пояснює теорія переносників, згідно якої транспортування моносахаридів в клітину епітелію ворсинки здійснюється за допомогою спеціальних білків з молекулярною масою 10 – 30 тис. Вони знаходяться на мембранах мікроворсинок і відразу ж після ферментативного розщеплення дисахаридів сприймають на певні „майданчики” своїх молекул моносахариди, які потім переносять у глиб клітини до базального її краю. Переносник з’єднується з моносахаридами і їх дериватами. Мітохондрії в цих процесах є джерелом хімічної енергії. Комплекс переносник–моносахарид може пересуватися в глиб клітини по ендоплазматичній мережі та іншим органоїдам. На базальній поверхні клітини комплекс розпадається. Переносник повертається назад до поверхні клітини і з’єднується з новими порціями моносахаридів. Моносахариди потрапляють в міжклітинну рідину, потім в судинну систему – капіляри, підепітеліальну і підслизову венозну мережу, вени брижейки і ворітну вену. Процес всмоктування активується іонами Na+, які створюють натрієвий насос, що забезпечує активне транспортування моносахаридів через мембрани ентероцита.
У товстій кишці (сліпа, ободова, пряма) частина полісахаридів, яка не піддалася гідролізу, розкладається під впливом мікробів. Продукти, що утворилися при цьому, всмоктуються слизовою оболонкою в кровоносне русло. При споживанні недоброякісних продуктів і деяких захворюваннях харчового каналу утворюються продукти гниття, які токсично впливають на організм. У товстій кишці людини і тварин мікроорганізми синтезують деякі вітаміни (К, В1, B2, B6, B3, B5, С та ін.).
Проміжний обмін
Він протікає в органах, тканинах, клітинах та інтрацелюлярних структурах. При цьому моносахариди крові використовуються для різних потреб організму – енергетичних, пластичних, захисних та ін. Так, у людини, що вживає їжу рослинного і тваринного походження, 3 – 5% глюкози крові використовується для синтезу глікогену, 30 – 35% – для синтезу ліпідів, 60 – 70% служить джерелом хімічної енергії. Проміжний обмін часто називають: внутрішньотканинним або внутрішньоклітинним обміном. При розщепленні молекули вуглеводу до CO2 і Н2О в тканинах і клітинах утворюється велика кількість інших проміжних продуктів обміну.
Цукор крові. Цукор крові, в основному, представлений глюкозою, частково – фруктозою і глікогеном (табл. 1).
Таблиця 1
