
- •Теоретические основы технологии органического синтеза.
- •Стехиометрические и кинетические уравнения химических реакций.
- •Классификация химических процессов по фазовому признаку. Гомогенное, гетерогенное, гомофазно-гетерогенные, гетерофазно-гомогенные, гомогенно-гомофазные и гетерогенно-гетерофазные процессы.
- •Стационарное и квазистационарное состояние реагирующих веществ. Метод квазистационарных концентраций Боденштейна-Семенова.
- •Определение скорости элементарных реакций.
- •При постоянной температуре скорость химической реакции прямо пропорциональна произведению молярных концентраций реагентов.
- •Определение тепловых эффектов реакций. Уравнение Кирхгоффа.
- •Определение изменений энергии Гиббса для химической реакции.
- •Требования
- •Классификация.
- •Требования безопасности.
- •Цепной механизм и его стадии
- •Элементарные реакции с участием свободных радикалов.
- •Диссипативные структуры в катализе.
- •Требования к катализаторам, применяемым в органической технологии. Текстура катализаторов.
Теоретические основы технологии органического синтеза.
Промежуточные и целевые продукты в технологии органического синтеза.
По применению продукты органической технологии разделяются на:
Промежуточные продукты – это продукты, у которых нет прямого применение в быту, но используются для получения нужных продуктов других экономических отраслей. Например, этилен и пропилен не имеют прямого применение в быту, но нужны для получения полиэтилена и полипропилена.
Целевой продукт – продукты, имеющие прямое применение в быту. Например, бензин, керосин полученные из нефти используются как топливо в двигателях прямого сгорания.
Классификация химических реакций в химической кинетике и химической технологии
Существуют различные типы классификации химических реакций:
1. По характеру системы, в которой протекает реакция, — гомофазные (все компоненты, кроме катализатора, находятся в одной фазе: газофазные, жидкофазные реакции) и гетерофазные (компоненты находятся в двух и более фазах: газ — жидкость, жидкость—жидкость и др.).
2. По зоне протекания химической реакции — гомогенные (осуществляются в объеме какой-либо фазы) и гетерогенные (осуществляются на поверхности раздела фаз).
Понятия «фазовое состояние компонентов» и «зона протекания реакции» неравнозначны. Существуют гомофазные гетерогенные процессы — реакция в газовой фазе на поверхности твердого катализатора и гетерофазные гомогенные процессы, когда реагенты находятся в двух несмешивающихся фазах и их взаимодействие идет только в той фазе, где растворен катализатор (например, взаимодействие изобутилена с формальдегидом в присутствии серной кислоты).
По использованию в ходе реакции катализатора — каталитические и некаталитические. Каталитические реакции, в свою очередь, подразделяются на гомогенно-каталитические (протекающие в той фазе, в которой находится катализатор) и гетерогенно-каталитические (протекающие на поверхности твердого катализатора).
По характеру протекания — простые (одностадийные) и сложные (многостадийные).
Простыми называются реакции, в которых протекает одно необратимое превращение и не образуется иных стабильных продуктов, кроме указанных в уравнении реакции.
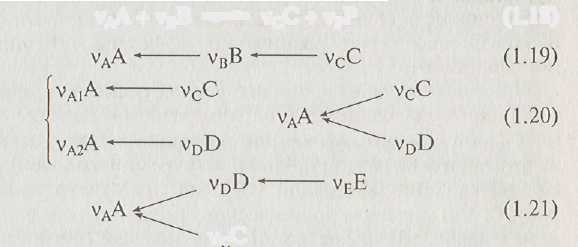
Сложные
реакции состоят из ряда простых реакций,
или макростадий. К ним относятся
обратимые (1.18), последовательные (1.19),
параллельные реакции (1.20) и различные
их сочетания (1.21): vAA+vBB
^^ vcC
+ vPP (1.18)
vcC
5. По механизму протекания — элементарные, протекающие непосредственно при взаимодействии исходных веществ, без видимых микростадий, и неэлементарные, протекающие через ряд микростадий, в которых участвуют промежуточные комплексы или частицы и которых нет в стехиометрическом уравнении, например образование комплекса с катализатором:
А + Кt <=> [Кt] <=С +Кt ■ (1.22)
При этом каждая из промежуточных стадий элементарна, а их сочетание составляет механизм реакции.
Из-за стадий, составляющих механизм, реакции могут быть подразделены следующим образом.
А. По числу частиц, участвующих в элементарной стадии (молекулярности), — на моно-, би-, три молекулярные (последние очень редки и в дальнейшем рассматриваться не будут).
![]()
Например, расщепление молекулы хлора под действием света.
![]()
Мономолекулярными являются реакции изомеризации (перегруппировки) и расщепления. В зависимости от характера расщепления связи различают гомолитические (радикальные) и гетеролитические (ионные) реакции:
Например, диссоциация в воде соли на ионы.
Бимолекулярные элементарные реакции классифицируют по типу разрыва старой и образования новой химической связи и по природе атакующего реагента. Они могут быть нуклеофильными N), электрофильными (Е) и радикальными (R). Каждая из них может быть реакцией замещения (S) или присоединения (Ad).
В нуклеофильных реакциях реагент (нуклеофил) характеризуется повышенной электронной плотностью одного из своих атомов и может быть нейтральной молекулой (Н2О, ROH, RNH2) или отрицательно заряженным ионом (НО-, RO-, NH2, RCOO-).
В молекуле субстрата нуклеофил атакует атом с наименьшей электронной плотностью. Новая связь образуется парой электронов нуклеофила:
![]()
В электрофильных реакциях электрофильный реагент у одного из атомов имеет незаполненную электронную оболочку и является нейтральной молекулой (Cl2, SO3, BH3) или катионом (R+, N02+, С1+). В молекуле органического вещества электрофил атакует атом с наибольшей электронной плотностью. Новая связь образуется электронной парой субстрата:
![]()
П![]() ри
радикальных реакциях атакующая частица
имеет у одного из
атомов неспаренный электрон и является
свободным атомом или
радикалом (С1*, R*,
RCO*).
При атаке органической молекулы новая
связь образуется между неспаренным
электроном радикала и
одним из электронов прежней связи,
другой электрон образует новый
радикал:
ри
радикальных реакциях атакующая частица
имеет у одного из
атомов неспаренный электрон и является
свободным атомом или
радикалом (С1*, R*,
RCO*).
При атаке органической молекулы новая
связь образуется между неспаренным
электроном радикала и
одним из электронов прежней связи,
другой электрон образует новый
радикал:
В. По тепловому эффекту — экзотермические (+Q или -ДН) и эндотермические (-Q или +ДН).
Г. По физическим параметрам проведения — высоко- и низкотемпературные, осуществляемые при нормальном, повышенном, среднем и высоком давлении.
Для исследования ХТП наибольшее значение имеют классификации реакций по фазовому состоянию системы, по наличию катализатора, по механизму протекания и тепловому эффекту, а также по физическим параметрам проведения. Именно от типа химических реакций, подпадающих под эти виды классификации, зависит выбор конструкции аппаратов и параметров ХТП.
