
- •1. Принципиальная схема кэс. Цикл Ренкина.
- •2. Цикл Карно. Термический кпд цикла Карно.
- •Температура t1 (подвода теплоты) ограничена значением критич. Тем-ры 374°с (при более высоких температурах существование влажного пара невозможно).
- •Необходимость использования влажного пара приводит к установке в этой схеме компрессора громосткого и энергоемкого устройства.
- •3. Термодинамические процессы водяного пара, их изображение в диаграммах p-V, t-s, h-s. Определение насыщенного, сухого и перегретого пара, степени сухости пара.
- •4, Цикл и схема парокомпрессионной холодильной установки.
- •5. Схема и цикл теплового насоса.
- •Конденсатор
- •6. Изотермический, изобарный, изохорный, адиабатный и политропный процессы идеального газа. Определения, уравнения, изображения в p-V и t-s диаграммах.
- •7. Формулировка первого закона термодинамики. Аналитическое выражение закона.
- •10. Истечение и дросселирование газов и паров. Скорость движения потока в выходном сечении. Критическая скорость потока. Температура инверсии. Сопло Лаваля.
7. Формулировка первого закона термодинамики. Аналитическое выражение закона.
Закон: Подведенная к телу теплота расходуется на изменение внутренней энергии тела, и на совершение телом внешней работы.
Полная энергия вещества в конце любого процесса всегда равна алгеабрической сумме полной энергии вещества в начале процесса и всех количеств энергии подведенной и отведенной в процессе.
E2=E1+∆E ∆E=Q+L Q=E2-E1+L
Для неподвижных тел, а также в случаях постоянства кинетической и потенциальной энергии вещества равно изменению внутренней энергии вещества. Работа в этом случае представляет только работу расширения L, тогда для любого процесса можно записать:
 Q=U2-U1+L1-2
Q=U2-U1+L1-2
q1-2=u2-u1+l1-2
d q1-2=du1-2+dl1-2
Для тел находящихся в сплошном непрерывном потоке изменение полной эненергии тела равно изменению энтальпии, а также внешних потенциальной и кинетической энергии:

Q1-2=I2-I1+Lтех
q1-2=i2-i1+lтех
dq=di-dlтех
8. Сущность второго закона термодинамики и основные его формулировки.
Закон: все естественные процессы позволяющие вырабатывать необходимые для человека энергию идут всегда в определенном направлении. Направлением от более высокого потенциала до более низкого. Работу в этих процессах можно получать до тех пор, пока не наступит полное равновесие рассматриваемой системы (равенство t, давления).
1 Постулат: (Клазиус) тепло не может переходить от холодного тепла к теплому без компенсации само собой.
2 (Планк) осуществление вечного двигателя второго рода (состоит из одного источника теплоты) невозможно.
3 (Томсон) не возможно получить работу в тепловом двигателе в количестве равном отнятому от горячего источника количества теплоты Q1. для того чтобы получить работу необходимо отвести некоторое количество теплоты Q2 холодному источнику.
L<Q1 всегда
9. Теплоемкость. Истинная и средняя теплоемкость. Уравнение Майера. Определение количества теплоты через среднюю теплоемкость.
Теплоемкость -это количество теплоты, необходимое для нагрева вещества на 1 градус.
Различают:
1) массовую – отнесенную к килограмму вещества С Дж/(кг*К);
2) объемную – отнесенную к одному м3 , при н.у. С ' Дж/(м3·К);
3) мольную – отнесенную к одному киломолю газа Сμ Дж/(кмоль·К).
С= С ' · υо = μС/ μ
υо – уд. объем вещ-ва при н.у.; μ – молярная масса.
Ср - Сv =R – ур-е Майера
μ Ср - μ Сv = μ R=8314 Дж/(кмоль·К) ≈ 2 ккал/(кмоль·К)
Ср- это кол-во теплоты подведенное в изобарном процессе, необход. для нагрева на 1°
Ср.теплоемкость–удельная теплота отнесенная к единице кол-ва вещ-ва
Сm=q1-2/(t1-t2) Дж/кг;Дж/м2
Истиная теплоемкость-опред. как производная от кол-ва теплоты подводимого к телу в процессе его нагрева по температуре этого тела.
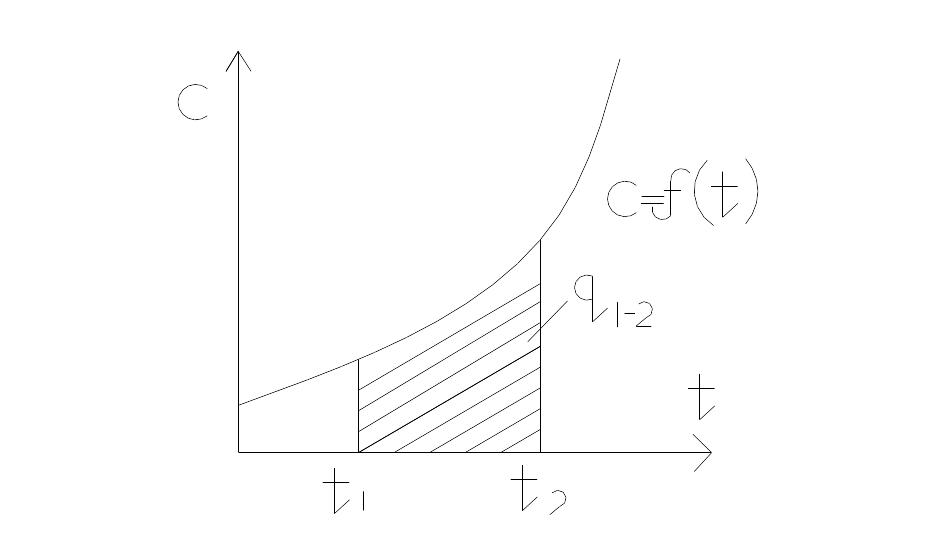
q1-2= t1∫t2 Cdt
Средняя теплоемкость – это теплоемкость вещества в интервале температур
Cmt2t1= (Cm0t2 · t2 - Cm0t1 · t1)/(t2-t1)
