
- •1. Принципиальная схема кэс. Цикл Ренкина.
- •2. Цикл Карно. Термический кпд цикла Карно.
- •Температура t1 (подвода теплоты) ограничена значением критич. Тем-ры 374°с (при более высоких температурах существование влажного пара невозможно).
- •Необходимость использования влажного пара приводит к установке в этой схеме компрессора громосткого и энергоемкого устройства.
- •3. Термодинамические процессы водяного пара, их изображение в диаграммах p-V, t-s, h-s. Определение насыщенного, сухого и перегретого пара, степени сухости пара.
- •4, Цикл и схема парокомпрессионной холодильной установки.
- •5. Схема и цикл теплового насоса.
- •Конденсатор
- •6. Изотермический, изобарный, изохорный, адиабатный и политропный процессы идеального газа. Определения, уравнения, изображения в p-V и t-s диаграммах.
- •7. Формулировка первого закона термодинамики. Аналитическое выражение закона.
- •10. Истечение и дросселирование газов и паров. Скорость движения потока в выходном сечении. Критическая скорость потока. Температура инверсии. Сопло Лаваля.
4, Цикл и схема парокомпрессионной холодильной установки.
 Схема:
Схема:
1- дроссельный вентиль 2- испаритель
3- компрессор 4- конденсатор
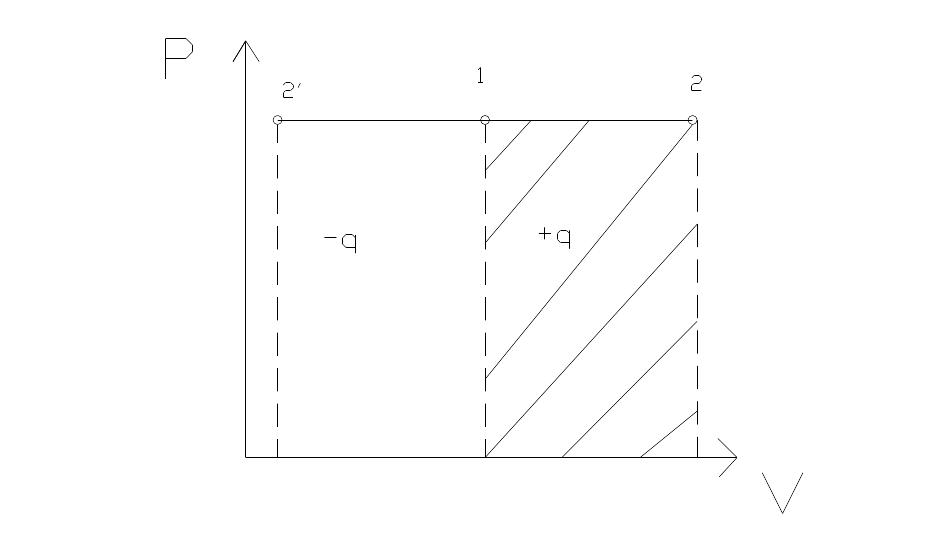
Жидкость с низкой температурой кипения (фреон 12 (-29 °С)) при P1 и T1 направляется в дроссельный вентиль 1, где она дросселируется до давления P2. При выходе из вентиля влажный пар направляется испаритель 2, где жидкость испаряется за счет тепла, отбираемого от охлаждаемых тел. Далее в компрессоре 3 пар высокой степени сухости адиабатно сжимается до P1. Затем пар направляется в конденсатор
Цикл:

1-2- расширение при дросселировании жидкости
2-3- изобарно- изотермический подвод теплоты и хладоагента в испаритель от охлаждаемого объема
3-4- адиабатное сжатие сухого пара в компрессоре
4-1- конденсация пара
5. Схема и цикл теплового насоса.
ТН- устройства предназначенные для эффективного преобразования низкой тепловой энергии природной среды и сбросной t производственной и бытовой деятельности людей на температурный уровень систем отопления и ГВС.
Схема ТН:

испаритель
компрессор
Конденсатор
дроссельный клапан
низкотемпературный источник (НИТ)
в систему отопления
В испаритель поступает НИТ. За счет тепла охлаждения этой воды или воздуха в испарителе происходит процесс парообразования фреонов, пары которого затем поступают в компрессор, где происходит его сжатие и повышение t, затем сжатые пары фреонов конденсируются в конденсаторе, отдавая тепло воде системы отопления или ГВС. Цикл ТН завершается дросселированием фреонов и возвратом его в ГВС.
Коэффициент преобразования- это соотношение полученной потребителем тепловой энергии (Q) к затраченной электроэнергии на привод компрессора (мощность N). КОП=Q/N. Основными параметрами, определяющими КОП, являются t НИТ и воды в системе отопления и ГВС.
Ц икл
ТН
икл
ТН
6. Изотермический, изобарный, изохорный, адиабатный и политропный процессы идеального газа. Определения, уравнения, изображения в p-V и t-s диаграммах.


Изотермическим наз-ся равновесный пр-с протекающий при постоянной температуре.
U2- U1=C2(T2-T1)=0 , т.к. Т=const , т.е. внутренняя энергия не изменяется, и аналогичное выражение первого з-на термодинамики принимает вид:
q=L=v1∫v2PdV= v1∫v2RT/V dV = RT v1∫v2dV/V = RT ln (V2/V1)
Изменение энтропии ΔST=S2 – S1= R·ln V2/V1= R·ln P1/P2
Определить кол-во теплоты, подведенное к рабочему телу при изотермическом процессе, с использованием удельной теплоемкости невозможно, т.к. С=dq/dT. dT=0 и теплоемкость С=±∞.
И зобарный
называется равновесный процесс,
протекающий при постоянном давлении.
зобарный
называется равновесный процесс,
протекающий при постоянном давлении.
Работа изменения объема выражается L= v1∫v2 P dV= P ·(V2-V1)=R(T2-T1)
Количество теплоты в изобарном процессе может быть определено по ур-ю 1-го закона
q= U2-U1+L= Cv(T2-T1)+R(T2-T1)= (Cv+R) · (T2-T1)= Cp· (T2-T1)= h2-h1
Таким образом вся подводимая теплота расходуется на изменение энтальпии газа.
Изменение энтропии при P=const Δ Sp= S2 -S1 =Cp lnT2/T1 T=T1 exp ((S-S1)/ Cp)
Изохорным называется равновесный процесс, протекающий при постоянном объеме.


dq= dU + P dV; dV=0; dq=dU= CvdT=U2-U1= Cv (T2-T1)
Следовательно в изохорном процессе вся подводимая теплота расходуется на изменение внутренней энергии газа, а работа расширения равна 0.
Изменение энтропии равно: ΔSv= S2- S1= Cv ln (T2/T1) T=T1 exp ((S-S1)/ Cv)
Адиабатный наз-ся процесс протекающий без теплообмена м/у термодинамической системой и окружающей средой.
dq=0 dU+PdV=0 dU=Cv dT Cv dT+PdV=0 (1)
PV=RT : PdV+VdP=RdT dT=(PdV+VdP)/R (Cv /R)(PdV+VdP)+PdV=0 (2)
l'/l=k= Cp/ Cv – показатель адиабаты (3); Cv/R из выражения (2) с учетом соотношения (3) с учетом Cp-Cv =R - ур-е Майера → Cv/R=1/(k-1) → тогда (2) преобразуется в dP/P + k dV/V = 0 → PVk = const.
L=-ΔU=-(U2-U1)=U1-U2= -Cv(T2-T1)= Cv (T1-T2)=(R/(k-1)) · (T1-T2) =
= (RT1/(k-1)) · (1–T2/T1)
L=(1/(k-1)) · (P1V1 – P2V2)= (P1V1/(k-1)) · (1-T2/T1)
Энтропия при dq=0 : dS= dq/T=0 S=const

Политропным называется всякий процесс идеального газа в котором теплоемкость является постоянной.
q=Cп(t2-t1) dq=Cпdt= Cpdt - VdP и dq=Cпdt= CVdt +PdV из этих уравнений выразим
(Cп - Cp)/ (Cп - CV) = - (VdP)/(PdV) (Cп - Cp)/ (Cп - CV) = n n·dV/V=-dP/P
Интегрируя полученное соотношение получим n·lg V2/V1 = lg P1/P2 или PVn = const - уравнение политропного процесса
для изохорного процесса n=±∞;изобарного n=0;изотермического n=1 и адиабатного n=k
Поскольку ур-ие политропы отличается от ур-ия адиабаты только величиной показателя n, то ,очевидно, все соотношения между основными параметрами могут быть представлены формулами, аналогичными адиабатному процессу: P2/P1=(V1/V2)n ; T2/T1=(V1/V2)n-1 ; T2/T1=(P2/P1)(n-1)/n
Теплоемкость политропного процесса равна Cп = CV(n-k)/(n-1)
