
- •Пищевая биотехнология
- •Пищевая биотехнология конспект лекций
- •Содержание
- •Уксуснокислые и молочнокислые бактерии и их роль в виноделии
- •Винная цвель (микодерма).
- •Биотехнология производства аминокислот Производство глутаминовой кислоты и глутамата натрия
- •Меры борьбы с производственной инфекцией
- •Список использованной литературы
Винная цвель (микодерма).
Если на поверхности вина в неполно налитом бочонке появилась пленка винной цвели, то ее необходимо немедленно удалить, так как вино после длительного воздействия пленки становится водянистым.
Пленка, разросшаяся на поверхности вина, представляет собой огромное скопление пленчатых дрожжей. По внешнему виду она похожа на плесень, которая появляется на кислой капусте, находящейся в теплом помещении. Рекомендуется вначале убить пленчатые дрожжи, а затем удалить пленку. Для этого в закурник помещают серный фитиль, зажигают его и опускают в шпунтовое отверстие. Последнее плотно прикрывают шпунтом. Если серный фитиль сгорел, то сжигают еще один или два. Если фитили перестанут горсть, значит, кислород в бочонке над пленкой израсходован и пленчатые дрожжи погибнут.
Удалить пленку можно следующим образом. В баллон с вином, на котором образовалась пленка, опускают ниже пленки конец резинового шланга. Затем через другой конец наливают вино. Пленка с вином будет подниматься, и, наконец, когда вино перельется через край, пленка выльется вместе с вином. Для полноты отделения пленки рекомендуется постукивать колотушкой вокруг шпунтового отверстия. Остатки пленки удаляют чистой тряпкой, смоченной в горячей воде с содой, обтирают шпунтовое отверстие и шпунт.
Лекция 6. Хлебопекарное производство. Сущность технологического процесса. Основные микроорганизмы, использующиеся в хлебопекарном производстве. Молокоперерабатывающее производство. Виды продукции молокоперерабатывающей промышленности – молочнокислые напитки, сыр, йогурт, кумыс, шубат. Микроорганизмы, использующиеся в молокоперерабатывающих производствах. Общая характеристика молочнокислых бактерий, лактозосбраживающих дрожжей и смешанных культур микроорганизмов, использующихся в молокоперерабатывающих производствах. Сущность и основные стадии технологического процесса.
Хлебопекарное производство. Сущность технологического процесса
ОСНОВНЫЕ ЭТАПЫ ПРОИЗВОДСТВА ХЛЕБОБУЛОЧНЫХ ИЗДЕЛИЙ
(общая технологическая схема)

Основные этапы процесса производства хлеба.
Процесс производства хлеба слагается из следующих этапов:
- прием и хранение сырья
- подготовка сырья к пуску в производство
- приготовление теста
- разделка теста
- выпечка,
- Хранение выпеченных изделий
-отправка выпеченных изделий в торговую сеть.
Каждый из этих этапов в свою очередь складывается из отдельных, последовательно выполняемых производственных операций и процессов.
Самый начальный этап - прием и хранение сырья. Этап охватывает прием, перемещение в складские помещения и емкости и последующее хранение всех видов основного и дополнительного сырья, поступающего на предприятие. К основному сырью относят муку, воду, дрожжи и соль, а к дополнительному - сахар и другие виды сырья, предусмотренные рецептурой. Для приготовления теста для хлеба формового из муки высшего сорта применяется двухфазный способ, при котором в первую фазу - опару вносится часть муки и воды, а также дрожжи, а во вторую фазу – в тесто или выброженную опару добавляют остаточную часть муки, воды, соли и если предусмотрено рецептурой сахар.
От каждой партии принимаемого сырья, в первую очередь муки и дрожжей, сотрудники лаборатории предприятия отбирают пробы для анализа, проверки соответствия нормативам качества и установления хлебопекарных свойств.
На основании данных анализа отдельных партий муки, имеющихся на хлебозаводе, сотрудники лаборатории устанавливают целесообразную с точки зрения хлебопекарных свойств смесь отдельных партий муки с указанием количественных их соотношений. Смешивание муки осуществляется в мукосмесителях, из которых смесь направляется на контрольный просеиватель и магнитную очистку. Затем смесь поступает в расходный силос, из которого по мере необходимости будет подаваться на приготовление теста. Вода хранится в емкостях - баках холодной и горячей воды, из которых затем направляется на дозаторы воды в соотношениях, обеспечивающих температуру воды, нужную для приготовления теста. Соль - предварительно растворяется в воде, раствор фильтруется, раствор заданной концентрации направляется на приготовление теста. Прессованные дрожжи предварительно измельчаются и в мешалке превращаются в суспензию их в воде. В виде такой суспензии дрожжи используются при приготовлении теста.
Основные микроорганизмы, использующиеся в хлебопекарном производстве.
Дрожжи — микроскопические грибки со своеобразной организацией и циклом развития; составляют особую группу — Saccharomycetes, дрожжевых грибков. Так как они обладают способностью вызывать спиртовое брожение, то они зовутся еще бродильными грибками (Alcoholg ä rungspilze). Способность эта не вполне чужда и некоторым другим грибкам. В мути и осадках, образующихся при брожении сахаристых жидкостей, Дрожжи встречаются обыкновенно в изобилии. Они являются в виде клеток различной величины и формы, то свободных, то соединенных в группы или цепочки на подобие чёток. Образование таких цепочек объясняется способом размножения др. грибков при помощи непрерывного почкования, происходящего следующим образом. В одном или в нескольких местах клетки образуются выпячивания (почки) в виде бугорков или бородавок, мало-помалу разрастающихся и превращающихся в новые клетки, отделяясь перегородкой от произведшей их (материнской) клетки. Но еще до отделения перегородкой молодые клетки могут давать, в свою очередь, почки. В результате получаются ряды (цепочки) клеток. Недавно Э. Ганзен указал на существование у других грибков и настоящего мицелия. Если оставить разводку (культуру) обыкновенных пивных дрожжей (Saccharomyces cerevisiae) в пивном сусле стоять более или менее продолжительное время (несколько недель) в полном покое, то на поверхности жидкости образуется плёнка (Kahmhaut). В этой-то пленке и попадаются ряды вытянутых в длину др. клеток — своего рода рудиментарный мицелий. Образование пленок дает хорошие признаки для отличения различных дрожжей друг от друга.
Хлебопекарные дрожжи являются биологическими разрыхлителями и им принадлежит ведущая роль в формировании качества хлеба. Их главная функция обусловлена самим составом дрожжей, которые на 44-75% состоят из белков, на 30-50% - из углеводов, и на 5-10% - из минеральных неорганических веществ, на 5-12% - из азота. Так что, будучи особыми белками дрожжи прежде всего обладают всеми их свойствами. При этом содержание витаминов (витамины группы В - В1, В2, В6; РР- никотиновая кислота, биотин, фоливоевая и пара-аминобензойная кислоты, пантеонат кальция, инозит и др.) в дрожжах во много раз больше чем в овощах, молоке или плодах. Особенно много витаминов содержится в сухих дрожжах, так как процесс удаления влаги при сушке и обработка их ультрафиолетом не сказывается на качественном и количественном состоянии витаминов, а наоборот, способствует их сохранению. Количество витаминов, синтезируемыми отдельными видами и штаммами дрожжей варьируются в широких пределах и на сдвиги накопления витаминов особенное влияние оказывает характер источника углерода в питательной среде и при выращивании дрожжей на средах, содержащих витамины, увеличивается и их содержание в готовых дрожжах за счет адсорбции их из среды. Наличие в дрожжах большой группы витаминов стимулирует не только витаминные, но и ферментативные свойства дрожжей, так как являясь белками дрожжи сохраняют все их свойства.
Хлебопекарные дрожжи относятся к определенному штамму дрожжей Сахаромицетов, выращиваются размножением чистой культуры этих грибов в определенной питательной среде – мелассе, которая является отходом свекловично-сахарного производства или же из отходов спиртовых заводов, путем выделения отработанных дрожжей из мелассы – спиртовой бражки. Меласса – темная густая жидкость, в которой содержатся сахароза, азотистые и минеральные вещества. Процесс производства хлебопекарных прессованных дрожжей включает несколько технологических операций: приготовление питательной среды, выращивание дрожжей периодическим или непрерывно-поточным методом в ферментерах при аэрировании, сепарирование, формовку, прессование и упаковку. Эта смена условий для жизнедеятельности обусловливает те разнообразные свойства, которыми должны обладать хлебопекарные дрожжи. Влажность отечественных прессованных дрожжей довольно высока – 75%, что влияет на длительность их хранения. Сушенные хлебопекарные дрожжи получают из готовых прессованных дрожжей определенной рассы Сахаромицетов и для стабилизации биологической активности сухих дрожжей в прессе сушки их обрабатывают специальными пластификаторами (смеси растительных масел с жирными кислотами, моноэфирами) или антиоксидантами, которые эмульгируют с растительным маслом. Важное значение имеет не только длительное сохранение ферментативной активности сушеных дрожжей, но и ее восстановление после регидратации. Для нее применяют различные вещества: глюкозу, аскорбиновую кислоту, бромат калия, эфиры глицерина и насыщенных жирных кислот и другие, которые добавляют в воду в разной последовательности. Готовые дрожжи должны обладать высокой потенциальной активностью гликолитичесих ферментов (зимазная активность – скорость сбраживания глюкозы, фруктозы и сахарозы; мальтазная активность – скорость сбраживания основного сахара теста мальтозы), и гидролитических ферментов, а так же способность расти и синтезировать ферменты и коферменты в достаточно анаэробных условиях и быстро адаптироваться к изменяющимся средам. Должны проявлять осмотическую стабильность по отношению к жирам и относительно высокой концентрации сахаров, быть солеустойчивыми и стойкими к изменениям рН среды, содержать небольшое количество глютатиона, играющего роль восстанавливающего агента и оказывающего разжижающее действие на клейковину теста, быть устойчивы к примесям и стойкими при хранении.
Дрожи Saccharomyces cereviziae – это не патогенные одноклеточные микроорганизмы с диаметром клетки примерно 5 мкм, которые во многих отношениях представляют собой эукариотический аналог E. Coli. Их генетика, молекулярная биология и метаболизм детально изучены. Saccharomyces cereviziae размножаются почкованием и хорошо растут на обогащённых питательных средах, содержащих аминокислоты, витамины, соли, микроэлементы и источники углерода. Их способность к превращению сахара в этанол и углекислый газ издавна пользовалась для изготовления алкогольных напитков и хлеба. В хлебопечении применяют прессованные, сушеные и жидкие дрожжи и дрожжевое молоко. К этому виду относятся расы дрожжей, используемые в хлебопечении, спиртовом производстве, пивоварении, виноделии, производстве кваса.
В пищевой промышленности дрожжи, не принадлежащие к сахаромицетам, играют, как правило, отрицательную роль, нарушая ход технологического процесса и вызывая порчу сырья и готовой продукции.
Молокоперерабатывающее производство. Виды продукции молокоперерабатывающей промышленности – молочнокислые напитки, сыр, йогурт, кумыс, шубат. Сущность и основные стадии технологического процесса
Кисломолочные продукты играют большую роль в питании человека, так как, кроме пищевой ценности, они имеют диетическое, а некоторые – лечебное значение. Кисломолочные продукты усваиваются лучше, чем цельное молоко, и значительно быстрее. По сравнению с молоком кисломолочные продукты обладают повышенной стойкостью при хранении. Они являются кроме того, неблагоприятной средой для развития многих патогенных бактерий. Это обусловлено их повышенной кислотностью и содержанием антибиотических веществ, вырабатываемых некоторыми молочнокислыми бактериями. Установлено экспериментально, что виды молочнокислых стрептококков, применяемые в заквасках, оказывают антагонистическое действие на возбудителя стафилококковой интоксикации. Качество и специфические свойства кисломолочных продуктов во многим зависят от направленности и интенсивности протекающих при их выработке микробиологических процессов. Решающее значение имеет нормальное течение молочнокислого брожения.
Приготовление простокваши в домашних условиях (без специального заквашивания) основано не естественном (самопроизвольно возникающем) сквашивании молока в результате деятельности находящихся в нем бактерий. Нередко такая простокваша имеет различные дефекты (горечь, неприятный запах и др.). В условиях промышленной переработки молока при изготовлении различных кисломолочных продуктов его предварительно пастеризуют, а затем заквашивают специально подобранными заквасками из чистых или смешанных культур молочнокислых бактерий. Применение заквасок микроорганизмов с известной биохимической активностью позволяет получить продукт с определенными химическими и органолептическими свойствами, избежать развития случайных микроорганизмов, нарушающих нормальное течение молочнокислого брожения (что бывает при самопроизвольном сквашивании молока), и обеспечивает высокое качество готовой продукции. Режим технологического процесса должен быть тесно увязан со свойствами заквасочной микрофлоры. Большое значение имеет активность используемой закваски и качество перерабатываемого молока. Иногда происходит замедленное сквашивание молока вследствие пониженного содержания в нем сухих веществ, витаминов, наличия антибиотиков, используемых при лечении коров. Потеря активности закваски может быть обусловлена наличием в молоке бактериофага. Имеет значение и состав остаточной микрофлоры пастеризованного молока. Между ее компонентами и заквасочными микроорганизмами могут возникать различные взаимоотношения, стимулирующие или тормозящие развитие полезной микрофлоры. При ослаблении молочнокислого процесса создаются условия для развития незаквасочной микрофлоры, что приводит к появлению различных дефектов готового продукта. В состав закваски для изготовления простокваши обыкновенной, сметаны и творога входят мезофильные гомоферментативные молочнокислые стрептококки и ароматобразующие стрептококки.
При изготовлении творога, кроме закваски, применяют сычужный фермент, который активизирует процесс. Иногда творог вырабатывают из непосредственного молока. Такой творог предназначен лишь для изготовления изделий, подвергающихся перед употреблением термической обработке в связи с возможным размножением в нем возбудителей пищевой интоксикации – стафилококков, находящихся обычно в сыром молоке. Ацидофильное молоко ацидофильную пасту готовят на закваске ацидофильной палочки в определенном соотношении слизистых и не слизистых рас. Для ацидофилина применяют смесь трех заквасок: закваски ацидофильной палочки, закваски для творога и кефирной закваски в соотношении 1:1:1. Ацидофильные продукты имеют лечебное значение. Ацидофильная палочка способна вырабатывать антибиотические вещества, подавляющие развитие многих гнилостных бактерий и возбудителей кишечных инфекции.
При выработке кефира используют не чистые культуры микроорганизмов, а естественную симбиотическую грибковую закваску – пастеризованное молоко, сквашенное так называемым кефирным грибом. Микрофлора его разнообразна и полностью не установлена. Кефирный грибок имеет неправильную форму, складчатую или бугристую поверхность, упругую консистенцию. Размер его от 1-2 мм до 3-6 см и более. При микрокопировании в грибке наблюдается тесное переплетение палочковидных бактерий, которые образуют как бы остов (строму), удерживающий в себе остальные микроорганизмы. Эта бактерия является, по-видимому, гетероферментативной молочнокислой палочкой, принимающей участие в процессе сквашивания кефира. Основная роль в процессе сквашивания и созревания кефира принадлежит мезофильным гомо- и гетероферментативным молочнокислым стрептококкам и дрожжам. Некоторое значение имеют термофильные молочнокислые палочки и уксуснокислые бактерии. Последние, как и дрожжи, повышают активность молочнокислых бактерий. Кефир является, таким образом, продуктом комбинированного брожения: молочнокислого и спиртового. Содержание спирта может быть до 0,2-0,6% (в зависимости от длительности созревания). Образующийся углекислый газ придает продукту освежающий вкус. Выпускаемый промышленностью кефир массового потребления содержит алкоголя очень мало – сотые доли процента. В кефире иногда появляются запах сероводорода. Причина этого дефекта окончательно не выяснена. Возбудителем его, по-видимому, являются гнилостные бактерии. Нередко, в сгустке кефира образуются «глазки». Их образование связано с излишним развитием дрожжей и ароматобразующих бактерий – компонентов кефирного грибка.
Кумыс готовят из кобыльевого молока. Приготовление кумыса как и кефира, основано на молочнокислом и спиртовом брожениях. Кобылье молоко отличается от коровьего более высоким содержанием лактозы, растворенных азотистых соединений и витаминов, особенно витамина С, но в нем меньше жира. При сквашивании кобыльего молока казеина выпадает в виде очень мелких хлопьев. В состав закваски входят термофильные молочнокислые бактерии (болгарская и ацидофильная палочки) и дрожжи, сбраживающие лактозу и обладающие антиобитической активностью. Спиртовое брожение протекает активно; количество спирта достигает 2-2,5 %. В настоящее время готовят кумыс и из коровьего молока. В зависимости от продолжительности сквашивании и степени созревания получают кумыс разной степени кислотности и с различным содержанием спирта. В состав закваски для ряженки входят термофильный молочнокислый стрептококк и в небольшом количестве болгарская палочка. Ряженка вырабатывается из смеси молока и сливок. Смесь перед заквашиванием нагревается до 95оС в течение 2-3 ч, в результате чего она приобретает цвет и вкус топленного молока.
Основные этапы технологии изготовления сыра
Нормализация молока для сыроделия (стандартизация)
Регулирование состава молока уже достаточно давно осуществляют путем добавления в него обезжиренного молока или удаления части сливок.
Гомогенизация молока
Гомогенизированное молоко имеет непрочные агрегаты белковых мицелл, которые трудно встраиваются в структуру сырного сгустка, способствуя удержанию сгустком избыточной влаги, поэтому молоко для производства сыра обычно не гомогенизируют.
Тепловая обработка молока
Тепловая обработка молока для производства сыра направлена на стандартизацию его биологического качества путем уничтожения нежелательных бактерий и инактивирования некоторых ферментов. В процессе тепловой обработки погибает также большинство важных для производства сыра бактерий (например, молочнокислые бактерии) и разрушаются некоторые нативные ферменты молока (например, липазы). Температура и продолжительность тепловой обработки молока выбираются в зависимости от желаемого результата. К сожалению, при тепловой обработке погибают некоторые группы бактерий нормальной микрофлоры молока, которые вырабатывают систему ферментов, способствующих появлению вкуса и запаха сыра, не производимых обычными заквасками. Некоторые заквасочные культуры (Lactococcus lactis sub. sp. lactis bioy; diacetylactis и Leuconostoc mesentemides sub. sp. cremoris) обеспечивают образование вкусовых веществ, в том числе диацетила. В настоящее время разрабатываются производственные культуры, которые отвечают за синтез дополнительных вкусовых компонентов.
Внесение закваски
После тепловой обработки молоко обычно охлаждают приблизительно до температуры 30 °С (точная температура зависит от рецептуры сыра). Температура важна для роста инокулированных заквасочных бактерий и дальнейшего процесса коагуляции: осуществляемой при использовании молокосвертывающих ферментов.
Красители и другие добавки
Перед созреванием или когда температура молока достигает уровня, необходимого для сычужного свертывания (29-30 0С), в него добавляют (в соответствии с рецептурой) красители и другие некоторые химические препараты (нитрат натрия или хлорид кальция).
Внесение сычуга (сычужного фермента)
Процедура тестирования молока на способность к сычужному свертыванию значительно отличается у разных производителей. В большинстве случаев в рецептуре указан уровень кислотности или рН, при котором добавляют сычужный фермента, так как от этого зависит тип сгустка и скорость образования коагулята. Используя молоко постоянного известного состава и определенный набор культур прямого внесения, можно точно определить момент его готовности к свертыванию.
Количество фермента и температура, при которой осуществляется сычужное свертывание, зависят от рецептуры конкретного сыра, типа фермента и состава молока.
Коагуляция (образование сгустка)
Коагуляция (свертывание) молока проходит в две стадии. На первой стадии, которая практически не зависит от температуры, происходит разрыв полипептидной цепи к-казеина между 105 и 106 аминокислотными остатками (фенилаланином и метионином). Это расщепление приводит к образованию пара-к-казеина и макропептида. Расщепление может происходить при низких температурах (< 10 °С), хотя на практике эта температура обычно выше.
Разрезка сгустка (постановка зерна)
Коагулят готов к разрезанию по прошествии периода от 25 мин до 2 ч в соответствий с рецептурой. Единого мнения относительно определения момента начала разрезания сгустка, следовательно, получения нужных параметров, не существует.
Вымешивание, второе нагревание и формование сырной массы
После первичного разрезания сырная масса остается мягкой, а покрывающая сырное зерно оболочка находится в несвязном состоянии. Перед стеканием сыворотки для предотвращения излишнего крошения, потерь жира и сырной пыли необходимо медленное вымешивание зерна. Когда оболочка зерна начнет приобретать более выраженные свойства мембраны, скорость перемешивания можно увеличить. Процесс второго нагревания способствует обезвоживанию белковой матрицы, в результате чего сырное зерно становится более плотным, упругим, круглым и выделяет больше сыворотки. Повышение температуры ускоряет метаболизм бактерий, находящихся внутри зерна. Количество молочной кислоты возрастает, рН понижается, что способствует сжатию частиц и выделению сыворотки.
Сыр с «промывкой» сырного зерна
Добавление воды в смесь сырного зерна и сыворотки приводит к удалению из сырной массы лактозы и прочих растворимых компонентов, а также к повторному впитыванию влаги. Горячая вода плавит сырное зерно и вытесняет из него влагу. Такое воздействие направлено на поддержание высокого рН, так как активность молочнокислых бактерий снижается вследствие сокращения количества лактозы.
Посолка сыра
Целью посолки является придание сыру определенного вкуса и регулирование микробиологических и ферментативных процессов во время созревания.
Время посолки колеблется от 15 мин до 5 сут в зависимости от размера и типа сыра.Обычно содержание соли в сыре составляет 1,5-2,5%, но в некоторых видах сыров оно может отличаться (эмменталь может содержать 0,6% соли, пекорино — 5-7%). Используют также посолку сухой солью, при этом соль втирают в поверхность сыра по окончании прессования, и она в течение нескольких дней медленно проникает внутрь сырного теста. Обычно используют соль в форме стандартных кристаллов, реже — в мелкоизмельченном виде, как при изготовлении масла.
Прессование сыра
Прессование сыра является одной из самых сложных технологических операций; производителей. Главной целью прессования является преобразование неплотных частиц сгустка в монолит, а также вытеснение свободной сыворотки.
Технология приготовления йогурта
Производство йогурта осуществляется двумя способами – термостатным и резервуарным (по приведенной ниже схеме). Эти два способа имеют оряд общих технологических операций.
Подготовка сырья
Нормализация
Очистка
Пастеризация
Гомогенизация
Охлаждение
Заквашивание
Резервуарный способ Термостатный способ
Сквашивание молока в резервуарах Розлив в бутылки и пакеты
Охлаждение в резервуарах или в потоке Сквашивание в термостатной
камере
Созревание Охлаждение в хладостатной
камере
Розлив в бутылки и пакеты Созревание
Хранение
Реализация
Подготовка сырья. Для производства используется молоко 1 сорта, с кислотностью не выше 20 Т, по редуктазной пробе – не ниже 1-го класса и по механической загрязненности – не ниже первой группы. Может быть использовано частично или полностью восстановленное молоко из целоного молока распылительной сушки высокой растворимости. Нормализация молока по жиру. Для большинства йогуртов содержание жира должно быть не менее 6%. Расчет потребного для нормализации обезжиренного молока или сливок ведут по формулам материального баланса если нормализация осуществляется путем смещивания цельного молока с обезжиренным или со сливками.
Тепловая обработка. Пастеризацию молока проводят при температуре
85-87 С с выдержкой в течение 5-10 мин или при 90-92 С с выдеожкой 2-3 мин.
Гомогенизация молока. Тепловая обработка молока обычно сочетается с гомогенизацией. Гомогенизация при температуре не ниже 55 С и давлении 17,5 МПа улучшает консистенцию и предупреждает отделение сыворотки. При производстве резервуарным способом гомогенизацию следует считать обязательной технологической операцией.
Охлаждение молока. Пастеризованное и гомогенизированное молоко немедленно охлаждают в регенеративной секции пастеризационной установки до температуры заквашивания его чистыми культурами молочнокислых бактерий: при использовании термофильных культур – до 50-55 С.
Заквашивание молока. В охлажденное до температуры заквашивания
молоко должна быть немедленно внесена закваска, соответствующая виду вырабатываемого продукта. Закваску перед внесением в молоко тщательно перемешивают до получения жидкой однородной консистенции, затем вливают в молоко при постоянном перемешивании. Наиболее рационально вносить закваску в молоко в потоке. Для этого закваска через дозатор подается непрерывно в молокопровод, в смесителе она хорошо смешивается с молоком.
Сквашивание молока. Сквашивание молока производят при определенной температуре, в зависимости от вида закваски. При использовании заквасок, приготовленных на чистых культурах молочнокислого стрептококка термофильных рас – 2,5-3 ч.
Охлаждение. По достижении требуемой кислотности и образовании сгустка йогурт немедленно охлаждают – при резервуарном способе производства в универсальных резервуарах или в пластинчатых охладителях до температуры не выше 8 С, а затем разливаются в бутылки. При обычном способе производства сквашенное молоко в мелкой таре по достижении определенной кислотности перемещают в хладостаты, где оно охлаждается.
Производство творога кислотно-сычужным способом
При этом способе выработки творога сгусток образуется не только в результате молочнокислого брожения, но и при помощи вносимого сычужного фермента.
Для производства творога используют доброкачественное свежее молоко без пороков. Нормализованное молоко очищают от механических примесей и направляют на пастеризацию. Пастеризованное молоко охлаждают до температуры заквашивания и направляют в специальные ванны для выработки творога. Для удобства выгрузки из них сгустка ванны монтируются на площадке.Для заквашивания молока применяют закваску, приготовленную на чистых культурах мезофильного молочнокислого стрептококка. После внесения закваски молоко тщательно перемешивают.
Схема производства творога кислотно-сычужным способом:
1 — резервуар для нормализованного молока; 2 — насос; 3 — промежуточный бак; 4 — пластинчатый пастеризационный аппарат; 5 — сепаратор-молокоочиститель: 6— ванна для творожного сгустка; 7 — пресс-тележка; 8—охладитель для творога; 9 — расфасовочно-упаковочный автомат; 10 — камера хранения. |
Сычужный фермент вносят не одновременно с закваской, а лишь после некоторой выдержки заквашенного молока. Заквашенное молоко выдерживают до достижения в нем кислотности 32-35°Т. После этого в него вносят раствор хлористого кальция с целью восстановления способности пастеризованного молока образовывать под действием сычужного фермента плотный, хорошо отделяющий сыворотку сгусток. В тщательно перемешанное молоко вносят раствор сычужного фермента. После этого молоко тщательно перемешивают и оставляют в покое для образования сгустка. Продолжительность сквашивания молока при правильном ведении технологического процесса с применением закваски на мезофильных культурах составляет 6—8 ч, при ускоренном методе 4—4,5 ч. Из полученного сгустка при производстве творога удаляют влагу (сыворотку вместе с растворенными в ней сухими веществами - лактозой, минеральными солями, сывороточными белками и др.). Для ускорения выделения сыворотки сгусток разрезают на небольшие части, что значительно увеличивает его поверхность, открывает много капилляров и пор, а также сокращает путь прохождения сыворотки до поверхности. С этой целью сгусток в момент готовности разрезают на кубики и оставляют в покое на некоторое время. За это время из нарушенного сгустка интенсивно выделяется сыворотка, кубики несколько уплотняются и одновременно в них нарастает кислотность. Отделившуюся за время выдержки сыворотку удаляют из ванны сифоном или выпускают через штуцер. Частично освобожденный от сыворотки сгусток выгружают из ванны и направляют на самопрессование. Для облегчения выделения сыворотки самопрессование и прессование сгустка происходит небольшими порциями, помещенными в прочные мешки. Мешки завязывают и укладывают в несколько рядов в пресс-тележку, где под собственной тяжестью происходит выделение из сгустка сыворотки. По окончании самопрессования мешки со сгустком равномерно раскладывают на перфорированное дно тележки в несколько рядов, опускают на них плиту и прессуют творог до готовности. Для ускорения выделения сыворотки мешки в пресс-тележке в ходе прессования встряхивают и перекладывают (верхние мешки перемещать вниз, а нижние — наверх). Во избежание нарастания кислотности прессование следует проводить не в производственном цехе, а в помещениях с температурой воздуха не выше 8°С. Для этого пресс-тележки перевозят из цеха в специальные камеры. Окончание прессования определяют по содержанию влаги в твороге. Весь процесс удаления сыворотки из сгустка, разлитого в мешки, продолжается не менее трех часов. После окончания прессования творог немедленно охлаждают до 6—8° С для предотвращения нарастания в нем кислотности. Для охлаждения творога на молочных заводах применяют охладители Локтюхова, ротационные барабаны, в которых происходит прессование и охлаждение творога, а также более совершенные двухцилиндровые охладители ОТД. На предприятиях с небольшим объемом производства творога после прессования его в тех же самых мешках помещают в холодильные камеры. Готовый творог расфасовывают в крупную и мелкую тару. Технология выработки творога кислотно-сычужным способом имеет ряд серьезных недостатков и основательно тормозит рост его производства. Весь процесс его выработки очень длителен и занимает не менее 11 ч. Операции по удалению сыворотки из сгустка занимают не только много времени, но и требуют большой затраты ручного труда, что влечет за собой снижение производительности труда. С сывороткой из сгустка уходит значительное количество жира.
Производство обезжиренного творога кислотным способом
Обезжиренный творог, как правило, вырабатывают кислотным способом. Производство его организовано не только на молочных заводах, но и на предприятиях низовой сети и осуществляется па том же оборудовании, на котором изготовляют жирный творог кислотно-сычужным способом. Обезжиренное молоко, идущее на выработку творога, должно быть свежим, доброкачественным и иметь кислотность не выше 21° Т. Его пастеризуют, охлаждают до температуры заквашивания и направляют в ванны. При тщательном вымешивании в обезжиренное молоко вносят закваску и оставляют в спокойном состоянии для образования сгустка. Для ускорения отделения сыворотки сгусток разрезают в горизонтальном и вертикальном направлении ножами на кубики с размером по ребру 20 мм и оставляют после этого в покое на 10—15 мин. Процесс синерезиса ускоряется при повышении температуры, что вызывает более сильное стягивание белкового сгустка и более интенсивное выделение из него сыворотки. Поэтому разрезанный сгусток нагревают (отваривают) до 36—38° С. В этом случае при производстве творога в двухстенных ваннах в их межстенное пространство подают горячую воду. Для равномерного нагревания всей массы сгусток осторожно перемешивается. Если творог вырабатывают в одностенных ваннах, то для нагревания к нему добавляют горячую сыворотку с температурой 60—65° С. При повышенной кислотности сгустка его подогрев лучше осуществлять кипяченой горячей водой. Приливать в ванну горячую сыворотку или воду следует постепенно при помешивании, чтобы избежать местного перегрева сгустка. Перегрев сгустка способствует образованию сухой и грубой консистенции творога. Недостаточный подогрев сгустка замедляет отделение сыворотки, что может вызвать нарастание кислотности и также отрицательно сказывается на качестве продукта. После достижения указанной температуры нагрев прекращают, сгусток оставляют в покое на 10—15 мин для лучшего обезвоживания. Затем удаляется часть сыворотки и сгусток разливают в мешки. Кислотность его перед розливом должна быть 80—85° Т. Самопрессование и прессование сгустка происходит в пресс-тележках точно так же, как и при выработке жирного творога кислотно-сычужным способом. Обезжиренный творог используется в основном как сырье в производстве плавленых сыров и поэтому расфасовывается в крупную тару.
Кефир. Для получения кефира молоко раньше засеивали «кефирными зернами» (закваска для получения кефира из коровьего молока. Естественно сложившееся сообщество микроорганизмов Lactobacillus lactis, Lactobacillus plantarum и дрожжи Torulopsis kefir) (кефирные грибки), содержащими Lactobacillus casei (используется для получения твердых сыров (на стадии созревания). Кроме того, Lactobacillus casei используют для получения молочной кислоты сбраживанием сыворотки или молока) и Saccharomyces cerevisiae (дрожжи, способные к активному сбраживанию. Имеют специфические и овальные клетки, размножаются почкованием. Применяют при производстве вина, пива, хлеба) и некоторые другие молочнокислые бактерии. Сейчас используют специальные закваски (взвесь дрожжей или бактерий, иногда с добавочным количеством питательных веществ, которую вводят в основной продукт для его заквашивания).
Простокваша обыкновенная. Простоквашу получают заквашиванием молока смесью из стрептококков, кавказской палочки ([Lactobacillus caucasicus] – (другое название Lactobacillus bulgaricus) – бактерии, вызывающая молочнокислое брожение. Применяется для получения йогуртов) и молочнокислых дрожжей (дрожжи, участвующие в сбраживании молока совместно с бактериями. Фаза развития дрожжей начинается после того, как молочнокислые бактерии значительно снижают кислотность молока, что делает его пригодным для развития дрожжей. Например, в образовании кумыса принимают участие дрожжи Saccharomyces lactis и Saccharomyces cartilaqinosus). Дрожжи используют молочную кислоту, уменьшая кислотность продукта, и выделяют углекислоту и небольшие количества спирта.
Сметана. Для изготовления сметаны сливки сквашиваются молочнокислыми бактериями Lactobacillus lactis, L. cremoris, L. diacetylactis. Добавление к ним культуры лейконосток (Leuconostoc (род бактерий) – аэробные грамположительные кокки. Энергию получают за счет молочнокислого брожения, не содержат геминовых пигментов, аэротолерантны. Принимают участие в заквашивании капусты (на начальных этапах). При использовании синтетической питательной среды в нее необходимо добавлять витамины и аминокислоты) (Leuconostoc citrovarum (аэробные грамположительные молочнокислые кокки, широко используются в производстве молочнокислых продуктов) и Leuconostoc dextranicum (на средах с сахарозой образуют в большом количестве слизь декстран (глюкан) за счет выделения экзофермента декстраназы) приводит к ароматизации сметаны.
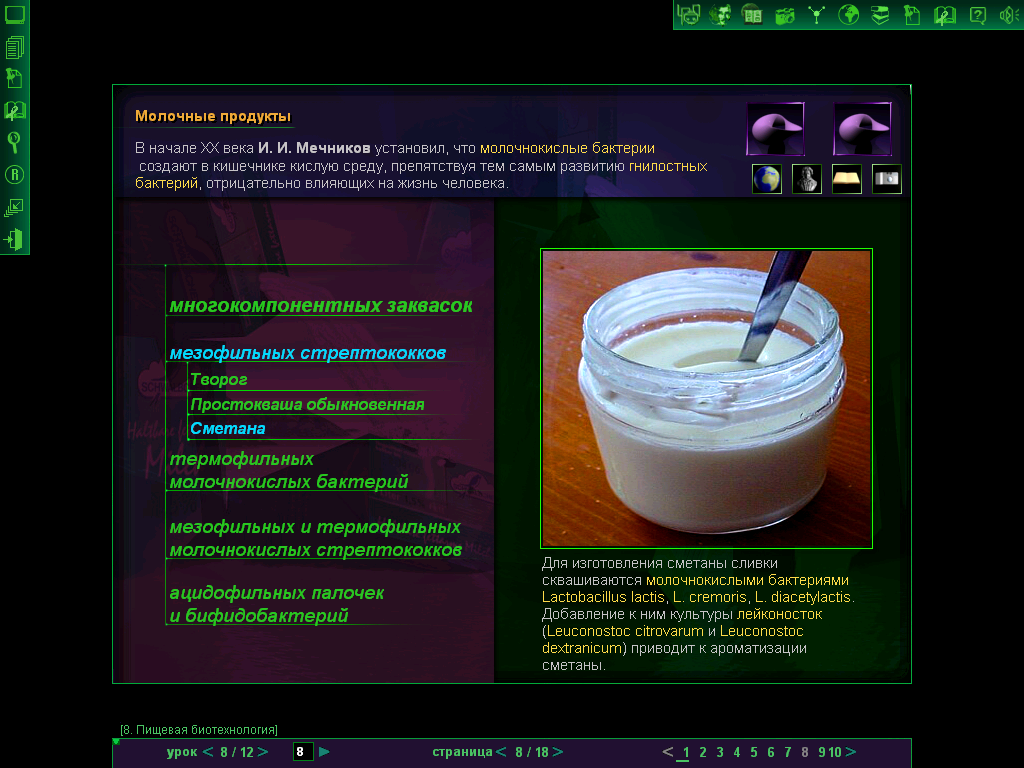
Ряженка. Чтобы получить ряженку, сначала производят топление молока (прогревание молока в течении длительного времени при высокой температуре (но не доводя до кипения), так, что постепенно карамелизуется часть сахаров и образуется твердая корочка на поверхности) повышенной жирности (6-8%) при 92-95ºС. После охлаждения вносят закваску молочнокислого стрептококка (Streptococcus thermoacidophillus – лактобациллы, вызывающие свертывание казеина молока при приготовлении молочнокислых продуктов. Характерное свойство вида – способность расти при повышенных температурах 45-400ºС).
Варенец. Для получения варенца производят топление молока обычной жирности (3,2%) при 92-95ºС. После охлаждения в молоко вносят закваску термофильного молочнокислого стрептококка и болгарскую палочку в соотношении к стрептококку от 1:4 до 1:10.
Общая характеристика молочнокислых бактерий, лактозосбраживающих дрожжей и смешанных культур микроорганизмов, использующихся в молокоперерабатывающих производствах.
Различные процессы ферментации молока проводят сегодня в контролируемых условиях, В течение многих прошедших тысячелетий они осуществлялись при участии бактерий, исходного присутствующих в молоке. В наше время для этого используют разнообразные закваски, позволяющие получать молочные продукты нужного качества и типа. Применяющиеся при этом культуры живых бактерий могут представлять либо один какой-то штамм Определенного вида (культуры моноштаммов), либо несколько штаммов и/или видов (моноштаммов или смешанные культуры). Коммерческие культуры - закваски состоят из бактерий, образующих молочную кислоту и пахучие вещества. В табл. 3.2 перечислены некоторые виды бактерий, используемые при производстве молочных продуктов методом ферментации, и указана их роль в этих процессах, а также продукты,. получаемые с их помощью. Выбор и состав используемых комбинаций из этих штаммов и видов бактерий определяются желаемыми свойствами и условиями получения продуктов, например скоростью образования молочной кислоты. Последующие разделы посвящены разнообразным молочным продуктам, вырабатываемым путем ферментации, рассмотрению способов их производства и возможных путей их усовершенствования.
Таблица 1 - Функциональная роль некоторых бактерий, используемых при переработке молока
Культура |
Функция |
Использование |
Propionibacterium P. shermanii Р. реtersonii |
Формирование вкуса, образование глазков |
Производство швейцарского сыра |
Lactobacillus L. casei L. helveticus L. lactis |
Образование кислоты |
Созревание, закваска для швейцарского сыра, производство сыров типа швейцарского. |
Leuconostoc L. dextranicum L. citrovorum |
Образование вкусовых веществ из лимонной кислоты (главным образом диацетила) |
Производство сметаны, сливочного масла, заквасок |
Streptococcus S. thermophilus S. lactis S. cremoris |
Образование кислоты |
Производство йогурта и швейцарского сыра, закваски для сыров |
Общая характеристика молочнокислых бактерий
Молочнокислые бактерии играют решающую роль в технологии молока, так как они сбраживают молочный сахар до молочной кислоты, что приводит к снижению рН и затем к свертыванию казеина и к подавлению чувствительных к кислоте микробов. Молочнокислые бактерии относятся к семейству Lactobacillaceae, которое включает три рода: Streptococcus, Leuconostoc и Lactobacillus. Бактерии рода Lactobacillus для углеводного обмена не нуждаются в лактозе. Они сами не синтезируют витамины и аминокислоты и поэтому не встречаются ни в почве, ни в воде. Естественная среда обитания этих бактерий — растения и растительные остатки. Они встречаются также в кишечнике, на коже и на слизистых оболочках человека и животных. Молоко для Lactobacillaceae является самой оптимальной средой. Сферы применения некоторых молочнокислых бактерий представлены в таблице.
Род стрептококков. Виды рода Streptococcus являются гомоферментативными, то есть они сбраживают более 90% сахара в молочную кислоту и лишь
незначительную его часть — в уксусную кислоту и спирт. В роде сапрофитных молочнокислых стрептококков различают несколько групп.
Группа молочных бактерий: Streptococcus lactis, Streptococcus cremoris, Streptococcus diacetylactis. Группа Viridans:
Streptococcus thermophilus. Группа энтерококков: Streptococcus faecalis var. faecalis, Streptococcus faecalis var. liquefaciens, Streptococcus faecalis var. zymogenes, Streptococcus faecium, (Streptococcus durans), Streptococcus bovis, патогенные стрептококки (Streptococcus agalactiae и др.).
Таблица 2 – Области применения молочнокислых бактерий.
Микроорганизмы
|
Область применения |
Streptococcus thermophilus |
Йогурт, кисломолочные напитки, кисломолочный творог, эмментальский сыр, свежий сыр |
Lactobacillus bulgaricus |
Йогурт, эмментальский сыр, другие твердые сыры, кисломолочный творог |
Lactobacillus lactis |
Эмментальский сыр, другие твердые сыры, кисломолочный творог |
Lactobacillus helveticus |
Эмментальский сыр |
Lactobacillus acidophilus |
Ацидофильное молоко, биогурт и другие напитки |
Streptococcus lactis. Он является первым микроорганизмом, который выделен в чистой культуре (в 1873 году Листером). Streptococcus lactis встречается на растениях.С пылью и растительными частицами попадает на доильное оборудование и затем в молоко. Он встречается в виде коротких цепочек из двух — шести звеньев. Определенные штаммы, которые не образуют слизи и ароматических веществ с неприятным запахом, как многие дикие штаммы, входят в состав заквасок. Оптимальная температура развития Streptococcus lactis — около 30°С. Отдельные штаммы, однако, могут также размножаться, но медленно, при низких температурах (ниже 7°С). При температуре 25°С Streptococcus lactis за счет образования молочной кислоты снижает показатель рН примерно до 4,5 и молоко свертывается вследствие выпадения казеина. Streptococcus cremoris (сливочный стрептококк). В сыром молоке Streptococcus cremoris встречается не так часто, как Streptococcus lactis, от которого он отличается морфологически, так как образует длинные цепочки. Оптимальная температура развития Streptococcus cremoris 20—25°С. В течение 24 ч под влиянием Streptococcus cremoris при температуре 25°С наблюдается свертывание молока при рН, равном 5,0—5,2, однако без наличия сгустка. При температуре 10—18 °С Streptococcus cremoris склонен к образованию слизи. В северных странах этот стрептококк используется для приготовления особо устойчивого кислого молока. В закваске молочнокислых бактерий Streptococcus cremoris в сочетании с Streptococcus lactis способствует более густой консистенции продукта. Streptococcus diacetylactis. Он образует в молоке не только молочную кислоту, но и ацетоин и диацетил, важнейшие ароматические масла, а также СО2. Streptococcus diacetylactis содержится в значительном количестве в закваске для приготовления масла. Streptococcus thermophilus (термофильный стрептококк). Часто встречается на доильном оборудовании, молочной посуде и в сыром молоке. Устойчив к кратковременной пастеризации, но погибает при высокотемпературной пастеризации. Термофильный стрептококк, как и Streptococcus cremoris, представляет собой длинные цепочки. Оптимальная температура его развития 40—45°С. Он совместно с Lactobacillus bulgaricus используется для приготовления йогурта и в качестве компонента культуры для приготовления эмментальского сыра. Streptococcus thermophilus чрезвычайно чувствителен по отношению к пенициллину и некоторым антибиотикам и поэтому применяется в качестве тест-микроба для биологического определения (обнаружения) антибиотиков в молоке. Виды микроорганизмов группы энтерококков являются составными элементами нормальной кишечной микрофлоры человека и животных. Встречающийся в молоке Streptococcus bovis желательно относить не к группе Viridans, а в соответствии с его серологической классификацией в группу D энтерококков. Streptococcus faecalis var. liquefaciens отличается от Streptococcus faecalis var. faecalis более сильной протеолитической активностью. Streptococcus faecalis var. zymogenes также осуществляет протеолиз, но в меньшем объеме. По данным М. Бергей, Streptococc durans, который является разновидностью Streptococcus faecium, в настоящее время не относят к специфическому виду. Энтерококки могут попадать в молоко с калом, пылью или непосредственно из вымени (латентная инфекция, специфические маститы). У крупного рогатого скота и овец преимущественно распространены Streptococcus faecium и Streptococcus bovis. Энтерококки устойчивы к высокой температуре и выдерживают пастеризацию молока и его термическую обработку, применяемую при изготовлении сыров, а также нагревание сырного сгустка до 51°С при производстве эмментальского сыра. Вследствие своей устойчивости они могут выживать также при повышенной концентрации поваренной соли. Streptococcus faecalis var. liquefaciens вследствие протеолиза вызывает появление у сыра горького вкуса. Streptococcus faecium может стать причиной повторного брожения в эмментальском сыре из-за образования пропионовокислыми бактериями стимулирующих веществ и излишка лактата в зрелых сырах. Обнаружение энтерококков в молоке часто служит в качестве индикатора его фекального загрязнения. При этом необходимо учитывать, что энтерококки, особенно Streptococcus faecium, размножаются в плохо продезинфицированном доильном оборудовании, во флягах, автоцистернах, в танках для хранения молока и молокопроводах и являются постоянным источником его загрязнения. Streptococcus faecalis улучшает качество сыра чеддар при его созревании. Рекомендуется добавлять Streptococcus faecalis при производстве эмментальского и грюйерского сыров для улучшения их аромата. Значение энтерококков как микроорганизмов, вызывающих пищевое отравление, еще недостаточно изучено. Однако имеются сообщения относительно пищевых отравлений сырами, содержащими энтерококки. Streptococcus faecium u Streptococcus durans не патогенны, в то время как Streptococcus faecalis/liquefaciens и определенные штаммы Streptococcus faecium zymogenes вызывают желудочно-кишечные расстройства.
Род Leuconostoc. Виды Leuconostoc находятся на растениях и морфологически подобны стрептококкам. Они сбраживают сахара и гетероферментативно, то есть наряду с незначительным количеством молочной кислоты образуют также уксусную кислоту и ароматические вещества (ацетоин и диацетил). Образуются ацетоин и диацетил из солей лимонной кислоты. Однако аромат появляется только при рН ниже 5. Так как Leuconostoc сквашивает молоко в незначительной степени, то необходимо для появления аромата, сопутствующего процессу сквашивания молока, использовать культуру Streptococcus lactis. Leuconostoc (раньше их называли бетакокками) являются ароматообразующими составными частями заквасок молочнокислых бактерий для приготовления масла. Они участвуют также в образовании аромата ломтевых сыров. Важнейшие их виды: Leuconostoc cilrovorum и Leuconostoc dextranicum.
Род лактобацилл. В молочном хозяйстве лактобациллами называются грамположительные молочнокислые палочки. Они различной длины и толщины, не образуют спор и окисляют молоко значительно быстрее, чем стрептококки при рН 3,2—3,5. Лактобациллы достигают оптимального развития при низком значении рН и пониженном содержании кислорода. В соответствии с классификацией М. Бергея в молочном хозяйстве все виды Tribus Lactobacilleae делятся на три рода: термобактерии, стрептобактерии и бетабактерии. Род I. Термобактерии. Длинные палочки, не образуют цепочек, при температуре ниже 15°С не развиваются, оптимальный рост при температуре около 40°С, гомоферментативны. Род II. Стрептобактерии. Образуют длинные цепочки, состоящие из коротких палочек, развиваются и при температуре ниже 15°С, оптимальный рост при температуре 30°С, гомоферментативны. Род III. Бетабактерии. Они — гетероферментативны. Естественное место обитания лактобацилл — растения (трава, силос, фрукты). Встречаются в слюне и в кишечном тракте человека и животных. В молоко лактобациллы попадают из окружающей среды, так как стерильно выдоенное молоко не содержит лактобацилл. Лактобациллы отчасти термоустойчивы и могут выживать при кратковременной пастеризации, однако не выдерживают высокотемпературную пастеризацию. Лактобациллы играют важнейшую роль в приготовлении кисломолочных продуктов, твердых и ломтевых сыров. Они оптимально развиваются и образуют молочную кислоту только тогда, когда стрептококки создают для них благоприятные показатели рН и пониженный окислительно-восстановительный потенциал. Затем, вследствие значительного образования лактобациллами молочной кислоты, тормозится дальнейшее развитие стрептококков.При производстве эмментальского сыра участие лактобацилл в обмене веществ пропионовокислых бактерий является решающим для образования лактата.Созревание сыров происходит благодаря проявляющейся в различной степени протеолитической активности лактобацилл. Lactobacillus bulgaricus (Thermobacterium buldaricum). Образует длинные палочки и является гомоферментативной. Совместно с Streptococcus thermophilus или с окисляющей в большей степени Lactobacillus jughurti она применяется для приготовления йогурта.Иногда Lactobacillus bulgaricus входит в состав бактерий молочнокислой закваски для приготовления молочнокислых продуктов. Ее используют также при производстве твердых сыров. Оптимальная температура ее развития составляет 40—45°С. Lactobacillus lactis (Thermobacterium lactis) образует длинные нити. Постоянно находится в кишечнике человека и животных. Ее можно обнаружить на доильном оборудовании, и чаще, чем другие виды лактобацилл, она присутствует в необработанном (сыром) молоке. Lactobacillus lactis идентична Lactobacillus caucasicus, находящейся в кефире. Она часто принимает участие в созревании твердых сыров. Оптимальная температура ее развития примерно 40°С.
Лекция 7. Органические кислоты. Микроорганизмы – продуценты молочной, уксусной, лимонной, яблочной, итаконовой и других органических кислот, применяющихся в пищевой промышленности.
Органические кислоты. Микроорганизмы – продуценты молочной, уксусной, лимонной, яблочной, итаконовой и других органических кислот, применяющихся в пищевой промышленности
Органические кислоты широко используются в пищевой и фармацевтической промышленности, в технике и в качестве химического сырья. Более 50 органических кислот могут быть получены на основе микробиологического синтеза. Биотехнологические методы их получения к настоящему времени детально разработаны. Более того, принято считать, что органические кислоты, полученные в результате микробиологического синтеза, для использования человеком предпочтительнее в сравнение с синтетическими кислотами. Для технических нужд органические кислоты получают химическим путем; применяемые в пищевой и фармацевтической промышленности – в различных биотехнологических процессах. Это производства лимонной, молочной, уксусной, итаконовой, пропионовой и глюконовой органических кислот; (молочная и уксусные кислоты производятся также и химическим путем). При многих производствах органических кислот экономический коэффициент по углероду достигает 90 % и выше. В качестве продуцентов используют бактериальные, дрожжевые и грибные культуры (Lactobacillus, Arthrobacter, Alcaligenes, Candida, Aspergillus, Penicillium, Trichoderma). Способы ферментации в микробиологических процессах производства органических кислот разнообразны. Среди них – поверхностные жидко- и твердофазные процессы, а также глубинные, включая проточные культуры. В последние годы разработаны принципиально новые и эффективные биотехнологии с использованием иммобилизованных целых клеток и ферментов. Также разнообразны и субстраты, используемые в производстве органических кислот. Применяемые в начале века глюкоза и сахароза со временем стали заменять более доступными комплексными средами (мелассой, гидролизным крахмалом). В последние годы внимание привлечено к непищевому сырью, такому, как этиловый спирт и жидкие парафины. Парафины нефти могут быть использованы для многих микробиологических синтезов, в том числе при синтезе органических кислот. Наиболее перспективными продуцентами органических кислот из Н-парафинов признаны дрожжи.
С помощью микроорганизмов возможно получение более 50 различных органических кислот. (Таблица 3.)
Таблица 3. Основные органические кислоты, продуцируемые микроорганизмами
Кислота
|
Микроорганизм - продуцент |
Источник углерода |
Выход от источника углерода, % |
1.Молочная
2. Масляная 3. Пропионовая 4. Глюконовая 5.Пировиноградная 6. Уксусная 7. Лимонная
8. Итаконовая 9. Янтарная 10. Фумаровая
11. Яблочная |
Lactobacillus delbrueckii Rhizopus oryzae Clostridium butyricum Propionobacterium shermanii Aspergillus niger Pseudomonas aeruginoza Acetobacter aceti Aspergillus niger Candida lipolytika Aspergillus terreus Bacterium succinicum Rhizopus delemar Candida hydrocarbofumarica Schizophyllum commune C. hydrocarbofumarica + Pichia membranaefaciens |
Глюкоза (крахмал) Глюкоза Крахмал, глюкоза Глюкоза Глюкоза Глюкоза Этанол Сахароза (меласса) Парафин Глюкоза Яблочная кислота Глюкоза Парафин Глюкоза
Парафин |
90 60-70 50 60 До 95 50 90-98 85 140 60 57 58-65 84 70-100
72 |
Процессы микробиологического получения органических кислот иногда называют аэробным брожением. Однако такое определение не отражает физиологического смысла этого процесса для самого микроорганизма-продуцента. Согласно современным представлениям брожение определяется как тип метаболизма без участия молекулярного кислорода, при котором АТР образуется путем субстратного фосфорилирования. В свете этого процессы микробиологического синтеза уксусной, глюконовой, лимонной, фумаровой и ряда других органических кислот не могут быть определены как процессы брожения, поскольку их продуценты – аэробы и образование кислот осуществляется в условиях интенсивной аэрации. Указанные кислоты являются промежуточными продуктами метаболизма соединений углерода, в том числе интермедиатами цикла трикарбоновых кислот. Микробиологические способы получения органических кислот основаны на неполном окислении соединений углерода в аэробных условиях. Исключением является молочная кислота, которую получают в результате брожения.
Способность продуцировать, органические кислоты при росте на средах с углеводами широко распространена среди мицелиальных грибов родов Aspergillus, Rhizopus,Candida и другие грибы. Грибы обнаруживаются в виде плесневого налета, состоящего из вегетативного мицелия, несущего конидиеносцы с конидиями. На поверхностях питательных сред пенициллы и аспергиллы образуют плоские колонии, состоящие из вегетативного мицелия. На определенной стадии развития грибов образуются воздушные гифы, на которых развиваются конидиеносцы несущие конидии, которые служат для размножения плесневых грибов.
Получение лимонной кислоты
В 1891 г. Немецкий ученый Вемер установил способность плесневых грибов продуцировать органические кислоты. При выращивании Aspergillus niger на среде с сахаром им было констатировано выделение щавелевой кислоты. Через два года Вемер обнаружил лимонную кислоту, накапливающуюся в среде при выращивании грибов, названных им Citromyces (C. pfefferianus C. glaber). Впоследствии Citromyces были отнесены к роду Penicillium. Вемер пытался осуществить производство лимонной кислоты с помощью грибов из сахара. Работа окончилась неудачей в связи с рядом трудностей, непреодолимых в то время. В 1917 г. американский ученый Кэрри сообщил о способности ряда штаммов Aspergillus niger продуцировать лимонную кислоту наряду с щавелевой. Это было важное открытие, поскольку в отличие от плохо растущих пенициллов, Aspergillus niger характеризовался мощным и быстрым ростом. Штамм гриба, с которым работал Кэрри, и условия ведения процесса были в дальнейшем использованы в микробиологических процессах производства лимонной кислоты. Способность образовывать лимонную кислоту при росте на средах с углеводами – свойство, широко распространенное среди мицелиальных грибов. До недавнего времени в производстве использовали специально селекционированные штаммы гриба, выделенные из природных источников. Последние два десятилетия в качестве продуцентов все шире применяются экспериментально полученные мутантные штаммы, отличающиеся от природных рядом положительных свойств, в первую очередь более высоким выходом целевого продукта. Для получения лимонной кислоты в лабораторном и промышленном масштабе, кроме грибов рода Aspergillus (в том числе виды A. awamori, A. clavatus, A. fumaricas, A. japonicus, A. wentii), используются грибы рода Penicillium (в том числе P. chrysogenum, P. citrinum, P. citrogenium, P. luteum), а также Botrytis cinerea, Paecilomyces divaricatum, Mucor piriformis, Poliporus anceps и некоторые другие грибы. Объем мирового производства цитрата составляет 400 тыс. т/год. Самый крупный производитель лимонной кислоты - США. Производство лимонной кислоты принадлежит к числу старейших промышленных микробиологических процессов: оно было организовано в 1893 г. С этого момента параллельно развитию фундаментальной микробиологии велись изыскания оптимальных продуцентов и технологических вариантов процесса ферментации.Способность различных грибов, продуцировать лимонную кислоту проявляется в строго определенных условиях культивирования. Культуры грибов при избытке питательных веществ не накапливают лимонной кислоты, а образуют значительную биомассу и окисляют сахар до CO2 и H2 O. Синтез лимонной кислоты грибом-продуцентом осуществляется обычно на средах с высокой концентрацией углевода (5-20%). Наилучшим субстратом для продуцентов является – сахароза.Накопления кислоты имеет место при ограничении роста гриба одним из минеральных компонентов среды (F, Mn, P, N) или несколькими компонентами одновременно. Преимущественное образование лимонной кислоты происходит при культивировании продуцента при низким значении рН среды. В таких условиях синтез других органических кислот подавляется. Процесс кислотообразования осуществляется в условиях культуры молекулярным кислородом.
В процессе ферментации микробиологического производства, можно выделить две фазы: 1) активного роста гриба и 2) интенсивного кислотообразования, рост мицелия в этот период становится незначительным.При производстве лимонной кислоты применяются три способа ферментации:
Культивирование продуцента на поверхности твердой питательной среды (твердофазная ферментация).
Поверхностное культивирование на жидкой среде.
Погруженное глубинное культивирование.
Культивирование на поверхности твердой среды. Гриб-продуцент выращивают в неглубоких лотках на поверхности влажных отрубей риса или пшеницы. Во время ферментации рН массы отрубей падает до 1,8-2,0. после окончания процесса лимонная кислота вместе с небольшим количеством одновременно образовавшихся глюконовой и щавелевой кислот экстрагируется водой, а затем осаждается в виде соли кальция. В связи с тем, что отруби богаты железом и другими микроэлементами используют штаммы Aspergillus niger, не чувствительные к высоким концентрациям металлов. Поверхностное культивирование на жидкой среде. Поверхность жидкой среды, разлитой в неглубокие кюветы, засевают конидиями гриба – продуцента. Кюветы размещают на стеллажах в термостатированных «бродильных камерах». Гриб развивается в виде плотной пленки на поверхности питательной среды, содержащей высокие концентрации сахара. Образующаяся лимонная кислота переходит из клеток мицелия в раствор, из которого после окончания процесса ее осаждают в виде кальциевой соли, а затем переводят в форму свободной кислоты и кристаллизуют.
Глубинное культивирование. Производство лимонной кислоты методом глубинного культивирования обладает многими преимуществами по сравнению другими методами культивирования. Применение глубинного метода позволяет повысить эффективность использования производственных площадей, увеличить масштабы производства, механизировать трудоемкие работы и почти полностью автоматизировать технологический процесс получения кислоты. При этом методе применяют специально селекционированные природные штаммы или мутанты. Штамм сохраняется в виде конидий, отделенных от мицелия. В качестве посевного материала для ферментации используются конидия гриба, смешанные с активированным углем или тальком. Процесс ферментации включает два этапа: 1) выращивание мицелия в посевном аппарате; 2) рост мицелия и кислообразование в основном ферментаторе. В предварительно простерилизованной посевной аппарат загружают питательную среду, для подращивания посевного материала, содержащую 3-4% сахара, затем через инокулятор вносят суспензию спор гриба. Сразу после засева в ферментер подают стерильный воздух и включают мешалку. Прорастание спор и формирование мицелии гриба происходит при непрерывном продувании воздуха через культуральную жидкость и перемешивании ее. Температура среды поддерживает около 32о С. Через 20-36 ч мицелии гриба вместе с культуральной жидкостью передается в основной ферментатор. Основной процесс в производственном ферментаторе продолжается 5-7 суток. В конце ферментации концентрация лимонной кислоты достигает 50-120% (в зависимости от качества сырья и активности штамма) и составляет 80-95% общей суммы кислот. Когда активность кислотообразования падает, процесс прекращают. Культуральный раствор отделяют от мицелия путем фильтрацией или другим способом и передают в химический цех для выделения и последующей кристаллизации лимонной кислоты ( Рис. 1).


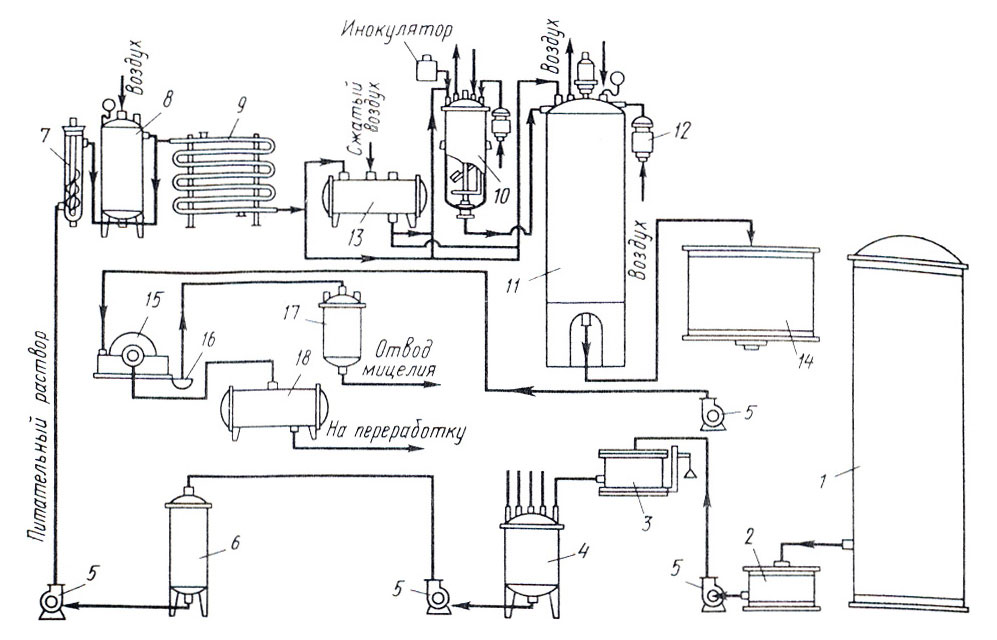
Рис. 1. Технологическая схема получения лимонной кислоты глубинным способом культивирования (Карклиньш и Пробок, 1972):
1 – бак с мелассой; 2 – приемный бак; 3 – весы; 4 – выварочный котел; 5 - центробежный насос; 6 – промежуточная емкость; 7 – стерильная колонка; 8 – выдерживатель; 9 – холодильник; 10 – посевной ферментатор; 11 - производственный ферментатор; 12 – противобактериальные фильтры; 13 – емкость для хранения мелассы; 14 – промежуточный сборник; 15 – барабанный вакуум-фильтр; 16 – корыто для приема мицелия; 17 - вакуум-сборник для мицелия; 18 – вакуум-сборник фильтрованного (сброженного) раствора.
Производство уксусной кислоты
Уксусная кислота (СН3СООН) – имеет наиболее важное значение среди всех органических кислот. Она широко используется в пищевой, химической, микробиологической промышленности, в медицине. Ежегодно в мире производят более 100 тыс. т уксусной кислоты. Уксус применяют в пищевой промышленности. Его используют при выработке многих химических веществ, включая каучук, пластмассы, волокна, инсектициды. Получение уксусной кислоты из спиртосодержащих жидкостей было известно более 10 тыс. лет назад. В те времена древние греки и римляне использовали уксус в качестве освежающего напитка и получали, главным образом, оставляя вино открытым. В больших масштабах уксус долго получали в плоских открытых бочках, в которых пленка бактерий плавала на поверхности. В XIX веке поверхностные процессы стали заменять более эффективными. Так, был разработан процесс в струйном генераторе. В середине ХХ века появились глубинные процессы ферментации. Усовершенствованный генератор Фрингса (рис. 2.) используется в настоящее время.


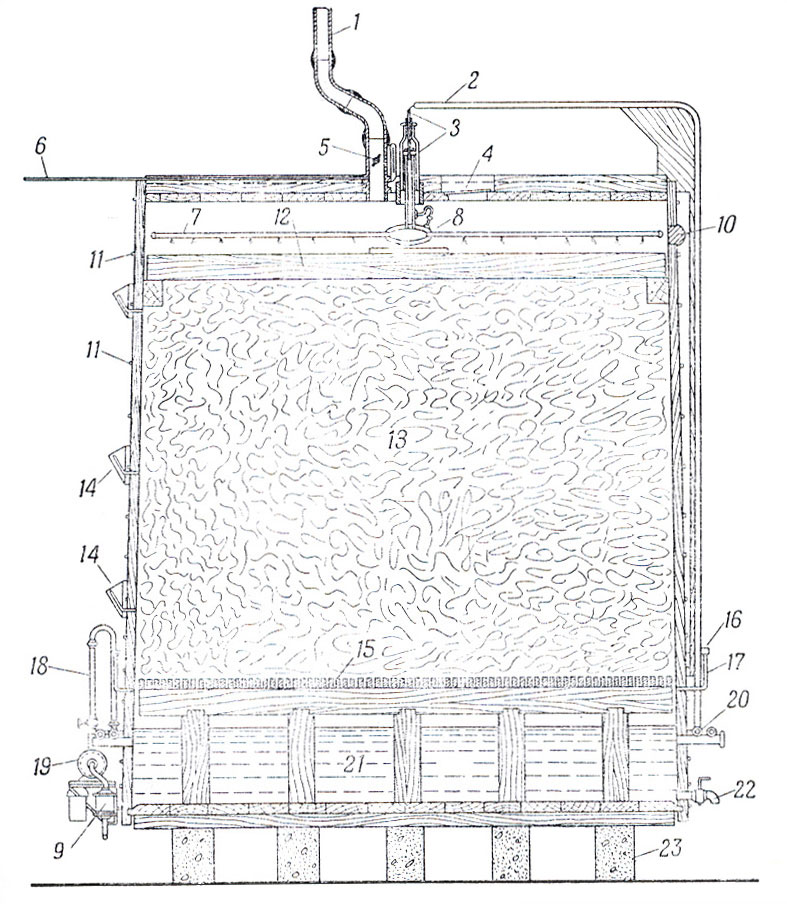
Рис.2. Схема получения уксусной кислоты. Поперечный разрез
генератора Фрингса.
1-выводная труба; 2-каучуковая трубка; 3-стеклянный механизм, регулирующий ток жидкости; 4-смотровое отверстие, закрытое стеклом; 5-регулятор тяги; 6-стеклянная трубка диаметром 1см, идущая к газовому счетчику; 7-боковые лучи распылителя диаметром около 2,2см; 8 – распылитель; 9-фильтр для уксуса; 10-втулка, закрывающая отверстие для работы распылителя; 11-обручи толщиной 2,5см; 12-Упор для распылителя диаметром 15,2-20,3см; 13-Стружки; 14-Термометры для измерения температуры внутри генератора; 15-Деревянная решетка с отверстиями 3,7-7,5см; 16-Фильтр для воздуха; 17-Труба для поступления воздуха (по 10 в каждом генераторе); 18-Счетчик циркулирующей жидкости; 9-Центробежный насос; 20-Змеевик холодильника диаметром 2,5см из нержавеющей стали, лежащий внутри медной трубки диаметром 3,75см, в которой циркулирует холодная вода; 21-Сточная камера; 22-Кран для слива готового уксуса; 23 – Цементные блоки.
Процессы получения в генераторе Фрингса, один из быстрых способов производства уксуса. Генератор состоит из герметического биореактора диаметром обычно около 4,25 м и высотой 4,5 м, снабженного вспомогательными механизмами. Генератор устанавливают на бетонных брусьях, для того чтобы воздух мог свободно циркулировать под аппаратом. Внутри биореактора, на небольшом расстоянии от его дна, находится деревянная решетка, на которую помещают буковые стружки. Генератор наполняют стружками, оставляя наверху свободное пространство около 40 см высотой. Между деревянной решеткой и дном генератора находится камера для сбора готовой продукции. В самом низу этой камеры имеется кран или втулка для удаления готового уксуса. На небольшом расстоянии от дна генератора расположен змеевик для охлаждения. Прошедший через стружки подкисленный спиртовой раствор попадает в нижнюю камеру, а оттуда накачивается в трубу, сделанную из нержавеющей стали или какого-либо другого кислотоустойчивого материала, где раствор охлаждается. Для охлаждения стальная труба заключена в другую трубу из меди, несколько большего диаметра, в которой циркулирует холодная вода. Затем частично сброженное сусло при помощи специального насоса из нержавеющей стали снова поднимается по резиновой трубке из холодильника в верхнюю часть биореактора. Здесь жидкость, проходя через специальный стеклянный аппарат, попадает в распылитель из нержавеющей стали. Количество проходящего через генератор кислорода зависит от регулятора тяги, расположенного в выходном отверстии диаметром около 10 см – оно находится на самом верху генератора. Это отверстие служит для выхода воздуха. Воздух поступает в генератор через несколько (обычно 10) специальных клапанов, расположенных по окружности биореактора на уровне нижней деревянной решетки. Эти клапаны снабжены приспособлениями для фильтрации воздуха. Для определения температуры брожения в различных отделах биореактора имеются термометры. Генератор снабжен двумя счетчиками: первый, расположенный около насоса, служит для измерения скорости циркуляции сусла, второй — для определения скорости тока воды в холодильнике. Сусло пропускают несколько раз через буковые стружки до получения уксуса желаемой крепости. Питательная жидкость, содержащая спирт и кислоту, проходя через холодильник, охлаждается до желаемой температуры, что позволяет точно контролировать температуру внутри биореактора. Охлажденная смесь вновь подается в распылитель и распределяется равномерно по поверхности стружек. Стекая по стружкам, этиловый спирт, содержащийся в сусле, постепенно превращается в уксусную кислоту. Затем полусброженное сусло снова охлаждается, накачивается насосом в верхнюю часть биореактора и распыляется еще раз. Эта операция повторяется до тех пор, пока содержание уксусной кислоты в жидкости не достигнет 10,5 %. Готовый продукт сливают, оставляя в генераторе лишь незначительную часть (10 %). Остающийся уксус служит для питания микробов, а также для того, чтобы насос мог нормально продолжать работать. После этого в генератор быстро вводят новую партию свежего сусла. Чтобы уксусное брожение протекало нормально, сахар, содержащиеся в сбраживаемом субстрате должен быть превращен в этиловый спирт, поэтому уксуснокислому брожению предшествует спиртовое. Уксус, полученный микробиологическим путем, различают по сортам в зависимости от характера сбраживаемого субстрата. Известен яблочный, виноградный, грушевый и другие сорта уксуса. Уксус, полученный при брожении, имеет приятный аромат и вкус, которые обуславливают побочные продукты брожения: сложные эфиры, высшие спирты, органические кислоты.
Процесс идет в анаэробных условиях в режиме непрерывного культивирования продуцента. Для роста бактерии Acetobacter aceti используют питательные среды, содержащие 6 - 12 % этилового спирта, 1 % бактериального гидролизата, 0,05 % дигидрофосфата калия, 0,1 % гидрофосфата аммония и 0,05% сульфата магния. Максимальная удельная активность непрерывной культуры A. aceti (количество микрограммов субстрата, подвергшегося окислению 1мкг биомассы за 1 мин) достигается к 20-м суткам культивирования при концентрации спирта 7 % и составляет 3,0 ед./мг.Установлено, что продуцент уксусной кислоты из рода Acetobacter, развиваясь на поверхности среды, образует слизистую пленку, которая состоит из целлюлозы (90 %) и клеток бактерий. Если эту пленку снять, высушить и соответственно обработать, можно получить достаточно прочные биофильтры медицинского назначения. Если ожоговые раны покрыть такими биофильтрами, они заживают в течении 7- 8 суток. В настоящее время процесс реализуют как поверхностным, так и глубинным способом. Поверхностный режим протекает в струйных генераторах, наполненных древесной стружкой, объемом до 60 м3. Исходный питательный раствор с бактериями распыляют по поверхности стружек, и он стекает, собираясь в нижней части аппарата. После этого жидкость собирают и вновь закачивают в верхнюю часть аппарата. Процедуру повторяют 3–4 раза, в результате в течение 3-х дней до 90 % спирта трансформируется в ацетат. Этот старый способ протекает более эффективно и равномерно в генераторах Фрингса с автоматическим поддержанием температуры и принудительной подачей воздуха. По такой технологии производят до 400 млн л уксусной кислоты в год. Современные промышленные процессы получения уксуса реализуют в глубинной культуре в специальных аэрационных аппаратах с термостабилизацией и механической системой пеногашения. Скорость аэрации составляет 3.4 м3/м3ч., вращение ротора – 1500 об./мин., температура 30С. Исходная инокулируемая смесь содержит этанол и уксусную кислоту, соответственно, около 5 и 7 %; конечная концентрация уксуса через 1.5 суток составляет 12–13 %. Процесс – полупроточный, отливно-доливный. Каждые 30–35 часов до 60 % культуры заменяют на свежее сусло. При глубинной ферментации выход продукта на 1 м3 в 10 раз выше по сравнению с поверхностной ферментацией. К началу 90-х гг. таким способом производили до 715 млн. литров 10 % уксусной кислоты в год. Разработан и реализован эффективный непрерывный способ получения уксусной кислоты в батарее последовательно работающих ферментеров (обычно 5 аппаратов). Температура культивирования составляет 28° для Acetobacter и 35° при использовании в качестве продуцента культуры Bact. schutzenbachii. Наилучшим сырьем для процесса является этиловый спирт, полученный из зерно-картофельного сырья, при его концентрации около 10 %. Оптимум рН для развития бактерий – около 3. При увеличении содержания уксусной кислоты в культуре свыше 8 % рост бактерий замедляется, при 12–14 % прекращается. Поэтому процесс проводят в батарее последовательно соединенных аппаратов. Первый выполняет роль инокулятора, поэтому в него непрерывно подают свежую среду и поддерживают условия, оптимальные для быстрого образования биомассы бактерий. Культура из первого аппарата поступает во второй аппарат и далее – в последующие, при этом транспортировка культуральной жидкости осуществляется воздухом. В каждом аппарате условия ферментации стабилизируются в соответствии с требованиями течения хода ферментации, при постепенном понижении температура среды от 28° в первом аппарате до 25° – в последнем. Режим аэрации также изменяется, от 0.4 до 0.15 м3/м3 мин. Концентрация спирта со второго по четвертый аппарат стабилизируется на требуемом уровне подачей в них среды с 40 % этанолом. Из последнего аппарата выводится культуральная жидкость с содержанием ацетата не ниже 9.0 и не выше 9.3 %. Выход кислоты составляет до 90 кг из 100 л безводного спирта. На постферментационной стадии после отделения бактериальной биомассы раствор уксуса фильтруют, освобождая от окрашенных и взвешенных частиц, и далее подвергают пастеризации. Для повышения концентрации исходные растворы вымораживают до 20–30 %. Дальнейшее концентрирование до получения ледяной уксусной кислоты (98.0–99.8 %), проводят методом перегонки. Уксус, полученный микробиологическим путем, различают по сортам в зависимости от характера сбраживаемого субстрата. Известен яблочный, виноградный, грушевый и другие сорта уксуса. Уксус, полученный при брожении, имеет приятный аромат и вкус, которые обуславливают побочные продукты брожения: сложные эфиры, высшие спирты, органические кислоты.
Производство итаконовой кислоты
Процесс синтеза итаконовой кислоты очень похож на соответствующий процесс получения лимонной кислоты. Она может быть получена методами поверхностного и глубинного культивирования. Чаще используется глубинный метод. Процесс включает культивирование продуцента на среде с высокой концентрацией сахара в условиях ограничения роста гриба минеральными компонентами среды (обычно железом и фосфором), при низким рН среды и достаточном обеспечении кислородом. Итаконовая кислота в отличие от лимонной кислоты является токсичным продуктом. При концентрации ее в среде около 70 г/л наблюдается угнетение роста продуцента и синтеза продукта. Избежать токсичного действия накапливающиеся кислоты можно нейтрализацией ее NH4OH. Периодическое введение NH4OH и поддержание значение рН среды на уровне 3,8 обеспечивает накопление до 150-200 г итаконовой кислоты в литре раствора. Другая особенность процесса синтеза итаконовой кислоты с помощью A. terreus – необходимость внесения в среду высокой концентраций ионов таких металлов, как Zn2+, Mg2+ и Cu2+. В результате многоступенчатой обработки природного штамма мутагенами и последующего отбора селекционированных ряд высокоактивных мутантов A. terreus используется для производства итаконовой кислоты во всех производствах. В качестве посевного материала при поверхностным и глубинным методах ферментации в промышленностях используют сухие конидии гриба, отделенные от мицелия и смешанные с активированным углем. При поверхностным способе процесс ферментации осуществляется в кюветах по бессменному варианту без долива или с доливом. В качестве источника углерода используют свекловичную мелассу или продукт переработки отходов древесины – двойное соединение глюкозы с NaCl. Рациональная концентрация сахара 8%, кроме того, среда содержит NH4NO3, MgSO4, ZnSO4·7H2O, K4Fe(CN)6 и кукурузный экстракт. Начальное рН среды 5,0. важным фактором является воздушный режим в «бродильном камере». При глубинном способе процесс осуществляется последовательно в двух ферментаторах. Среда в посевном ферментаторе засевается спорами гриба. В конечной фазе роста мицелий передается из посевного в основной аппарат. Ферментационная среда содержит 6-7% сахара мелассы (состав солей тот же, что и при поверхностном методе), рН среды поддерживается на уровне 2,1 – 2,3, оптимальном для синтеза итаконовой кислоты. В течении ферментации осуществляется интенсивное перемешивание и аэрация среды. В конце процесса концентрация кислоты достигает 40-60 г/л. Биосинтез итаконовой кислоты в глубинных условиях происходит намного интенсивнее, чем в поверхностных. Содержание итаконовой кислоты достигает 15–20 %, остаточная концентрация сахаров не превышает 0.6 %. В отличие от лимонной, итаконовая кислота – токсичный продукт, при ее концентрации около 7 % рост продуцента угнетается, и скорость продукции кислоты снижается. Токсичность итаконовой кислоты нейтрализуют дробными добавками гидроксиаммония, рН среды при этом стабилизируется на уровне 3.5–3.8. При глубинной ферментации конечная концентрация итаконовой кислоты ниже, 4–6 %. Товарный продукт – кристаллическая итаконовая кислота 92 % содержания, остальное – влага (3–6 %) и другие кислоты. Среды содержат высокие концентрации сахаров, обычно используют мелассу, при дефиците фосфора и железа. Особенностью процесса получения данной кислоты является высокая потребность продуцента в солях цинка, магния и меди. При поверхностной ферментации в течение 10–12 суток образуется около 60 % продукта в пересчете на сахар, доля целевой кислоты в смеси (синтезируются также янтарная, щавелевая и фумаровая кислоты) – свыше 90%. После окончания процесса ферментации культуральную среду освобождают от мицелия, осветляют активированным углем и упаривают под вакуумом. Итаконовая кислота кристаллизируется из упаренного раствора. Перекристаллизированная Итаконовая кислота используются для химических синтезов.
Производство молочной кислоты
Промышленное производство молочной кислоты начато в конце ХIХ века с участием молочнокислых бактерий Lactobacillus delbrueckii, L. leichmannii, L.bulgaricus. Образование молочной кислоты из глюкозы возможно несколькими путями. При сбраживании гомоферментными молочнокислыми бактериями:
С6Н12О6 2 СН2ОН2СНОНСНО (глицеральдегид) 2 СН3СОСНО (метилглиоксаль) + 2 Н2О,
СН3СОСНО (метилглиоксаль) + Н2О СН3СНОНСООН (молочная кислота).
Второй путь, гетероферментный, включает распад глюкозы до пировиноградной кислоты и восстановление последней до молочной кислоты:
С6Н12О6 СН3СОСООН + Н2 СН3СНОНСООН.
Молочнокислое брожение протекает в анаэробных условиях, однако лактобациллы относятся к факультативным анаэробам, поэтому при ферментации воздух полностью не удаляют из ферментеров. В качестве сырья используют сахарную и тростниковую мелассу и гидролизаты крахмала, при этом концентрация сахаров в исходной среде в зависимости от характера брожения составляет примерно от 5 до 20 %. Используют восстановленные формы азота, сульфаты или фосфаты аммония, а также солод и кукурузный экстракт в качестве источника факторов роста. Молочной, или казеиновой, сывороткой называют жидкость, остающуюся после удаления из молока жиров и казеина. Она содержит некоторое количество белков (лактальбумина), 4,6 % лактозы, рибофлавин, минеральные соли и воду. Молочная сыворотка служит питательным субстратом для молочнокислых бактерий в производстве молочной кислоты. Пастеризованную сыворотку засевают закваской, содержащей Lactobacillus bulgaricus. Образующаяся по ходу брожения молочная кислота периодически нейтрализуется известью. По окончании брожения раствор нагревают для удаления лактальбумина. После осаждения свернувшегося лактальбумина раствор молочнокислого кальция сливается, фильтруется, обрабатывается для осветления активированным углем, снова фильтруется и, наконец, упаривается. Молочнокислый кальций кристаллизуется, кристаллы отмывают и в случае необходимости подвергают дальнейшей очистке, а затем высушиванию. Готовый продукт поступает в продажу в виде молочнокислого кальция или молочной кислоты. Возможно использование сульфитного щелока с участием бактерий L. delbrueckii. Ферментацию проводят в глубинной культуре при рН 6.3–6.5 и строго постоянной температуре 50С. Длительность процесса составляет до 7–11 суток. В ходе процесса брожения для коррекции изменяющегося рН в культуру вносят мел, 3–4 раза в течение суток. Конечная концентрация образующегося лактата кальция составляет 10–15 %, остаточная концентрация сахаров – 0.5–0.7 %. На стадии получения готового продукта культуральную среду нагревают до 80–90, затем нейтрализуют гашеной известью до слабощелочной реакции. После отстаивания в течение 3–5 ч взвешенные частицы декантируют. После этого раствор лактата кальция подают на фильтр-пресс. Фильтрат упаривают до концентрации 27–30 %, охлаждают до 25–30 и подвергают кристаллизации. Промытый лактат кальция отделяют центрифугированием и подвергают расщеплению серной кислотой при 60–70. Сырую молочную кислоту 18–20 % концентрации упаривают в несколько этапов в вакуум-выпарных аппаратах до 70 % концентрации. Отфильтрованную кислоту после фильтр-пресса подают на розлив с внесением небольших количеств мела, при этом около 10 % кислоты превращается в кристаллический лактат, который связывает молочную кислоту.
Новые возможности для интенсификации производственных процессов получения органических кислот открывает применение иммобилизованных ферментов и клеток микроорганизмов.
Лекция 8. Получение белка. Получение белков из дрожжей. Получение белков из фототрофных микроорганизмов. Культура микроводорослей и цианобактерий. Пищевая ценность и перспективы применения микробного белка.
Получение белка. Получение белков из дрожжей
Микроорганизмы начали использовать в производстве белковых продуктов задолго до возникновения микробиологии. Достаточно упомянуть всевозможные разновидности сыра, а также продукты, получаемые путем ферментации соевых бобов. И в первом, и во втором случае питательной основой является белок. При выработке этих продуктов при участии микробов происходит глубокое изменение свойств белоксодержащего сырья. В результате получают пищевые продукты, которые можно дольше хранить (сыр) или удобнее потреблять (соевый творог). Микробы играют роль в производстве некоторых мясных продуктов, предназначенных для хранения. Так, при изготовлении некоторых сортов колбасы используется кислотное брожение, обычно при участии комплекса молочнокислых бактерий. Образовавшаяся кислота способствует сохранности продукта и вносит вклад в формирование его особого вкуса.Этим, пожалуй, и ограничивается использование микроорганизмов в переработке белков. Возможности современной биотехнологии в этих производствах невелики, за исключением сыроделия. Другое дело – выращивание и сбор микробной массы, перерабатываемой в пищевые продукты: здесь биотехнология может проявить себя во всей полноте. По многим важным показателям биомасса микроорганизмов может обладать весьма высокой питательной ценностью. В немалой степени эта ценность определяется белками: у большинства видов они составляют значительную долю сухой массы клеток. На протяжении десятилетий активно обсуждаются и исследуются перспективы увеличения доли белка микроорганизмов в общем балансе производимого во всем мире белка. Производство такого белка связано с крупномасштабным выращиванием определенных микроорганизмов, которые собирают и перерабатывают в пищевые продукты. Чтобы осуществить возможно более полное превращение субстрата в биомассу микробов, требуется многосторонний подход. Выращивание микробов в пищевых целях представляет интерес по двум причинам. Во-первых, они растут гораздо быстрее, чем растения и животные: время удвоения их численности измеряется часами. Это сокращает сроки, нужные для производства определенного количества пищи. Во-вторых, в зависимости от выращиваемых микроорганизмов в качестве субстратов могут использоваться разнообразные виды сырья. Что касается субстратов, то здесь можно идти по двум главным направлениям: перерабатывать низкокачественные бросовые продукты или ориентироваться на легкодоступные углеводы и получать за их счет микробную биомассу, содержащую высококачественный белок.
Получение микробного белка на низших спиртах. Культивирование на метаноле. Основное преимущество этого субстрата – высокая чистота и отсутствие канцерогенных примесей, хорошая растворимость в воде, высокая летучесть, позволяющая легко удалять его остатки из готового продукта. Биомасса, полученная на метаноле, не содержит нежелательных примесей, что дает возможность исключить из технологической схемы стадии очистки. Однако, необходимо учитывать при проведении процесса и такие особенности метанола, как горючесть и возможность образования взрывоопасных смесей с воздухом. В качестве продуцентов, использующих метанол в конструктивном обмене, были изучены как дрожжевые, так и бактериальные штаммы. У дрожжей были рекомендованы в производство Candida boidinii, Hansenula polymorpha и Piehia pastoris, оптимальные условия для которых (t=34-37°C, рН=4,2-4,6) позволяют проводить процесс с экономическим коэффициентом усвоения субстрата до 0,40 при скорости протока в интервале 0,12-0,16 ч-1. Среди бактериальных культур применяется Methylomonas clara, Pseudomonas rosea и др, способные развиваться при t=32-34°C, рН=6,0-6,4 с экономическим коэффициентом усвоения субстрата до 0,55 при скорости протока до 0,5 ч-1. Особенности процесса культивирования во многом обусловлены применяемым штаммом-продуцентом (дрожжи или бактерии) и условиями асептики. Ряд зарубежных фирм предлагает использовать дрожжевые штаммы и проводить выращивание в отсутствии строгой асептики. В этом случае технологический процесс протекает в ферментёре эжекционного типа производительностью 75 т АСВ в сутки, а удельный расход метанола составляет 2,5 т/т АСВ. При культивировании дрожжей в асептических условиях рекомендованы аппараты колонного или эрлтфитного типа производительностью 75-100 т АСВ/сут при расходе метанола до 2,63 т/т АСВ. В том и другом случае процесс культивирования проводится одностадийно, без стадии «дозревания» с невысокой концентрацией субстрата (8-10 г/л). В ряде стран в качестве продуцентов применяются бактериальные штаммы, процесс проводится в асептических условиях в ферментерах эрлифитного или струйного типов производительностью 100-300 т/сут и расходом метанола до 2,3 т/т АСВ. Ферментация осуществляется одностадийно при невысоких концентрациях спирта (до 12 г/л) с высокой степенью утилизации метанола. Кормовые дрожжи, полученные на метаноле, имеют следующий процентный состав: сырой протеин 56-62; липиды 5-6; зола 7-11; влага 8-10; нуклеиновые кислоты 5-6. Бактериальная биомасса характеризуется следующим составом: сырой протеин 70-74; липиды 7-9; зола 8-10; нуклеиновые кислоты 10-13; влажность 8-10.Кроме метанола, в качестве высококачественного сырья используют этанол, который имеет малую токсичность, хорошую растворимость в воде, небольшое количество примесей.В качестве микроорганизмов – продуцентов белка на этиловом спирте как единственном источнике углерода могут использоваться дрожжи (Candida utilis, Sacharomyces lambica, Hansenula anomala, Acinetobacter calcoaceticus). Процесс культивирования проводят одностадийно в ферментерах с высокими массообменными характеристиками при концентрации этанола не более 15 г/л. Дрожжи, выращенные на этаноле, содержат (%): сырого протеина 60-62; липидов 2-4; золы 8-10; влаги до 10.
Получение белковых веществ на углеводном сырье. Исторически одним из первых субстратов, используемых для получения кормовой биомассы, были гидролизаты растительных отходов, предгидрализаты и сульфитный щелок – отходы целлюлозно-бумажной промышленности. Интерес к углеводному сырью как основному возобновляемому источнику углерода значительно возрос еще и с экологической точки зрения, так как оно может служить основой для создания безотходной технологии переработки растительных продуктов. В связи с тем, что гидролизаты представляют собой сложный субстрат, состоящий из смеси гексоз и пентоз, среди промышленных штаммов- продуцентов получили распространение виды дрожжей C.utilis, C.scottii и C.tropicalis, способные наряду с гексозами усваивать пентозы, а также переносить наличие фурфурола в среде. Состав питательной среды в случае культивирования на углеводородном сырье значительно отличается от применяемого при выращивании микроорганизмов на углеводородном субстрате. В гидролизатах и сульфитных щелоках имеются в небольшом количестве практически все необходимые для роста дрожжей микроэлементы. Недостающие количества азота, фосфора и калия вводятся в виде общего раствора солей аммофоса, хлорида калия и сульфата аммония. Ферментация осуществляется в эрлифтных аппаратах конструкции Лефрансуа-Марийе объемом 320 и 600 м3. Процесс культивирования дрожжей осуществляется в непрерывном режиме при рН 4,2-4,6. Оптимальная температура от 30 до 40°С.Кормовые дрожжи, полученные при культивировании на гидролизатах растительного сырья и сульфитных щелоках, имеют следующий состав (%): белок 43-58; липиды 2,3-3,0; углеводы 11-23; зола – до 11; влажность – не более 10. Одним из перспективных субстратов в производстве кормовой биомассы являются гидролизаты торфа, имеющие в своем составе большое количество легкоусвояемых моносахаров и органических кислот. Дополнительно в состав питательной среды вводятся лишь небольшие количества суперфосфата и хлорида калия. Источником азота служит аммиачная вода. По качеству кормовая биомасса, полученная на гидролизатах торфа, превосходит дрожжи, выращенные на отходах растительного сырья.
Получение белков из фототрофных микроорганизмов. Культура микроводорослей и цианобактерий.
Компромиссом может служить белок микробной массы. Разработана технология получения таких белков из отходов растениеводства. Из биомассы отдельных штаммов (культуры микроорганизмов одного вида, выделенные из одного или разных источников в разное время. Разные штаммы бактерий могут отличаться по ряду свойств, например, по способности синтеза ферментов) получают белок, сбалансированный по аминокислотному составу и нуклеиновым компонентам (нуклеиновые кислоты (ДНК и РНК) входящие в состав препаратов белка, получаемого из микроорганизмов). Принципиально новое направление использование фотоавтотрофных (организмы получающие энергию за счет фотохимических реакций, а углерод - из углекислоты) и хемолитотрофных (бактерии, получающие энергию за счет химических реакций, а углерод из углекислоты воздуха) организмов, для которых источником углерода является углекислота. К ним относятся сине-зеленые водоросли (цианобактерии, аэробные оксигенные фототрофные
бактерии. Имеют такой же фотосинтетический аппарат, как и растения, но строение клетки и способ размножения у них те же, что и у бактерий. Бывают
одноклеточные и многоклеточные формы, в том числе – нитчатые) рода Spirulina (род цианобактерий. Цианобактерии – это род аэробных фототрофных бактерий, образующих кислород. По способу размножения (бинарное деление), наличию муреиновой клеточной стенки, наличию 70-S-рибосом и другим признакам относятся к бактериям. Цианобактерии содержат хлорофилл и ряд общих с растениями пигментов. Для рода Spirulina характерно образование трихомов (цепочек клеток) винтообразно закрученной формы. Трихомы способны двигаться путем скольжения), получающие энергию света и водородные бактерии (бактерии, окисляющие в аэробных условиях молекулярный водород с использование кислорода как конечного акцептора
электронов. Способны использовать как углекислоту, так и органические вещества в качестве источника углерода в процессе построения необходимых для клетки веществ, т.е. являются факультативными хемолитоавтотрофами), которым дает энергию реакция окисления водорода.
Ж ивотные
белки дороги и трудно перевариваются.
У них иной, чем у человека, аминокислотный
состав. Зачастую в животных белках нет
нужных аминокислот. В растительных
белках нет семи незаменимых аминокислот,
без которых не могут строиться белки
человека (лизин (альфа,эпсилон-диаминокапроновая
кислота, диаминомонокарбоновая
аминокислота. Молекулярная масса 146.
Входит в состав почти всех белков, в
малом количестве содержится в белках
злаков. Незаменимая аминокислота, не
синтезируется в организме человека и
животных), триптофан (бета-(бета-индолил)-
альфа-аминопропионовая кислота,
ароматическая аминокислота. L-триптофан
входит в состав гамма-глобулинов,
фибриногена и других белков. Из продуктов
распада L-триптофана образуется
никотиновая кислота и серотонин, у
растений –гетероауксин. В растениях и
микроорганизмах триптофан синтезируется
конденсацией серина и индола. L-триптофан
незаменимая аминокислота. Суточная
потребность человека составляет 0,25 г,
у детей – около 1 г. Недостаток триптофана
может быть связан с туберкулезом,
диабетом, раком. Для повышения пищевой
ценности белков в них добавляют
триптофан), метионин
(альфа-амино-гамма-метилтиомасляная
кислота,монокарбоновая аминокислота,
содержащая серу. D- и L-формы равноценны,
т.к.способны к взаимному превращению.
L-метионин входит в состав большинства
белков растительного и животного
происхождения. Является донором метильных
групп при образовании холина, адреналина
и других биологически активных веществ.
Служит источником серы при биосинтезе
аминокислоты цистеина.Образуется из
аспарагиновой кислоты только в клетках
растений и некоторых микроорганизмов,
у млекопитающих образуется из гомоцистеина.
Незаменимая аминокислота, суточная
потребность человека составляет 2,5-3 г.
Недостаток метионина приводит к нарушению
биосинтеза белков, замедлению роста и
развития организма, тяжелым функциональным
расстройствам), цистин(серосодержащая
незаменимая аминокислота SH(CH2)C(NH2)COOH),
валин (альфа-аминоизовалериановая
кислота.(СН3)2СНСН(NH2)–COOH Одна из незаменимых
аминокислот. Входит в составмногих
белков), лейцин (аминоизокапроновая
кислота, моноаминомонокарбоновая.
кислота,входит в состав всех белков
животных и растений, является незаменимой
аминокислотой, так как в организме
человека не может синтезироваться),
изолейцин (альфа-амино-бета-валериановая
кислота. Аминокислота, относится к
числу алифатических моноаминокислот
с разветвленной углеродной цепью),
особенно дефецитен лизин.
ивотные
белки дороги и трудно перевариваются.
У них иной, чем у человека, аминокислотный
состав. Зачастую в животных белках нет
нужных аминокислот. В растительных
белках нет семи незаменимых аминокислот,
без которых не могут строиться белки
человека (лизин (альфа,эпсилон-диаминокапроновая
кислота, диаминомонокарбоновая
аминокислота. Молекулярная масса 146.
Входит в состав почти всех белков, в
малом количестве содержится в белках
злаков. Незаменимая аминокислота, не
синтезируется в организме человека и
животных), триптофан (бета-(бета-индолил)-
альфа-аминопропионовая кислота,
ароматическая аминокислота. L-триптофан
входит в состав гамма-глобулинов,
фибриногена и других белков. Из продуктов
распада L-триптофана образуется
никотиновая кислота и серотонин, у
растений –гетероауксин. В растениях и
микроорганизмах триптофан синтезируется
конденсацией серина и индола. L-триптофан
незаменимая аминокислота. Суточная
потребность человека составляет 0,25 г,
у детей – около 1 г. Недостаток триптофана
может быть связан с туберкулезом,
диабетом, раком. Для повышения пищевой
ценности белков в них добавляют
триптофан), метионин
(альфа-амино-гамма-метилтиомасляная
кислота,монокарбоновая аминокислота,
содержащая серу. D- и L-формы равноценны,
т.к.способны к взаимному превращению.
L-метионин входит в состав большинства
белков растительного и животного
происхождения. Является донором метильных
групп при образовании холина, адреналина
и других биологически активных веществ.
Служит источником серы при биосинтезе
аминокислоты цистеина.Образуется из
аспарагиновой кислоты только в клетках
растений и некоторых микроорганизмов,
у млекопитающих образуется из гомоцистеина.
Незаменимая аминокислота, суточная
потребность человека составляет 2,5-3 г.
Недостаток метионина приводит к нарушению
биосинтеза белков, замедлению роста и
развития организма, тяжелым функциональным
расстройствам), цистин(серосодержащая
незаменимая аминокислота SH(CH2)C(NH2)COOH),
валин (альфа-аминоизовалериановая
кислота.(СН3)2СНСН(NH2)–COOH Одна из незаменимых
аминокислот. Входит в составмногих
белков), лейцин (аминоизокапроновая
кислота, моноаминомонокарбоновая.
кислота,входит в состав всех белков
животных и растений, является незаменимой
аминокислотой, так как в организме
человека не может синтезироваться),
изолейцин (альфа-амино-бета-валериановая
кислота. Аминокислота, относится к
числу алифатических моноаминокислот
с разветвленной углеродной цепью),
особенно дефецитен лизин.
Применение микробного белка
Основные компоненты пищи человека-белки ( [Proteins] – высокомолекулярные органические вещества, построенные из аминокислот. В качестве ферментов играют важную роль в химических процессах, протекающих в клетке. Белки являются также основными структурообразующими элементами клетки. Они входят в состав сложных клеточных структур — органелл), жиры (сложные эфиры глицерина (триглицериды) и одноосновных жирных кислот. Один из главных компонентов клеток животных, растений и микроорганизмов), углеводы ( [Carbohydrates] – органические соединения, входящие в состав всех живых организмов. Первоначально считалось, что общая формула углеводов Сm(H2O)n, (углерод+вода). Другое название углеводов – сахара – связано с тем, что наиболее распространенными углеводами являются глюкоза, фруктоза, сахароза и др.); из них наиболее дефицитны белки-2/3 населения земного шара страдает от недостатка белка в пищи. Каждый тип белка как источник питания имеет 2 основные характеристики: перевариваемость и сбалансированность по аминокислотному составу (наличие незаменимых аминокислот (аминокислоты, которые не могут синтезироваться организмом человека и должны поступать в организм с пищей). Идеальным является белок куриного яйца и казеина молока.
Белковые концентраты, пасты, порошки иногда имеют пометку SCP ( Single cell protein). Это означает, что в них содержаться неживые высушенные микроскопические клетки водорослей, дрожжей, грибов, бактерий.
Микробный белок применяется:
- в виде добавок в консервы
- как белковая и вкусовая добавка в составе сухих пищевых концентратов
- как белковые добавки в хлеб и кондитерские изделия
- как белковые добавки в колбасу и сосиски
- как вкусовая добавка в плавленый сыр
Грибной белок (микопротеин). Микопротеин – это пищевой продукт, состоящий в основном из мицелия гриба. При его производстве используется штамм Fusarium graminearum, выделенный из почвы. Микопротеин производят сегодня на опытной установке методом непрерывного выращивания. В качестве субстрата используется глюкоза и другие питательные вещества, а источниками азота служат аммиак и аммонийные соли. После завершения стадии ферментации культуру подвергают термообработке для уменьшения содержания рибонуклеиновой кислоты, а затем отделяют мицелий методом вакуумного фильтрования. Если сопоставить производство микопротеина с процессом синтеза белков животных, то выявится ряд его преимуществ. Помимо того, что здесь выше скорость роста, превращение субстрата в белок происходит несравненно эффективнее, чем при усвоении пищи домашними животными. Это отражено в таблице 1. Нелишне напомнить, что корма для животных должны содержать некоторое количество белка, до 15-20% в зависимости от вида животных и способа их содержания. Положительным фактором является и волокнистое строение выращенной культуры; текстура массы мицелия близка к таковой у естественных продуктов, поэтому у продукта может быть имитирована текстура мяса, а за счет добавок – его вкус и цвет. Плотность продукта зависит от длины гиф выращенного гриба, которая определяется скоростью роста.
Таблица 1. Эффективность конверсии при образовании белка для различных животных и Fusarium graminearum.
|
Исходный продукт |
Продукция |
|
Белок, г |
Общая, г |
||
Корова |
1 кг корма |
14 |
68 говядины |
Свинья |
1 кг корма |
41 |
200 свинины |
Курица |
1 кг корма |
49 |
240 мяса |
Fusarium graminearum |
1 кг углеводов + неорганический азот |
136 |
1080 клеточной массы |
После проведения всесторонних исследований питательной ценности и безвредности микопротеина министерство сельского хозяйства, рыболовства и пищевых продуктов дало разрешение на его продажу в Англии. Содержание питательных веществ в нем указано в таблице 2.
Таблица 2. Средний состав микопротеина и сравнение его с составом говядины.
Компоненты |
Состав, % (на сухой вес) |
|
микопротеин |
бифштекс |
|
Белки |
47 |
68 |
Жиры |
14 |
30 |
Пищевые волокна |
25 |
Следы |
Углеводы |
10 |
0 |
Зола |
3 |
2 |
РНК |
1 |
Следы |
Лекция 9. Получение витаминов. Биологическая роль витаминов, их применение в пищевой промышленности. Витамин В12 (биосинтез витамина В12, продуценты витамина В12, получение и применение витамина В12). Рибофлавин, продуценты рибофлавина, получение и применение витамина В2.
Получение витаминов. Биологическая роль витаминов, их применение в пищевой промышленности
Среди биологически
активных веществ, необходимых для
нормального
развития организма животных, одно из
первых мест
занимают витамины. Важное значение
витаминов объясняется
их участием во многих биохимических
реакциях, способностью
служить катализаторами многих процессов,
обеспечивающих обмен веществ в
организме и его связь с окружающей
средой.
Промышленное
производство витаминов длительное
время было
основано на их извлечении из натурального
сырья, а это связано с большими расходами
ценных пищевых продуктов. Например,
витамин B![]() получали из сырой печени крупного
рогатого
скота, р-каротин — из моркови. В дальнейшем
были разработаны методы химического
синтеза ряда витаминов. Однако химический
синтез витаминов представляет собой
сложный, многоступенчатый
процесс, сопряженный с большими
производственными
затратами, что делает конечные продукты
слишком дорогими.
Этот способ получения сохраняется в
производстве медицинских
витаминных препаратов. Использование
витаминов в качестве добавок в корма
животных
требует крупномасштабного производства,
поэтому возникла
необходимость в более дешевых способах
изготовления витаминов.
Таким перспективным способом получения
ряда витаминов оказался микробиологический
синтез.
получали из сырой печени крупного
рогатого
скота, р-каротин — из моркови. В дальнейшем
были разработаны методы химического
синтеза ряда витаминов. Однако химический
синтез витаминов представляет собой
сложный, многоступенчатый
процесс, сопряженный с большими
производственными
затратами, что делает конечные продукты
слишком дорогими.
Этот способ получения сохраняется в
производстве медицинских
витаминных препаратов. Использование
витаминов в качестве добавок в корма
животных
требует крупномасштабного производства,
поэтому возникла
необходимость в более дешевых способах
изготовления витаминов.
Таким перспективным способом получения
ряда витаминов оказался микробиологический
синтез.
Для нормальной деятельности организма животных и птиц необходимо включать в рационы витамины A, D2 и D3, К, группы В и др. Микробиологическая промышленность нашей страны выпускает кормовые препараты витаминов В2 и Bi2. Кроме того, микробиологическим можно считать и производство витамина D2, который образуется из эргостерина при облучении УФ- светом кормовых дрожжей. Микроорганизмы содержат много витаминов, которые чаще всего входят в состав ферментов. Состав и количество витаминов в биомассе зависят от биологических свойств данной культуры микроорганизмов и условий культивирования. Так, кормовые дрожжи, получаемые на гидролизатах древесины и углеводородах, сравнительно богаты витаминами группы В. Они содержат следующие витамины группы В, мкг/г (в расчете на сухую биомассу):
Тиамин 15—18 Инозит 400—5000
Рибофлавин (В2) 45—68 Фолиевая кислота 3,4—21,5
Биотин 1,6—3,0 Никотиновая кислота 440—610
Изменяя состав питательной среды, содержание отдельных витаминов можно увеличить. Например, количество витамина В2 (рибофлавина) в биомассе дрожжей зависит от интенсивности аэрации и содержания железа в среде. На содержание витаминов в клетках дрожжей заметное влияние оказывают микроэлементы. Так, небольшие добавки марганца способствуют накоплению в клетках дрожжей инозита, а повышенные дозы кобальта приводят к увеличению содержания витамина В6 (пиридоксина). В природе источниками витаминов являются главным образом растения и микроорганизмы. Менахиноны и кобаламины синтезируются исключительно микроорганизмами. И хотя химический синтез в производстве большей части витаминов занимает ведущее положение, микробиологические методы также имеют большое практическое значение. Микробиологическим путем получают эргостерин, витамин В12, B, D. Кроме того, микроорганизмы используются как селективные окислители сорбита в сорбозу (при получении витамина С), а также для производства витаминных концентратов (витамина В2, каротиноидов). Перспективно микробиологическое получение биотина, используемого в рационе кур и свиней.
В мире существует 40 крупных промышленных производителей витаминов; 18 из них - в США, 8 - в Японии, 14 - в Западной Европе. Ведущее место в производстве витаминов занимает швейцарский концерн Hoffman La Roche, выпускающий 50 - 70 % всех витаминов от мирового европейского производства.
Витамин В12 (биосинтез витамина В12, продуценты витамина В12, получение и применение витамина В12)
Витамин В12 (цианкобаламин) занимает особое место среди витаминов, так как он полностью отсутствует в растительных кормах и в относительно небольших количествах содержится в кормах животного происхождения (рыбной и мясо-костной муке, молочных отходах). Недостаток витамина Bi2 в организме тормозит рост животных, приводит к серьезным заболеваниям. Витамин В12 обладает также очень ценным биологическим свойством повышать у животных усвояемость белка растительных кормов. Среди неполимерных соединений витамин В12 имеет самое сложное строение. Это α (5,6-диметилбензимидазол) - кобамидцианид или цианкобаламин. В молекуле витамина В12 различают: порфириноподобное, хромофорное или корриновое кольцо, связанное с атомом кобальта четырьмя координационными связями через атомы азота.Верхним координационным лигандом кобальта в витамине В12 является цианогруппа. Ее место могут занимать другие неорганические или органические заместители, например, NO22- SO22-, ОН-, Н2О, СН3, аденозил; заместители определяют название производных витамина В12. Шестая позиция кобальта занята нуклеотидным ядром (нижним лигандом кобальта), состоящим из азотистого основания, рибозы и остатка фосфорной кислоты. Нуклеотидное ядро связано с кобальтом через азот основания, а с корриновым кольцом - через аминопропаноловый мостик.
|
Продуценты витамина B12. В природе витамин В12 и родственные корриноидные соединения находят в клетках микроорганизмов, в тканях животных и некоторых высших растениях (горох, лотос, побеги бамбука, листья и стручки фасоли). Однако происхождение витамина В12 в высших растениях окончательно не установлено. Такие низшие эукариоты, как дрожжи и мицелиальные грибы, корриноиды, по-видимому, не образуют. Организм животных не способен к самостоятельному синтезу витамина. Среди прокариот способность к биосинтезу корриноидов широко распространена. Активно продуцируют витамин В12 представители рода Propionibacterium. Природные штаммы пропионовокислых бактерий образуют 1,0—8,5 мг/л корриноидов, но получен мутант P. shermanii M.- 82, с помощью которого получают до 58 мг/л витамина. В семействе Propionibacteriaceae есть и другие представители, способные к высокому накоплению витаминами В12 в клетках. Это, прежде всего, Eubacterium limosum (Batyribacterium retteerii). Как продуценты витамина практический интерес имеют многие представители актиномицетов и родственных микроорганизмов. Истинный витамин В12 в значительных количествах синтезирует Nocardia rugosa. Путем мутаций и отбора получен штамм N. rugosa, накапливающий до 18 мг/л витамина В12. Активные продуценты витамина обнаружены среди представителей рода Micromonospora: M. purpureae, M. echinospora, M. halophitica, M. fusca, M. chalceae. Высокой кобаламинсинтезирующей активностью обладают метаногенные бактерии, например, Methanosarcina barkeri, M. vacuolata и отдельные штаммы галофильного вида Methanococcus halophilus. Последний организм синтезирует более 16 мг корриноидов на грамм биомассы. Столь высокого содержания корриноидов не отмечено ни у одного другого из изученных микроорганизмов. Причина высокого содержания корриноидов у метаногенных бактерий не установлена. Корриноиды синтезируют строго анаэробные бактерии из рода клостридий. У Clostridium tetanomorphum и Cl. Sticklandii аденозилкобаламин входит в состав ферментных систем, катализирующих специфические реакции изомеризации таких аминокислот, как глутаминовая, лизин и орнитин. В значительных количествах образуют витамин В12 ацетогенные клостридии Cl. thermoaceticum, Cl. formicoaceticum и Acetobacter woodi, синтезирующие ацетат из СО2. Известны активные продуценты витамина B12 у псевдомонад, среди которых лучше других изучен штамм Pseudomonas denitrificans MB-2436 - мутант, дающий на оптимизированной среде до 59 мг/л корриноидов. Корриноиды синтезируют Rhodopseudomonas, фототрофные пурпурные бактерии Rhodobacter sphericus , Rh. Capsulatus, Rhodospirillum rubrum, Chromatium vinosum и ряд других видов. Наряду с витамином В12 они образуют бескобальтовые корриноиды, роль которых для продуцентов не установлена. Значительные количества витамина В12 образует цианобактерия Anabaena cylindrica, одноклеточные зеленые водоросли Chlorella pyrenoidosae и красные водоросли Rhodosorus marinus. Продуценты витамина B12 культивируют в средах, приготовленных на основе пищевого сырья: соевой муки, рыбной муки, мясного и кукурузного экстракта. В последние годы выявлены микроорганизмы, образующие высокие качества корриноидов при утилизации непищевого сырья. Единственным способом получения витамина B в промышленных масштабах является микробиологический синтез. В природе витамин В12 синтезируют многие микроорганизмы (например, метанобразующие и пропионовокислые бактерии), а также биоценоз бактерий, осуществляющих термофильное метановое сбраживание сточных вод. В клетках микроорганизмов встречается около 30 аналогов витамина B , однако биологическую активность проявляют только два из них. Витамин B — единственный витамин, в структуру которого входит кобальт. На большинстве зарубежных предприятий витамин B выпускают в чистом кристаллическом виде. В СНГ в промышленных масштабах выпускают кормовой концентрат витамина B (КМБ-12). Многочисленными опытами на животных установлена высокая биологическая эффективность как кристаллического препарата витамина B , так и его кормовых концентратов.
Сырьем для получения витамина B служит ацетонобутиловая барда — отход микробиологического производства ацетона и бутилового спирта.
Производство витамина B . Технологический процесс производства витамина B состоит из следующих основных стадий:
сбраживание ацетонобутиловой барды;
стабилизация метановой бражки;
сгущение бражки;
сушка сгущенной бражки;
фасовка и упаковка
Термофильное метановое брожение осуществляется смешанной культурой анаэробных бактерий. При их совместном выращивании происходит непрерывное брожение за счет взаимосвязанных процессов. При этом продукты жизнедеятельности одной группы бактерий используются в качестве питательных веществ для другой группы и в конечном счете органические вещества разлагаются до углекислого газа и метана; образуется витамин B .Непрерывное термофильное метановое брожение смешанной культуры проводят в ферментаторе в нестерильных условиях при температуре 55—57 °С. Ацетонобутиловая барда из емкости, в которой осаждаются взвешенные частицы, подается в нижнюю часть ферментатора, а сверху отбирается готовая бражка. Метановое брожение в ферментаторе протекает в две фазы. В первой фазе происходит образование жирных кислот и аммиака, а во второй — метана, диоксида углерода и витамина B . Метановая бражка имеет слабощелочную среду (рН 7,5— 8,0), в которой витамин B может, разрушаться. Во избежание этого к бражке добавляют различные стабилизаторы (соляную и фосфорную кислоты, сульфит натрия), поддерживая рН среды в пределах 6,3—6,5. Для интенсификации синтеза витамина B в ферментатор вносят хлорид кобальта до концентрации кобальта 4 г/м3 и добавляют метиловый спирт из расчета 5 л на 1 м3 бражки. Продолжительность процесса брожения в одном ферментаторе составляет 2,5—3,5 сут, а в двух последовательно соединенных аппаратах — 2,0—2,5 сут. Процесс метанового брожения сопровождается выделением значительного количества газа (20 м3/м3), состоящего в основном из метана (65%) и диоксида углерода (30%). Процесс газообразования усиливается при подкислении, стабилизации и нагревании бражки перед упариванием, что вызывает обильное пенообразование, а следовательно, требует подачи пеногасителей. Метановая бражка из ферментатора поступает в выпарной аппарат, в котором происходит сгущение до содержания сухих веществ 20%. Сгущенную бражку высушивают в распылительной сушилке до содержания сухих веществ 94%. В качестве теплоносителя используют газы, получаемые при сжигании природного газа и газов, выделяемых в процессе метанового брожения.
Рибофлавин, продуценты рибофлавина, получение и применение витамина В2
Рибофлавин (витамин В2, 7,8-диметил-10-(1-D-рибитил-изоаллоксазин) выделен в кристаллическом виде в 1933 г. В основе строения флавинов, к которым относится рибофлавин, лежит гетероциклическая изоаллоксазиновая система, представленная тремя конденсированными циклами: ароматическим (А), пиразиновым (В) и пиримидиновым (С). К азоту пиразинового кольца присоединен спирт рибит. Рибофлавин функционирует в коэнзимных формах, представляющих собой его фосфорные эфиры: флавиномононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). В последние десятилетия открыты новые биокаталитические факторы изоаллоксазиновой структуры, функциональные группы которых представлены модифицированными молекулами РФ, ФМН, ФАД. Новые природные аналоги РФ входят в состав простетических групп многих флавопротеидов.
Продуценты рибофлавина.Продуцентами рибофлавина в природе являются высшие растения, дрожжи, мицелиальные грибы и бактерии. Большинство микроорганизмов образует свободный рибофлавин и две его коферментные формы - ФМН и ФАД. Из многих бактерий и плесневых грибов выделены аналоги РФ и их коферментные формы. Основной формой флавинов, выделяемых микроорганизмами в среду, является РФ. Среди прокариот флавиногенной группой считают микобактерии и ацетонобутиловые бактерии. Из актиномицетов значительные количества РФ синтезируют Nocardia eritropolis. Среди плесневых грибов наиболее активные продуценты рибофлавина - грибы рода Aspergillus и вид A. niger. Использование мицелия грибов как препарата флавинов экономично: мицелий является отходом антибиотической промышленности. Активные продуценты рибофлавина Eremothecium ashbyii, Ashbyii gossupii, образующие игольчатые аскоспоры, дрожжеподобные грибы, входящие в класс Ascomycetes, порядок Endomycetales, семейства Spermophtoraceae. Описан ряд способов получения кормовых и кристаллических препаратов РФ с использованием указанных микроорганизмов.
Получение и применение рибофлавина. Кормовой концентрат РФ получают с помощью гриба Eremothecium ashbyii. Недостаток культуры Е. ashbyii - ее нестабильность: при хранении на твердых средах при комнатной, низкой температуре и даже в процессе лиофилизации гриб легко теряет способность к сверхсинтезу РФ. Для сохранения штамма Е. ashbyii в активном состоянии в течение длительного времени (8 - 10 месяцев) рекомендуется производить систематический рассев на твердые питательные среды и отбирать наиболее интенсивно окрашенные в оранжевый цвет колонии. Яркая окраска колоний коррелирует с высокой рибофлавин-синтетической способностью. При подготовке инокулята гриб пересевают последовательно по схеме: посев на скошенную агаризованную среду в пробирке → в жидкую среду → в колбы → в бутыли → в инокулятор. Среда для пробирок содержит соевую муку, свекловичный сахар, агар, рН 6,8 (1-й вариант) или дрожжевой экстракт, пептон, глюкозу, агар, рН 6,8 (2-й вариант). Время выращивания 5-7 суток.
Культивирование в ферментере ведут до начала лизиса клеток и появления спор (определяют микроскопически). Температура культивирования 28-30°С, давление воздуха в ферментере (1-2)104 Па, расход воздуха 1,5-2,0 л в минуту на 1 л культуральной жидкости. Выход РФ - около 1200 мкг/мл. Для получения кормового препарата РФ культуральную жидкость упаривают под вакуумом до содержания 39 – 40 % сухих веществ.
Лекция 10. Получение ферментов. Основные группы ферментных препаратов, используемых в пищевой индустрии. Микроорганизмы – продуценты ферментных препаратов. Особенности ферментов микроорганизмов. Сущность технологического процесса производства ферментных препаратов.
Получение ферментов. Основные группы ферментных препаратов, используемых в пищевой индустрии. Микроорганизмы – продуценты ферментных препаратов. Особенности ферментов микроорганизмов.
Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток, поэтому их традиционно широко применяют в практике. Биологические катализаторы нетоксичны, работают в мягких условиях, используют доступное сырье (в том числе и отходы), в связи с чем их применение в промышленности выгодно с экономической и экологической точек зрения. По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из более чем 2000 известных в настоящее время ферментов в промышленности используется около 30. Основная часть ферментов, поступающих на мировой рынок, приходится на долю гидролаз, из которых 60 % составляют пептидогидролазы (в основном щелочные и нейтральные протеазы), использующиеся в качестве детергентов в производстве синтетических моющих средств, а 30 % — гликозидазы, применяющиеся в производстве кондитерских изделий, фруктовых и овощных соков. Ферменты находят применение в текстильной, кожевенной, целлюлозо-бумажной, медицинской, химической промышленности (табл. 4.1). По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают глюкоизомераза и глюкоамилаза, применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50 % рынка пищевых энзиматических препаратов. Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих коферменты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление а-ке-токислот в а-гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфата зу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу.
Применение ферментов
Название и шифр фермента |
Источники фермента |
Химический и биотехнологический процессы. Область использования |
Амилазы |
Бактерии, грибы |
Гидролиз крахмала до декстри- |
(КФ 3.2.1.1 |
(Bacillus sp., Aspergil- |
нов, мальтозы и глюкозы. Спир- |
КФЗ.2.1.2 |
lus niger, A. oryzae) |
товая, пивоваренная промыш- |
КФ 3.2.1.3) |
|
ленность, хлебопечение, получение патоки, глюкозы |
Глюкоизоме- |
Более 80 видов мик- |
Изомеризация D-глюкозы в |
раза |
роорганизмов {Bacillus |
D-фруктозу. Кондитерская, ли- |
(КФ 5.3.1.18) |
sp., Streptomyces albus, |
кероводочная, безалкогольная |
|
S.griseus) |
промышленность, хлебопечение |
Глюкоокси- |
Penicillium chrysoge- |
Удаление кислорода и глюкозы |
даза |
num, P.casei, P.nigri- |
(из яичного порошка, мясных и |
(КФ 1.1.3.4) |
cans, P.notatum, P.vi- |
других продуктов). Виноделие, |
и каталаза |
tale, Aspergillus niger, |
пивоваренная, консервная, соко- |
(КФ 1.11.1.6) |
Corynebacterium ssp.) |
вая и безалкогольная промышленность |
Липазы |
Поджелудочные же- |
Гидролиз жиров и масел. |
(КФЗ. 1.1.3) |
лезы животных, семе- |
Пищевая, легкая, медицинская |
|
на растений, микро- |
промышленность, сельское хо- |
|
организмы {Candida |
зяйство, коммунальное хозяй- |
|
lipofytica, Streptomyces |
ство, бытовая химия |
|
flavogriseus, Aspergillus |
|
|
ssp., Saccharomyces |
|
|
lipofytica) |
|
Пектиназа |
Многие микроорга- |
Гидролиз галактуронана, освет- |
(КФ 3.2.1.15) |
низмы (Aspergillus ssp., Fusarium ssp., Peni-cillum ssp.и др.) |
ление вина и фруктовых соков |
Пептидогид- |
Поджелудочные желе- |
Лизис белка. Получение амино- |
ролазы |
зы и слизистая желуд- |
кислот, производство и получе- |
(КФ3.4) |
ка животных; плоды, |
ние сыра, мягчение мясных и |
|
побеги, отходы пере- |
рыбных изделий, выделка кожи, |
|
работки некоторых |
активизация пищеварения.Пиво- |
|
растений (дынное де- |
варение, виноделие, хлебопече- |
|
рево, инжир, ананас), |
ние, пищевая промышленность, |
|
микроорганизмы (Ba- |
сельское хозяйство, медицина |
|
cillus ssp., Aspergillus |
|
|
ssp., Penicillium ssp., |
|
|
Streptomyces ssp., Pseu- |
|
|
domonas ssp.) |
|
Целлюлазы |
Микроорганизмы: |
Гидролиз целлюлозы до глюко- |
(КФ 3.2.1.4) |
Clostridium ssp., |
зы. Производство пищевых и |
|
Trichoderma reesei, |
кормовых белковых препаратов, |
|
Т. viridae, Alternaria |
этанола, глюкозо -фруктозных |
|
tenuis, Aspergillus |
сиропов. Спиртовая, пивоварен- |
|
oryzae, Fusarium |
ная, пищеконцентратная про- |
|
culmorum |
мышленность, хлебопечение, кормопроизводство |
Фруктофура- |
Микроорганизмы: |
Инверсия сахарозы. Кондитер- |
нозидаза |
Aspergillus ssp., Penicil- |
ская, ликероводочная, безалко- |
(КФ 3.2.1.26) |
liumssp., Fusarium ssp., |
гольная промышленность, си- |
|
Cercospora beticola, |
ропопроизводство |
|
Bacillus subtilis, E. coli, |
|
|
Saccharomyces cerevisiae, |
|
|
Streptococcus mutans |
|
Применение сопряженных ферментативных реакций с участием алкогольоксидазы и каталазы дрожжей Hansenulla polimorpha и формальдегиддисмутазы бактерии Pseudomonas putida позволило осуществить окисление метанола в муравьиную кислоту с выходом 88 — 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе, в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре 100 °С.
В промышленности культуры микроорганизмов, в том числе и продуценты ферментов, выращивают либо способом поверхностного культивирования, либо способом глубинного культивирования. В соответствии с этим промышленно получаемым ферментным препаратам присваиваются буквенные обозначения Пх или Гх и цифровой индекс (2, 3, 10, 15, 20, 30), указывающий, в результате какой последовательности технологических операций был получен данный ферментный препарат. Продукты с цифровым индексом «2» обозначают технические ферментные препараты, которые получают в результате экстракции ферментов водой из культуры продуцента, выращенного поверхностным способом, с последующим упариванием водного экстракта или культуральной жидкости (в случае глубинного культивирования) до 50 % содержания сухих веществ. Препараты группы П3х и Г3х представляют собой высушенные до порошкообразного состояния продукты П2х и Г2х. Очищенные ферментные препараты группы П10х и Г10х получают осаждением органическим растворителем непосредственно из культуральной жидкости (Г10х) или из водного экстракта биомассы (П10х) при оптимальных для данного фермента условиях. Препараты группы П15х и Г15х выделяют из тех же водных растворов осаждением сульфатом аммония. П20х и Г20х готовят на основе препаратов П10х и Г15х, подвергая последние очистке методом ультрафильтрации. П30х и Г30х представляют собой высушенные после ультрафильтрационной обработки препараты группы П20х и Г20х. За единицу активности (Е или А) любого фермента принимают его количество, которое катализирует превращение одного микромоля субстрата за одну минуту при заданных стандартных условиях. Если количество субстрата не может быть выражено в микромолях (при отсутствии точного значения его молекулярной массы), то величину активности оценивают по количеству микроэквивалентов, участвующих в реакции групп. Например, при гидролизе белка расчет активности ведут не по числу гидролизованных микромолей вещества, а по количеству образовавшихся в ходе гидролиза свободных гидроксильных или аминогрупп, соответствующих числу расщепленных пептидных связей.
В качестве стандартной температуры при определении активности ферментных препаратов выбрано значение 30С. Концентрация фермента и субстрата, величина рН могут меняться в широком диапазоне значений при определении активности различных по своей природе ферментов, но для каждого из ферментов в оптимальных для него значениях. Для оценки мощности отдельных предприятий по выпуску данного ферментного препарата, их сравнения ввели понятие активности условного ферментного препарата. За одну условную тонну ферментного препарата принимают тонну препарата со стандартной активностью. Для пересчета выработанной товарной продукции в условные тонны пользуются соотношением:
Qy=![]()
где Qy - количество условного препарата, т.
Q т - количество товарного препарата, т.
Ау - активность условного препарата, ед.
Аф - фактическая активность товарного препарата, ед.
Для характеристики получаемых ферментных препаратов пользуются двумя номенклатурами – систематической и тривиальной. Систематическое название содержит информацию о природе химической реакции, катализируемой данным ферментом. Оно состоит из двух частей. Первая часть включает в себя название используемого субстрата, а для биомолекулярных реакций – названия субстратов, разделяемых двоеточием. Вторая часть с окончанием «-аза» называют природу катализируемой биохимической реакции. Если биохимическое превращение состоит из двух катализируемых реакций, например, окислительное дезаминирование, то вторую функцию указывают в круглых скобках. Тривиальное название более употребимо, в основном, по причине его краткости. Оно также включает название субстрата и катализируемую ферментом реакцию. Присоединение окончание «-аза» к назначению субстрата обозначает гидролитический фермент. Название ферментных препаратов, полученных микробиологическим синтезом, формируют из сокращенного обозначения основного фермента и видового названия продуцента, например: амилосубтилин, протосубтилин, пектавоморин.
Таблица 1- Характеристики названий получаемых ферментных препаратов
Реакция |
Систематическое название |
Тривиальное название |
L-Аланин + Н2О +
НАД+ |
L- Аланин: НАД- оксиредуктаза (дезаминирующая) |
L- Аланин- гидрогеназа |
АТФ + D - гексоза АТФ + D - гексоза -6 - фосфат |
АТФ: D- гексоза- 6- фосфотрансфераза |
Гексокиназа |
Сущность технологического процесса производства ферментных препаратов
Технология получения ферментных препаратов микробным синтезом обязательно включает в себя стадию промышленного культивирования соответствующего микроорганизма. В условиях промышленного производства значительное количество продуцента получают одним из следующих двух способов.
- культивирование на твердых питательных средах (поверхностный способ выращивания продуцента);
- культивирование соответствующего продуцента в большом объеме жидкой фазы, содержащей все необходимые для нормального роста и развития микроорганизма питательные вещества (глубинный способ выращивания продуцента).
Для любого микробиологического производства всегда необходима исходная культура продуцента, которая не отличается высокой стабильностью при хранении. Поэтому предприятие один раз в 2 - 3 месяца получает «чистую» культуру в количестве трех пробирок из специальной лаборатории отраслевого научно- исследовательского института. При этом пробирку с исходным продуцентом расходуют на размножение исходного штамма, вторую используют для организации микробиологического контроля за исходным штаммом- продуцентом, третью оставляют в резерве. В зависимости от условий хранения производят периодические посевы исходной культуры, обязательно сопровождающиеся микробиологическим контролем. В процессе пересева стараются перенести на новую питательную среду споры или мицелий без остатков старой питательной среды. При этом вновь полученные косяки хранят при температуре 3 - 4С. Для длительного хранения используют следующие методы:
- хранение под слоем вазелинового масла. Сохраняемую таким образом культуру подвергаю пересеву 1-2 раза в год;
- хранение в ампулах в 10 % водном растворе глицерина в атмосфере жидкого азота. Возможный срок хранения - до 5-ти лет;
- хранение в лиофильно - высушенном состоянии. Для этого культуру в асептических условиях замораживают при температуре минус 35С, затем высушивают в вакууме, постепенно повышая температуру до 20С в течении 25 -30 ч, ампулы запаивают. В таком виде культура храниться в течение 5 - 6 лет без потери активности;
- хранение на зерне. Для этого в распаренное зерно, как правило, пшено, заливают микробную суспензию, выращивают при температуре 30С, затем высушивают и закрывают;
- хранение в стерильной почве. Используется для хранения актиномицетов.
В производственных условиях выращивание основного продуцента проводят в несколько стадий, число которых не превышает 4-х.
Поверхностное культивирование
Культивирование продуцентов ферментов на твердых питательных средах или как его еще называют, процесс получения продуцента ферментов поверхностным способом, осуществляется по типовой технологической схеме (рисунок 1). Субстрат лифтом (норией) 1 подают в тележку 2, из нее на дозирующие весы 3, далее в стерилизатор питательной среды 4, который одновременно может являться и смесителем. В нем происходит предварительная подготовка питательной среды и засев ее культурой соответствующего микроорганизма. Исходный посевной материал готовят на предприятии в отделении «чистой» культуры. Для этой цели используют дозатор питательной среды 5, стерилизатор среды 6, аппарат для засева кювет 7, камеру для выращивания посевного материала 8, дозатор посевного материала 9. Среду с посевным материалом направляют на раздаточный стол 10, на котором кюветы загружают с помощью механических дозаторов. Перед каждой загрузкой кюветы моют в ванне 11 и стерилизуют паром в камере 12.
Производственную культуру выращивают в растильных камерах 13. Для снабжения растущих клеток кислородом и отвода выделяющегося в ходе ферментации тепла в камеры подают стерильный воздух. Основные субстраты, используемые при культивировании ферментных препаратов на твердых питательных средах. В качестве субстратов, используемых при культивировании ферментных препаратов на твердых питательных средах. Применяют. Как правило, нестандартное сырье – отходы пищевой промышленности. Среди них наиболее часто используют:
- пшеничные отруби в производстве амилаз и протеаз;
- свекловичный жом в производстве пектолитических ферментов;
- солодовые ростки представляют собой корешки проросшего ячменя;
- древесные опилки используют в основном, для разрыхления какого-либо субстрата;
- шелуха некоторых сельскохозяйственных культур, например риса, гречихи и подсолнуха.
На основе этих субстратов готовят соответствующие питательные среды. Для этого используют специальные емкости или непосредственно сами аппараты-стерилизаторы. Первоначально осуществляют смешение необходимых твердых компонентов, затем их увлажняют и подкисляют соляной кислотой для достижения более высокого эффекта при последующей стадии стерилизации полученной смеси. Завершают формирование питательных средств путем введения дополнительных источников азота и прочих ростовых факторов.
Простерилизованная питательная среда является исходным субстратом, на котором выращивают необходимое количество посевного материала. В зависимости от индивидуальных особенностей продуцента посевной материал получают в трех видах:
- в виде культуры гриба;
- в виде спор или конидии;
- в виде мицелиальной массы на жидкой питательной среде.
Получение посевного материала в виде культуры гриба проводят по следующей схеме: получение маточной культуры в пробирках на косяках выращивание культуры гриба в колбах малого размера на отрубях выращивание культуры гриба на отрубях в колбах большого размера выращивание культуры гриба на отрубях в посевных кюветах выращивание культуры гриба на отрубях в производственных кюветах. Получаемый по такой технологии посевной материал должен содержать не менее 0,7 млрд. клеток/г со всхожестью 85 - 90 %. Присутствие микрофлоры не допускается. Выращивание спорового посевного материала на жидких питательных средах проводят в термостатируемой камере. Культура микроорганизма вырастает в виде пленки. По завершении стадии спорообразования жидкость из-под пленок сливают, а пленки высушивают в токе сухого воздуха, после размельчают и транспортируют с помощью шнекового устройства на стадию расфасовки.
Посевной материал в виде мицелиальной массы на жидкой питательной среде получают по следующей схеме:
- получение маточной культуры в пробирках на косяках выращивание культуры в колбах (на 250 мл) на тонком слое отрубей выращивание культуры в колбах (на 4 - 8 л) на качалке с жидкой питательной средой (солодовое сусло).
Данный способ получения посевного материала обладает следующими преимуществами:
- время выращивания сокращается в 2 - 3 раза;
- сокращается производственная площадь, необходимая для организации отделения чистой культуры;
- улучшаются условия труда работающих ввиду значительного снижения запыленности производственных помещений.
Однако данному способу получения посевного материала присущи и ряд недостатков:
- значительная трудоемкость проводимых технологических операций, что позволяет использовать его в организации только небольших производств;
- использование такого посевного материала на стадии промышленной ферментации приводит к увеличению лаг - фазы основного процесса. Последнее повышает вероятность инфицирования среды.
Микробиологическому контролю исходная культура микроорганизма подвергается на всех стадиях производства. К ней предъявляют следующие требования:
Рисунок 1 - Принципиальная типовая технологическая схема культивирования продуцентов ферментных препаратов на твердых питательных средах: 1 – нория; 2 – тележка для перевозки субстрата; 3 – дозирующие весы; 4 – стерилизатор питательной среды; 5 – дозатор питательной среды; 6 – стерилизатор питательной среды; 7 – аппарат для засева кювет; 8 – камера для выращивания посевного материала; 9 – дозатор посевного материала; 10 – раздаточный стол; 11 – ванна для мытья кювет; 12 – камера для стерилизации кювет; 13 – растильные камеры.
|
- единица массы посевного материала должна содержать требуемое количество спор.
Целью биохимического контроля процесса является определение ферментативной активности полученного продуцента. Посевной материал считается пригодным для засева основных препаратов, если он обеспечивает при нормальной длительности культивирования на производственной среде необходимое по паспорту накопление целевого фермента или нужной ферментативной активности.
На скорость роста клеток и процесс биосинтеза целевого фермента оказывают влияние ряд факторов. Это, прежде всего:
- дозировка и возраст посевного материала. Количество посевного материала стараются брать минимальным. Обычно оно составляет 0,02 - 0,1 % от массы питательной среды. В заводских условиях это количество увеличивают до уровня 0,5 - 1,0 %;
- возраст посевного материала оценивается по числу содержащихся в нем конидий. Чем моложе посевной материал, тем меньше в нем конидий;
- состав питательной среды. Состав питательной среды оказывает очень сильное влияние на биосинтез того или иного фермента. Кроме того, питательная среда должна быть сбалансированной по традиционным источникам углевода, азота, макро- и микроэлементам. В зависимости от состава все среды делятся на простые (синтетические) и сложные (комплексные);
- условия стерилизации питательной среды. Режим стерилизации питательной среды выбирают на основании результатов микробиологического контроля на присутствие посторонней микрофлоры;
- режим подачи воздуха. Поскольку практически все продуценты ферментных препаратов являются аэробными, то кислород воздуха им, прежде всего, необходим для дыхания, для съема выделяющегося тепла в ходе культивирования. Очистка воздуха от пыли, и его стерилизация осуществляется на фильтрах по типовой схеме;
- выбор оптимальных условий культивирования продуцента. Влажность- параметр, определяющий способность культуры к спорообразованию и к биосинтезу ферментов. Регулируя значение рН, можно добиться преобладания одного из ферментов в получаемом комплексе. Температура влияет на скорость образования ферментов, причем для каждой группы ферментных систем существует свой температурный оптимум образования. Продолжительность культивирования, также имеет значение.
От этих параметров процесса зависит конечная цель производства - максимально возможная активность единицы массы ферментного препарата, получаемая в единицу времени. Основные способы высушивания биомассы грибов, выращенной на твердом субстрате. Биомассу грибов, выращенную на твердом субстрате, сушат после проведения процесса измельчения. Размельченный твердый субстрат имеет остаточную влажность 35 - 50 %. В таком материале достаточно быстро происходит нарастание температуры до 60 - 70С, что способствует инактивации полученных ферментов. Для предотвращения этого явления остаточная влажность твердой фазы должна быть не выше 10 - 12 %. Процесс сушки проводят обычно воздухом. При этом время высушивания не превышает 30 мин. Выбор режима сушки обусловлен, прежде всего, химическим составом среды и термолабильностью полученных ферментов. Большое влияние на активность ферментов оказывает также повышение концентрации солей при сушке. Их присутствие может вызвать инактивацию ферментов. В производственных условиях применяют ленточные, вибрационные, тоннельные и другие типы сушильных агрегатов. Однако наибольшее распространение получили барабанные сушилки.
Процессы дробления и сушки являются завершающими стадиями технологического процесса получения ферментных препаратов класса Пх. Сухой порошок упаковывают в крафт – мешки с полиэтиленовой прокладкой по 15 - 30 кг, снабжают этикеткой с указанием наименования препарата, даты его выпуска и активности.
Глубинное культивирование
Глубинный способ микробиологического получения ферментов имеет преимущества по сравнению с поверхностным, так как проходит в контролируемых условиях ферментации, исключает ручной труд, позволяет автоматизировать процесс. Питательная среда для ферментации готовится, исходя из физиологических потребностей используемой микробной культуры, а также из типа целевого фермента. Основным углеродным сырьем служат различные сорта крахмала (кукурузный, пшеничный, картофельный), кукурузный экстракт, свекловичный жом, а также глюкоза, мальтоза, декстрины. В качестве источника азота применяют органические соединения (гидролизаты казеина или микробных биомасс), а также минеральные соли (NaNO3, NH4NO3, NH4HPO4, (NH4)2SO4). Для биосинтеза целлюлолитических ферментов источником углерода служит хлопок, солома, целлюлоза; липолитических – липиды. На предферментационной стадии технологическое оборудование и питательная среда подвергаются стерилизации. После охлаждения среды до 30°С в нее вносят выращенный инокулят (2 - 5 % от объема производственной культуры). Процесс проводят в цилиндрических аппаратах объемом до 100 м3. Синтез фермента в глубинной культуре протекает в течение 3 - 4 суток при непрерывной подаче стерильного воздуха, стабилизации рН и температуры среды на строго определенных уровнях. Незначительные изменения значений данных параметров могут вызвать многократное снижение ферментативной активности. Процесс образования биомассы продуцента не совпадает во времени с максимумом продукции фермента, при этом условия для образования фермента могут существенно отличаться от условий для оптимального режима синтеза биомассы. Поэтому условия среды в ходе протекания процесса ферментации контролируются и изменяются. Известны стадийные процессы в двух последовательных аппаратах. В первом создают условия для развития мицелия; во втором – для синтеза и накопления фермента. На промышленном уровне реализованы также проточные режимы, например, для получения глюкозоизомеразы с использованием бактериальной культуры Bacillus coagulans. Ферментацию проводят при дефиците глюкозы и кислорода в среде (глюкозоизомераза ингибируется кислородом); максимальная продуктивность сохраняется длительное время, до 200 ч. После завершения ферментации для предотвращения инактивации ферментов культуральную жидкость охлаждают до 3 - 5С и направляют на обработку. После отделения мицелия культуральную среду освобождают от грубых взвешенных частиц и концентрируют под вакуумом или подвергают ультрафильтрации. В связи с термолабильностью многих ферментов процессы обработки ведут при контролируемых, часто пониженных температурах. Глубокая очистка ферментов приводит к существенной потере активности препаратов и также очень дорогостояща. Более того, высокоочищенные белки менее стабильны по сравнению с неочищенными. Поэтому при использовании растворимых ферментов редко пользуются полной очисткой. Тем более, что в зависимости от сферы применения, требования к чистоте ферментных препаратов различны. Так, ряд ферментных препаратов, получаемых при поверхностной ферментации, выпускают в виде высушенных отрубей с остатками мицелия, а также высушенных осадков белков или высушенных растворов. Товарные формы таких препаратов известны в виде сухих препаратов или растворов ферментов. Последние хранят при отрицательных температурах, с применением стабилизаторов (соли кальция или магния, а также хлорид натрия, сорбит, бензоат и др.). Для получения очищенных препаратов ферментов применяют различные методы (осаждение солями или органическими растворителями, высаливание, сорбционную и хроматографическую очистку с использованием высокоселективных ионитов). Процесс завершается стадией высушивания на распылительных или вакуумных аппаратах в щадящем температурном режиме, не допускающем больших потерь активности ферментов. После стандартизации продукт направляется потребителю.
Лекция 11. Получение аминокислот. Микроорганизмы – продуценты аминокислот – аспарагиновой, глутаминовой, лизина и др., применяющихся в пищевой промышленности. Биотехнология производства аминокислот.
Получение аминокислот. Микроорганизмы – продуценты аминокислот – аспарагиновой, глутаминовой, лизина и др., применяющихся в пищевой промышленности.
Среди соединений, получаемых биотехнологическими методами, аминокислоты занимают первое место по объему производства и второе место по стоимости, уступая антибиотикам. Объем мирового производства аминокислот составляет более 500 тыс. т в год, из которых 300 тыс. т приходится на глутамат натрия, 100 тыс. т - на лизин и 140 тыс. т - на метионин. По данным ВОЗ потребность человечества всего лишь в четырех незаменимых аминокислотах составляет, млн. т: для лизина - 5, метионина - 4, треонина - 3,7 и триптофана - 2. Аминокислоты - структурные единицы белков. Природные аминокислоты вовлечены в биосинтез ферментов, ряда гормонов, витаминов, антибиотиков, алкалоидов, токсинов и других азотсодержащих соединений. В организме животного практически половина белковых аминокислот не синтезируется. Они называются незаменимыми аминокислотами и должны поступать в организм с пищей. Недостаток каждой из этих аминокислот в пищевом или кормовом рационе приводит к нарушению обмена веществ, замедлению роста и развития. Сведения о ежедневной потребности человека в незаменимых аминокислотах представлены в таблице 1. Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
- глицин - подсластитель, антиоксидант, бактериостатик;
- аспарагиновая кислота - усилитель вкуса, сырье для синтеза аспартама;
- глутаминовая кислота - усилитель вкуса, препарат для лечения психических заболеваний;
- гистидин — противовоспалительное средство;
- метионин — пищевая и кормовая добавки;
- цистеин — фармацевтический препарат;
- треонин и триптофан — пищевые и кормовые добавки;
- фенилаланин — сырье для получения аспартама;
- лизин — пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок.
Таблица 1 - Потребность человека в незаменимых аминокислотах
Аминокислоты |
Потребность, мг/кг массы тела в сутки |
|
младенцы |
взрослые |
|
валин |
92 |
14 |
гистидин |
33 |
10 |
изолейцин |
83 |
12 |
лейцин |
135 |
16 |
лизин |
99 |
12 |
метионин (и цистеин) |
49 |
10 |
фенилаланин (и тирозин) |
141 |
16 |
треонин |
68 |
8 |
триптофан |
21 |
3 |
В промышленных масштабах белковые аминокислоты получают:
- гидролизом природного белоксодержащего сырья;
- химическим синтезом;
- микробиологическим синтезом;
- биотрансформацией предшественников аминокислот с помощью микроорганизмов или ферментов (химико-микробиологический метод).
При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 - 105 0С в течение 20 - 48 ч. Чаще всего используют 20 % раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10 - 30 %). Лучшим способом уменьшения потерь аминокислот при гидролизе является проведение его в вакууме или в атмосфере инертного газа.
Существенный недостаток методов химического синтеза аминокислот состоит в получении целевых препаратов в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-α-аминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза. Разделение рацематов других аминокислот - дорогая и чрезвычайно трудоемкая процедура. Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно таким способом, главное преимущество его в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основе возобновляемого сырья. В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, особенно с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем. Промышленное производство аминокислот стало возможным после открытия способности у некоторых микроорганизмов выделять в культуральную среду значительные количества какой-либо одной аминокислоты.
Таблица 2 - Микроорганизмы - продуценты аминокислот
Продуценты аминокислот |
Микроорганизмы |
Агринин |
Е. cоli. Bacillus subtilis, Corynebacterium glutamicum, Brevibacterium flavum, Serratia marcescens |
Гистидин |
B.flavum, C. glutamicum, S.marcescens, виды Steptomyces |
Изолейцин |
B.flavum, С glutamicum, B. subtilis, S. marcescens |
Лейцин |
Brevibacterium lactofermentum, S. marcescens, C. glutamicum |
Лизин |
B. flavum, С. glutamicum |
Фенилаланин |
B. flavum, С. glutamicum |
Пролин |
B. flavum |
Серин |
С. glutamicum |
Треонин |
В. flavum, С. Glutamicum, Arthrobacter parafinens, E. coli S. marcescens |
Триптофан |
Micrococcus, Candida utils, B. subtilis |
Тирозин |
B. flavum, С. glutamicum |
Валин |
B. flavum, С. glutamicum |
В России изыскания в области промышленного синтеза аминокислот были начаты в 50-х годах прошлого столетия по инициативе академика А.А. Александрова. Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Распространенные объекты селекции продуцентов - микроорганизмы, относящиеся к Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter (таблица 2).
