
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
Глава XII. Капиллярные явления
§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
Роль поверхностной энергии проявляется в появлении кривизны поверхности жидкости, уменьшающей площадь поверхности при данном объеме.
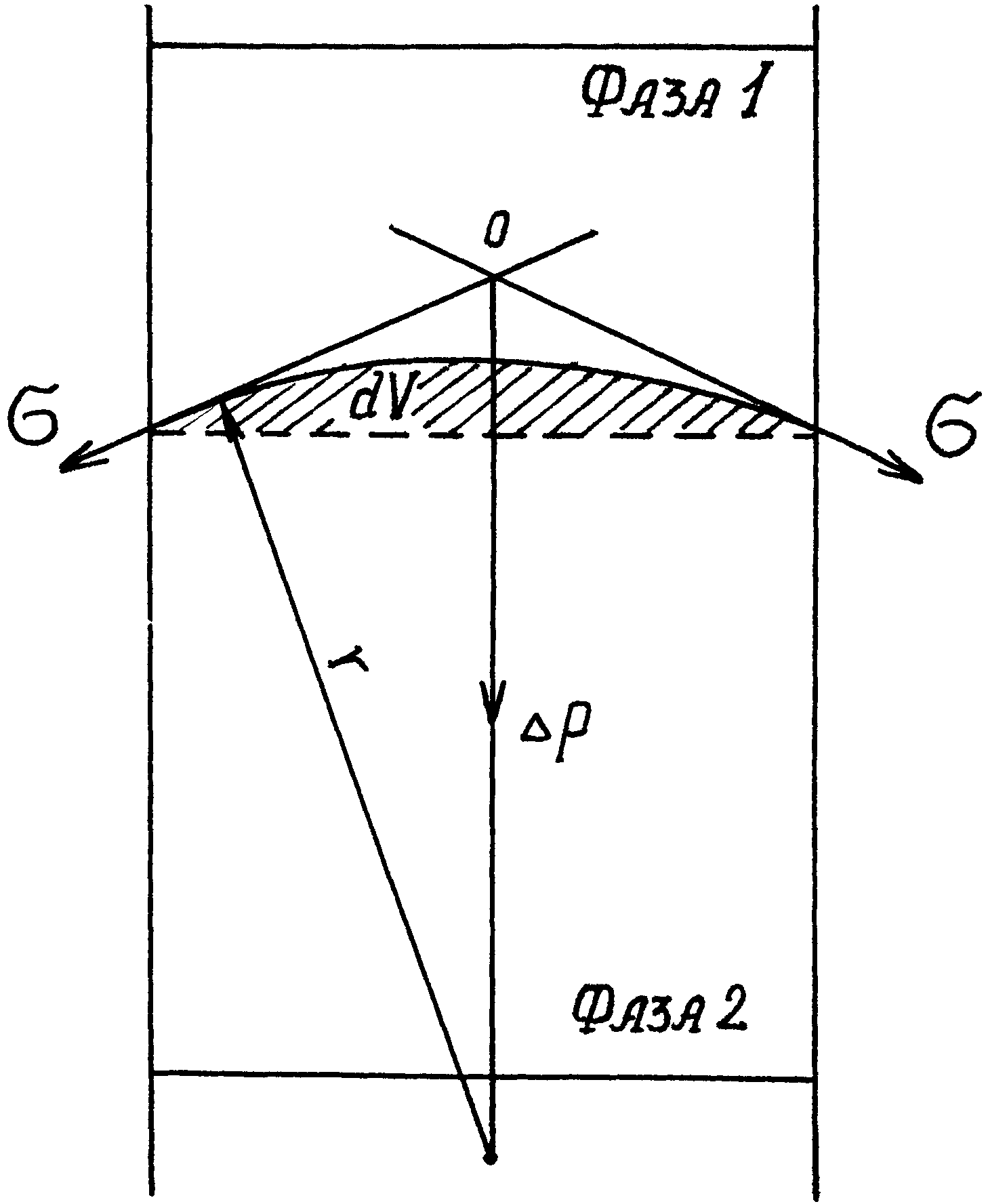
Рис.29. Схема, иллюстрирующая влияние кривизны межфазной поверхности на внутреннее давление жидких фаз
Рассмотрим результат влияния кривизны поверхности раздела между двумя несмешивающимися жидкостями на внутреннее давление в фазах (рис.29). Кривизна вызывает изменение площади и положения межфазной поверхности, что можно выразить изменением поверхностной энергии dS. Кроме того, изменяются объемы фаз 1 и 2 на dV1 и dV2. При условии постоянства объема всей системы dV1 = —dV2. Изменение объемов вызывает соответствующие изменения энергий фаз 1 и 2 на P1dV1 и P2dV2 (где P1 и P2 - давления внутри фаз). Соотношение между поверхностной энергией и «объемной» можно записать следующим образом (при T = const):
![]()
если принять во внимание, что при равновесии dG=0, а также соотношение
dV1 = —dV2 , то получим :
![]()
или, опуская индекс:
![]() (XII.1)
(XII.1)
где P - разность давлений между двумя соприкасающимися фазами, также называемая капиллярным давлением.
Полученное уравнение (XII.1) в общем виде отражает влияние кривизны поверхности на разность давлений между двумя соприкасающимися фазами и выражает в аналитическом виде закон Лапласа.
Чем больше межфазное натяжение, тем влияние кривизны значительнее. Из него следует, что фазы, разделенные искривленной поверхностью, могут находиться в равновесии только при разных давлениях внутри фаз. В фазе, имеющей положительную кривизну, давление больше, чем внутри фазы с отрицательной кривизной.
Это также следует из рис.29. Стремление межфазного натяжения сократить поверхность приводит к увеличению давления в фазе 2. Это увеличение ΔP можно представить как равнодействующую сил межфазного натяжения σ, сходящихся в точке 0. Равнодействующая направлена перпендикулярно к поверхности в центр кривизны. Для поверхности, имеющей форму правильной сферы радиусом r, отношение dS/dV равно:
![]()
Тогда уравнение (XII.1) принимает вид
![]() (XII.2)
(XII.2)
Это уравнение применимо для определения приращения внутреннего давления жидкости со сферической поверхностью.
Если жидкость находится в диспергированном состоянии, то 1/r характеризует дисперсность частиц. Таким образом, чем выше дисперсность, тем больше внутреннее давление. Например, в капле воды с радиусом 10-6 см дополнительное давление P достигает 15 МПа. Оно составляет небольшую долю от общего внутреннего давления воды, но вполне достаточно для того, чтобы обеспечивать сферическую форму капель. Такое же дополнительное давление характерно и для пузырьков воздуха в жидкости.
Дополнительное давление, обусловленное кривизной поверхности, всегда направлено к центру кривизны. Поскольку центр кривизны может находиться внутри жидкости (положительная кривизна) и вне жидкости (отрицательная кривизна), дополнительное давление в первом случае увеличивает внутреннее давление жидкости (сжатие), а во втором - уменьшает его.
Интересна особенность, характерная для мыльных пузырей, Они имеют наружную и внутреннюю поверхности, радиусы кривизны которых почти одинаковы (толщиной пленки можно пренебречь), и обладают одним центром кривизны. В результате давление в пузырях равно удвоенному значению, получаемому по формуле (ХII.2). Так же, как и для сплошной жидкости, давление в мелких пузырях больше, чем в крупных. Если соединить эти пузырьки друг с другом какой-нибудь трубкой, то воздух будет переходить в крупный пузырек до тех пор, пока на месте мелкого пузырька не образуется кривизна, равная кривизне большого пузырька.
Уравнение Лапласа лежит в основе экспериментального метода «максимального давления пузырька» для определения поверхностного натяжения жидкостей и жидких растворов, а также межфазного натяжения. Метод заключается в продавливании через капилляр, опущенный в жидкую фазу, газа (воздуха) или жидкости (другой фазы). Максимальное давление соответствует образованию полусферы пузырька (капли) радиуса, равного радиусу капилляра, и его отрыву от капилляра. Полученные данные используют и для последующих расчетов поверхностного натяжения жидкостей по экспериментальным значениям давления Р.
