
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
Наличие гидрофильной и олеофильной (гидрофобной) частей у молекул ПАВ является характерной отличительной особенностью их строения. По способности к диссоциации в водных растворах поверхностно-активные вещества делят на ионогенные и неионогенные. В свою очередь ионогенные ПАВ подразделяют на анионные, катионные и амфолитные (амфотерные).
Анионные ПАВ диссоциируют в воде с образованием поверхностно-активного аниона. К ПАВ этого типа, составляющего большую часть мирового производства всех поверхностно-активных веществ, относятся:
а) карбоновые кислоты и их соли (мыла) общей формулы RCOOM (где М – одновалентный металл), например пальмитат натрия C15H31COONa, стеарат натрия C17H35COONa, олеат натрия C17H33COONa;
б) алкилсульфаты ROSO2OM;
в) алкиларилсульфонаты RArSO2OM;
г) вещества, содержащие другие типы поверхностно-активных анионов, например фосфаты, тиосульфаты и т.д..
В кислых средах соли карбоновых кислот переходят в слабодиссоциированные и малорастворимые кислоты, а в присутствии некоторых катионов (кальция, магния) образуют нерастворимые соли, что резко снижает эффективность их действия как ПАВ, особенно ухудшает их моющее действие. Большими преимуществами в этом отношении обладают алкилсульфаты и алкилсульфонаты, которые являются солями сильных кислот и поэтому могут быть использованы в кислых и солевых растворах.
Катионные ПАВ диссоциируют в воде с образованием поверхностно-активного катиона. К катионным ПАВ относятся:
а) соли первичных, вторичных и третичных алифатических и ароматических аминов;
б) соли алкилзамещенных аммониевых оснований и т.д.
Катионные ПАВ — наиболее токсичные и наименее биологически разлагаемые из всех ПАВ; их часто используют в качестве бактерицидных, фунгицидных, дезинфицирующих веществ, ингибиторов коррозии.
Амфолитные ПАВ содержат две функциональные группы, одна из которых имеет кислый, а другая оснóвный характер, например карбоксильную и аминную группы. В зависимости от рН среды амфолитные ПАВ проявляют анионактивные или катионактивные свойства:
Неионогенные ПАВ не диссоциируют в растворах на ионы. Методы их получения основаны на реакции присоединения этиленоксида к спиртам, карбоновым кислотам, аминам и другим соединениям. Например, оксиэтилированные алкилспирты марки «ОС» синтезируют по реакции:
R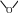 OH
+ nH2C—CH2
RO(CH2CH2O)nH
OH
+ nH2C—CH2
RO(CH2CH2O)nH
Полиоксиэтиленовая цепь определяет гидрофильные свойства неионогенных ПАВ. Изменяя длину полиоксиэтиленовой цепи, легко регулировать их коллоидно-химические свойства. Эти ПАВ применяются в любых средах (кислой и щелочной), а также в присутствии растворимых солей. Полиоксиэтиленовые эфиры алкилфенолов марки ОП обладают хорошими моющими свойствами.
К недостаткам этих ПАВ относится медленное разложение из-за наличия в их составе ароматического радикала и, как следствие, накопления их в объектах окружающей среды. Неионогенные ПАВ с алкильными радикалами способны биологически разлагаться достаточно полно и быстро.
Все дифильные поверхностно-активные вещества относительно поведения их в воде делят на истинно растворимые и коллоидные.
К первой группе относится большой класс растворимых в воде дифильных органических соединений с небольшим углеводородным радикалом, например низшие спирты, фенолы, кислоты и их соли, амины. Вещества этого типа в растворе находятся в молекулярно-дисперсном состоянии вплоть до концентраций, соответствующих их насыщенным растворам и разделению системы на две сплошные фазы. Эти вещества применяются в качестве смачивателей вспенивателей, гидрофобизаторов при флотации, диспергаторов, облегчающих процессы образования новых поверхностей, и т. д.
Особый интерес представляют коллоидные поверхностно-активные вещества. Именно они в первую очередь понимаются под термином ПАВ. Главной отличительной особенностью этих веществ является способность образовывать термодинамически устойчивые (лиофильные) гетерогенные дисперсные системы(ассоциативные или мицеллярные коллоиды). К основным свойствам коллоидных ПАВ, обусловливающим их широкое применение, относятся высокая поверхностная активность; способность к самопроизвольному мицеллообразованию - образованию лиофильных коллоидных растворов при концентрации ПАВ выше некоторого определенного значения, называемого критической концентрацией мицеллообразования (ККМ); способность к солюбилизации - резкому увеличению растворимости веществ в растворах коллоидных ПАВ вследствие их «внедрения» внутрь мицеллы; высокая способность стабилизировать различные дисперсные системы.
Поверхностная активность коллоидных ПАВ зависит, главным образом, от длины углеводородного радикала. Увеличение длины радикала на одну группу -СН2- приводит к возрастанию поверхностной активности приблизительно в 3,2 раза (правило Дюкло - Траубе). Это правило соблюдается в основном для истинно растворимых ПАВ.
Для органических сред правило Дюкло - Траубе обращается: поверхностная активность снижается с увеличением длины углеводородного радикала ПАВ.
В заключение можно отметить, что основной количественной характеристикой ПАВ является поверхностная активность, которая определяет их способность понижать поверхностное натяжение, вызывать эмульгирование, пенообразование, диспергирование и стабилизацию, смачивание и другие явления.
