
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
Как было указано выше, в результате адсорбции происходит перераспределение компонентов между объемными фазами и поверхностным слоем.
Результатом этого процесса является изменение поверхностного натяжения.
Д.У.Гиббс вывел фундаментальное уравнение, устанавливающее связь между величиной адсорбции Г, поверхностным натяжением раствора и равновесной концентрацией адсорбата С. Для разбавленных растворов неэлектролитов оно имеет следующий вид:
![]() (IX.3)
(IX.3)
Адсорбционное уравнение Гиббса записано для многокомпонентных систем и является термодинамически строгим соотношением.
Важным частным вариантом адсорбции является адсорбция газа или пара на твердой поверхности при условии отсутствия растворимости адсорбента в конденсате адсорбата.
Если адсорбция происходит из газовой фазы, то, выразив концентрацию в соответствии с уравнением Клапейрона - Менделеева через давление P, получим:
![]() (IX.4)
(IX.4)
Следовательно, зная зависимость поверхностного натяжения раствора от концентрации (давления пара) растворенного вещества, по уравнениям (IX.3) и (IX.4), можно рассчитать изотерму адсорбции этого компонента. Схема графического расчета показана на рис.18. В нескольких точках кривой = f(С) проводят касательные и определяют тангенсы угла наклона их по отношению к оси абсцисс, которые соответствуют значениям производных д/дС в данных точках. Зная эти производные, по уравнению (IХ.3) можно рассчитать величины Г, что позволяет построить изотерму адсорбции Г = f(С).
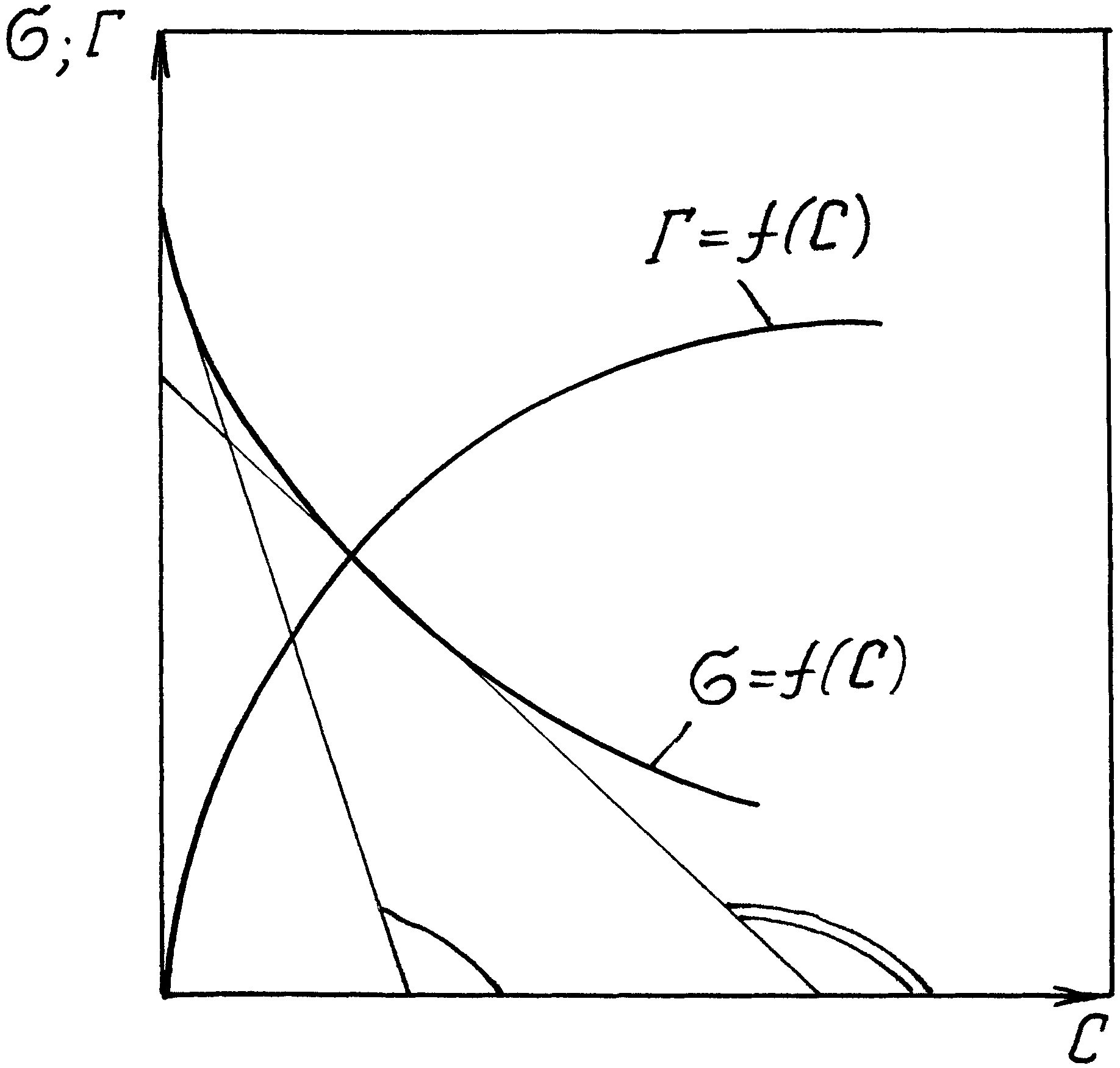
Рис. 18. Схема графического расчета изотермы адсорбции Г= f(С) из известной зависимости = f(С)
§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
В адсорбционном уравнении Гиббса (IX.3) влияние природы веществ на адсорбцию отражает производная д/дС. Эта производная определяет и знак гиббсовской адсорбции. Таким образом, величина д/дС может служить характеристикой поведения веществ при адсорбции. Чтобы исключить влияние концентрации на производную и придать этой величине вид характеристической постоянной, берут ее предельное значение при С 0; эту величину П. А. Ребиндер (1924 г.) назвал поверхностной активностью (g). Ее общее определение дается соотношением:
![]() (IX.5)
(IX.5)
которое справедливо как для неэлектролитов, так и для электролитов. При положительной адсорбции величина д/дС имеет отрицательный знак. Чтобы знаки поверхностной активности и гиббсовской адсорбции совпадали, в уравнении (IX.5) перед производной ставят знак минус.
Поверхностная активность является важнейшей адсорбционной характеристикой веществ, определяющей многие их свойства и области применения.
Уравнение (IX.5) показывает, что чем сильнее уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества. Физический смысл поверхностной активности состоит в том, что она представляет силу, удерживающую вещество на поверхности, рассчитанную на единицу гиббсовской адсорбции.
Поверхностная активность, как и гиббсовская адсорбция, может быть положительной и отрицательной. Абсолютное значение и ее знак зависят от природы как адсорбируемого вещества, так и среды (растворителя). Если с увеличением концентрации вещества поверхностное натяжение на границе раздела фаз понижается, то такое вещество называют поверхностно-активным (ПАВ). Для таких веществ
g
0 ![]() 0
0
0
0
Вещества, повышающие поверхностное натяжение на границе раздела фаз с увеличением концентрации, называют поверхностно-инактивными. Для них
g 0 0 0
Отрицательная гиббсовская адсорбция Г < 0 означает, что концентрация адсорбируемого вещества в объеме больше, чем в поверхностном слое. При увеличении концентрации поверхностно-инактивного вещества в объеме степень соответствующего роста его концентрации в поверхностном слое ниже. В результате с увеличением концентрации поверхностно-инактивного вещества в объеме растет отрицательная величина гиббсовской адсорбции. Эти зависимости наглядно иллюстрирует рис.19, из которого видны различия между поверхностно-активными (додециламин) и поверхностно-инактивными (сульфат натрия) веществами, растворенными в воде. Если же в качестве растворителя додециламина ( = 22,5 мДж/м2) взять гексан, поверхностное натяжение которого меньше ( = 17,8 мДж/м2), то амин будет выступать уже как поверхностно-инактивное вещество. Так как большинство органических веществ имеет поверхностное натяжение меньше, чем вода, то они по отношению к воде поверхностно-активны.
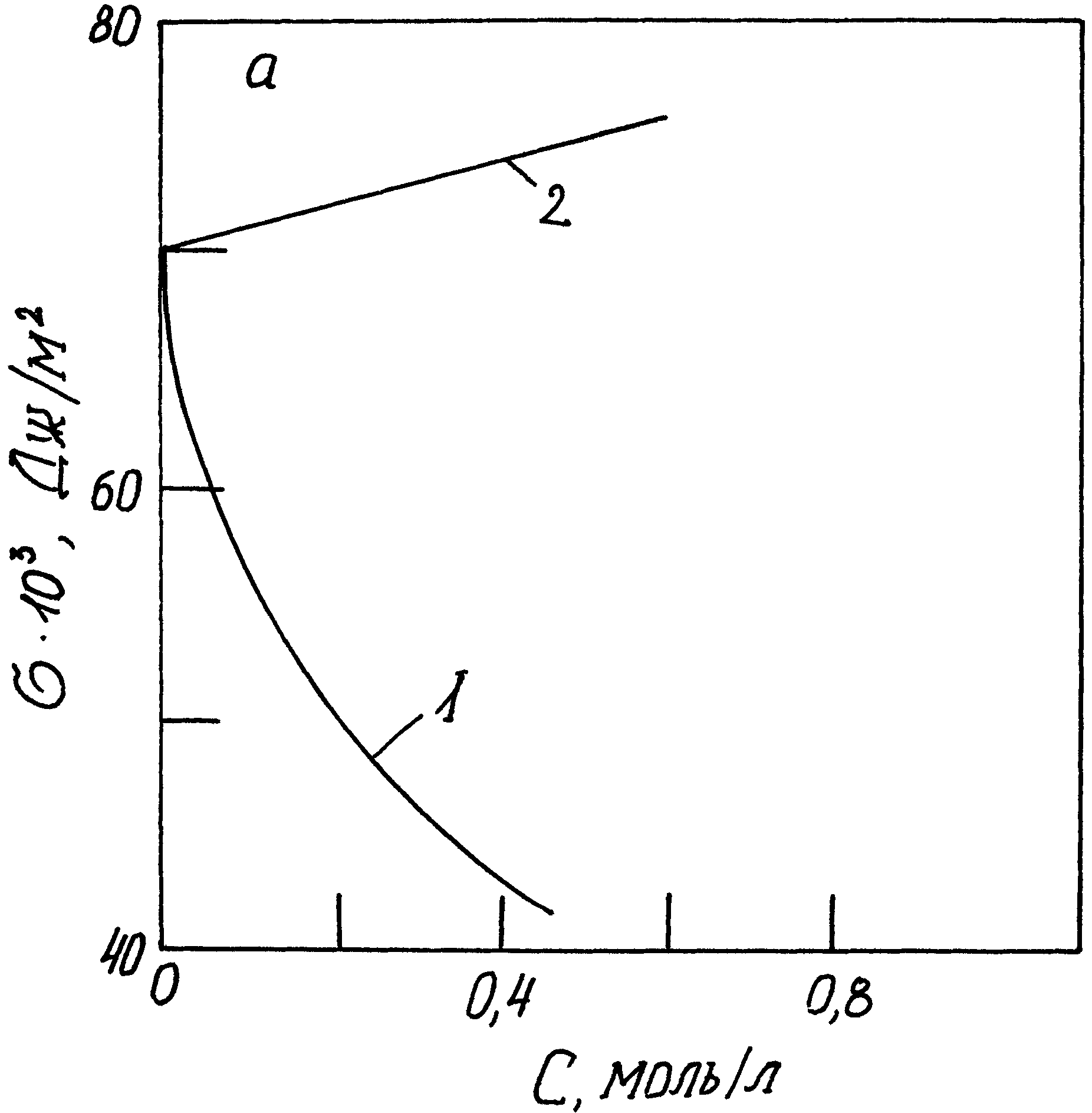
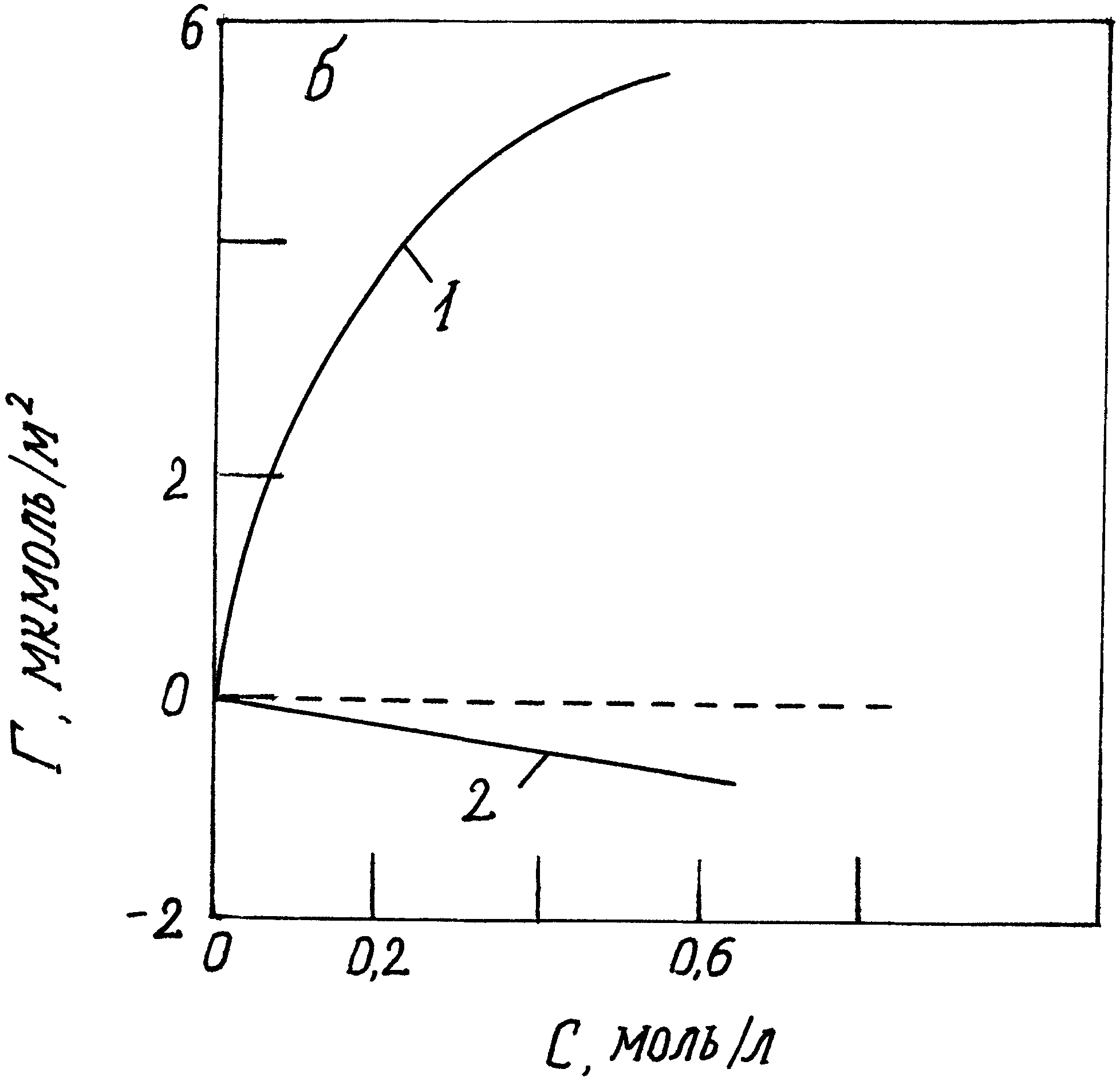
Рис. 19. Зависимость поверхностного натяжения () и гиббсовской адсорбции () от концентрации водного раствора поверхностно-активного (1 – додециламин) и инактивного вещества (2 - сульфат натрия).
Термин «поверхностно-активные вещества» (ПАВ) обычно применяют к специфическим веществам, обладающим очень большой поверхностной активностью по отношению к воде, что является следствием их особого строения. Молекулы ПАВ имеют неполярную (углеводородную) часть и полярную, представленную функциональными группами —СООН, —NН2, —ОН, —О—, —SO2OH и др. (в этом случае говорят о дифильном строении молекул ПАВ). Углеводородные радикалы ПАВ выталкиваются из воды на поверхность, а полярные группы находятся внутри водной фазы, т.к. молекулы ПАВ стремятся ориентироваться в поверхностном слое таким образом, чтобы каждая их часть – полярная и неполярная – находились в родственной им среде.
Величина адсорбции ПАВ всегда положительна (Г > 0). ПАВ типа обычных мыл (олеат натрия) в концентрации 10-3 моль/л понижают воды при 298 К с 72,5 до 30 мДж/м2. Это значит, что в определенной толщине поверхностного слоя концентрация ПАВ в 3·104 раз (т. е. в десятки тысяч раз) превышает концентрацию ПАВ в объеме раствора.
Примером поверхностно-инактивных веществ по отношению к воде являются неорганические соли, которые сильно гидратируются. Они взаимодействуют с водой сильнее, чем молекулы воды между собой. Вследствие этого они имеют отрицательную величину адсорбции (Г < 0). При добавлении неорганических солей к воде поверхностное натяжение повышается, но в связи с тем, что адсорбция соли отрицательна, т. е. на поверхность предпочтительнее переходит растворитель (вода), поверхностное натяжение раствора с увеличением концентрации поверхностно-инактивных веществ растет медленно (см. рис.19).
