
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
§ 2. Влияние давления на растворимость газов. Закон Генри
Отношение растворимости газа к давлению при постоянной температуре является постоянной величиной6 (растворимость чаще всего выражается в г/л и обозначается q):
![]() =
K' (VI,
1)
=
K' (VI,
1)
Величина К' может служить мерой растворимости газа в жидкости.
Уравнение (VI, 1) является выражением закона Генри, найденного (1803) опытным путем.
Нетрудно видеть, что уравнение (VI, 1) есть иная форма уже рассмотренного ранее уравнения Рауля-Генри (V, 4):
![]()
Если для раствора газа соблюдается уравнение (V, 4), то такой раствор, в соответствии с ранее сказанным, является предельно разбавленным раствором. Для него справедлив закон Рауля и все закономерности для этих растворов, рассмотренные в главе V.
Выразим весовое количество m2 растворенного газа, находящегося во всем объеме V раствора, через объем, занимаемый газом при тех же температуре и давлении. По уравнению Клапейрона - Менделеева:
![]()
откуда следует, что
![]() ,
,
где
![]() - молекулярная масса газа и Vгаз
– его объем.
- молекулярная масса газа и Vгаз
– его объем.
Подставив в уравнение (VI, 1) значение
![]()
получим:
![]() (VI,
1а)
(VI,
1а)
сокращая величину P и объединяя постоянные величины, получаем:
![]() (VI,
2)
(VI,
2)
Отношение
![]() ,
называемое
коэффициентом
растворимости газа, не
зависит от давления (для идеальных и
предельно разбавленных растворов
идеальных газов). Величина
показывает, сколько объемов газа
растворяется в одном объеме раствора
при данной температуре (объем газа
измеряется при тех же значениях Т
и P,
при
которых установилось равновесие
газ-раствор).
,
называемое
коэффициентом
растворимости газа, не
зависит от давления (для идеальных и
предельно разбавленных растворов
идеальных газов). Величина
показывает, сколько объемов газа
растворяется в одном объеме раствора
при данной температуре (объем газа
измеряется при тех же значениях Т
и P,
при
которых установилось равновесие
газ-раствор).
Растворимость газа может быть выражена также в объемах газа, приведенных к 0°С:
![]()
![]()
![]() (VI,
3)
(VI,
3)
Величина называется коэффициентом поглощения газа и, так же как , не зависит от давления газов (в границах применимости закона Генри).
По значению коэффициента растворимости можно найти концентрацию растворенного газа, выраженную в любых единицах.
Идеальная растворимость газа, т. е. растворимость его в идеальном растворе, может быть вычислена по закону Рауля - Генри (для Р = 1 атм), если считать приближенно газ идеальным и положить P2 = 1 атм:
x
=
![]() (VI,
4)
(VI,
4)
где
![]() —
давление насыщенного пара сжиженного
газа7
при той же температуре, при которой
определяется растворимость.
—
давление насыщенного пара сжиженного
газа7
при той же температуре, при которой
определяется растворимость.
Из уравнения (VI, 4) вытекает, что идеальная растворимость газа не зависит от природы растворителя. Ее зависимость от давления выражается графически прямой линией.
В растворах, близких к идеальным, а тем более в растворах с положительными отклонениями давление растворенного газа резко возрастает с увеличением его концентрации ( велико) и уже при малых значениях последней достигает внешнего давления (например, 1 атм).
Поэтому растворимость (выраженная в мольных долях) газов, образующих идеальные растворы или растворы с положительными отклонениями, при обычных давлениях мала. Значительно больше растворимость газов, образующих растворы с отрицательными отклонениями.
Это положение иллюстрирует рис.14, из которого видно, что кривая P2 = f(x) для раствора с положительными отклонениями от закона Рауля пересекает изобару Р = 1 атм при меньших концентрациях, чем прямая P2 = x для идеального раствора, и тем более, чем кривая P2 = f(x) для раствора с отрицательными отклонениями. Следовательно, и растворимости газов в соответствующих растворах
xпол. < xид. < xотр.
В табл.4 приведены значения растворимостей некоторых газов в разных растворителях при 20°С и 1 атм.
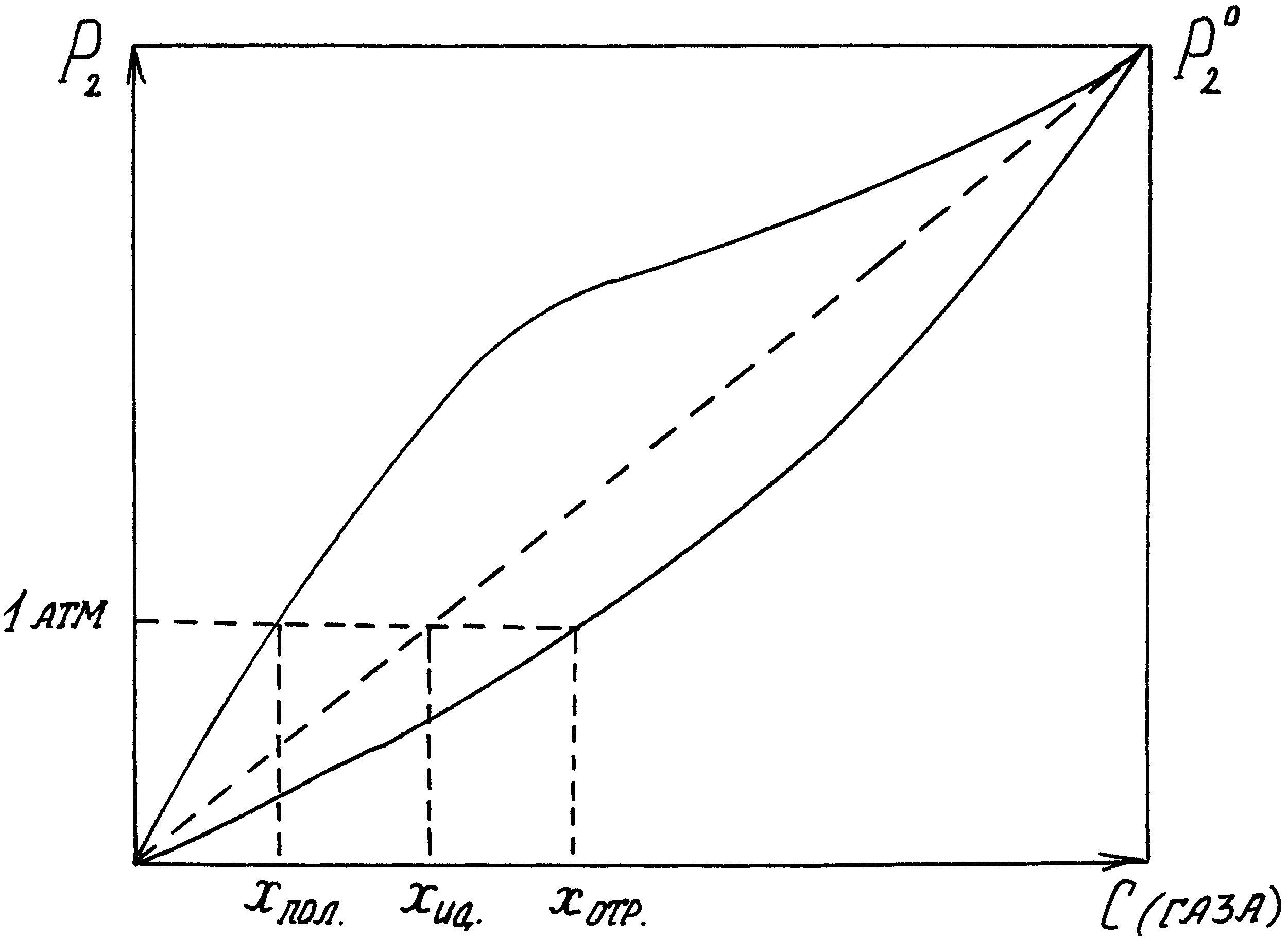
Рис.14. Парциальное давление газа над его растворами.
Таблица 4. Растворимость некоторых газов при 20°С и 1 атм
Растворитель |
Растворимость газов (мольные доли 104) |
|||||||
|
He |
Н2 |
N2 |
О2 |
CH4 |
С2Н4 |
СO2(0°) |
NH3(0°) |
н-гексан |
— |
6,5 |
12,5 |
19,3 |
42,4 |
161 |
— |
— |
циклогексан |
1,22 |
3,80 |
7,22 |
— |
28,3 |
— |
— |
— |
ацетон |
1, 08 |
2,31 |
5,92 |
9,258 |
22,3 |
75 |
211 |
|
бензол |
0,77 |
2,61 |
4,40 |
16 |
20,7 |
107 |
91 |
— |
метиловый спирт |
0,60 |
1,57 |
2,35 |
3,18 |
7,1 |
_ |
70 |
4390 |
вода |
0, 070 |
0,15 |
0,12 |
0,23 |
0,24 |
0,33 |
7 |
4810 |
Как видно из таблицы, растворимость так называемых постоянных газов (Н2, N2, О2) мала (сотые и десятые доли мольных процентов).
Газы с полярными молекулами сравнительно мало растворимы в неполярных и малополярных жидкостях.
Большие отрицательные отклонения и, соответственно, очень большие растворимости СO2 и NH3 в водных растворах обусловлены, с одной стороны, химическим взаимодействием с водой, сильно уменьшающим количество свободных молекул СO2 и NH3 в растворе, и, с другой стороны, гидратацией этих молекул, за счет чего значительно понижается их летучесть.
Растворение газов в жидкостях сопровождается, как правило, выделением теплоты. Исключением являются растворы водорода и инертных газов в органических растворителях, которые образуются с поглощением теплоты.
