
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
§ 6. Второй закон Коновалова. Азеотропные растворы
Значительные положительные или отрицательные отклонения растворов от закона идеальных растворов приводят, как указывалось выше, к появлению максимума или соответственно минимума на кривой полного давления пара5.
Д. П. Коновалов установил (1881), что экстремумы на кривых полного давления пара (или температур кипения) отвечают такому равновесию раствора и насыщенного пара, при котором составы обеих фаз одинаковы (второй закон Коновалова).
По второму закону Коновалова на кривых давления пара или температуры кипения растворов, дающих экстремумы, обе кривые - кривая пара и кривая жидкости - должны касаться в точке экстремума. Соответствующие диаграммы температура кипения - состав имеют вид, показанный на рис.12 и 13. Эти диаграммы можно представить как бы составленными из двух частей, каждая из которых аналогична диаграмме, показанной на рис.9.
С раствором, состав которого отвечает экстремуму на кривых давления пара или температур кипения, находится в равновесии пар такого же состава. Очевидно, что состав таких растворов при перегонке не меняется и они кипят при постоянной температуре. Такие растворы называются азеотропными (нераздельно-кипящими).
Очевидно, что разделение азеотропного раствора (его называют также азеотропом) на чистые компоненты путем фракционированной перегонки невозможно.
В табл.3 приведены температуры кипения некоторых азеотропных растворов.
Таблица 3. Азеотропные (нераздельно-кипящие) растворы
Компоненты |
Температура кипения |
Состав азеотропа вес. % В |
||||
А |
B |
A |
B |
азеотропа |
||
Минимум температур кипения |
||||||
H2O |
C2H5OH |
100 |
78,30 |
78,15 |
95,57 |
|
CHCl3 |
С2Н5ОН |
61,2 |
78,2 |
59,3 |
6,8 |
|
Максимум температур кипения |
||||||
Н2О |
HNO3 |
100 |
86 |
120,5 |
68 |
|
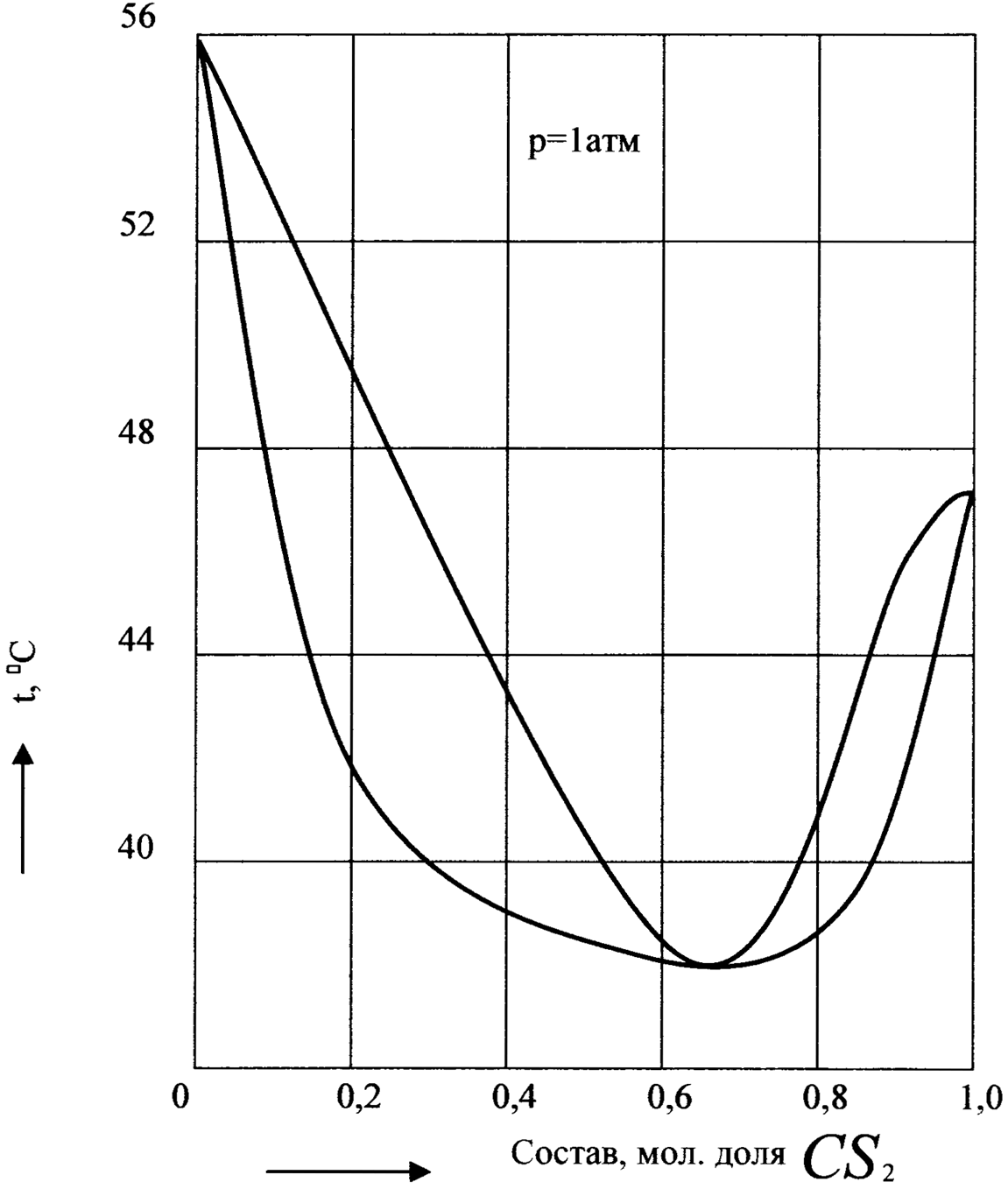
Рис.12. Диаграмма температура кипения - состав бинарной смеси с минимумом температуры кипения (метилаль - сероуглерод).
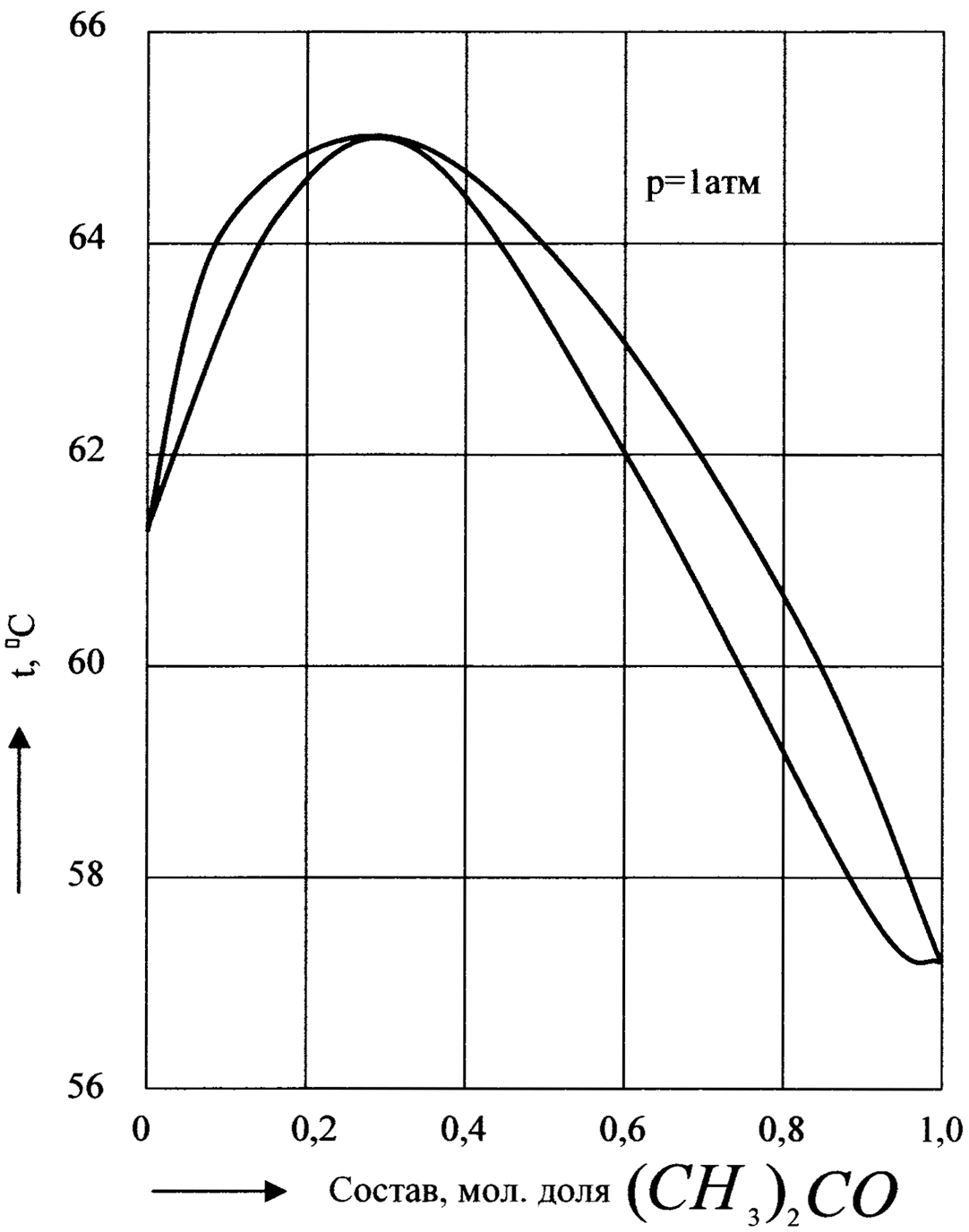
Рис.13. Диаграмма температура кипения - состав бинарной смеси с максимумом температуры кипения (хлороформ - ацетон).
Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
§ 1. Растворимость газов в жидкостях
Газ не может растворяться в жидкости беспредельно. При некоторой концентрации газа (при данных P и Т) устанавливается равновесие раствор - газ (насыщенный раствор).
Количество газа, растворенного в единице объема раствора, который находится в равновесии с газообразной фазой (растворимость газа), зависит от температуры и парциального давления газа, а также физического и химического сродства молекул растворителя и растворенного вещества.
Чаще всего хорошо растворимы друг в друге подобные по физическим и химическим свойствам вещества (эмпирическое правило «подобное растворяется в подобном»). В частности, вещества, состоящие из полярных молекул, и вещества с ионным типом связи хорошо растворимы в полярных растворителях (воде, этаноле и др.), а неполярные вещества хорошо растворяются в неполярных растворителях (различных углеводородах).
Растворимость газа, как правило, увеличивается с ростом его молекулярной массы.
Растворимость газа также увеличивается с ростом давления. Если газ мало растворим в данной жидкости и его давление невелико, то растворимость (выраженная в г/л или моль/л) газа q пропорциональна его давлению.
В нефти содержится значительное количество растворенных газов (попутные газы), они выделяются при подъеме нефти на поверхность вследствие снижения давления. В газонефтяных месторождениях на одну тонну нефти приходится от 30 до 300 м3 растворенного газа. В состав попутных газов входят метан, этан, пропан, бутаны, а также в меньших количествах N2, CO2, H2S, He, Ar и другие.
От количества растворенного в пластовой нефти газа, т.е. от газонасыщенности нефти, зависят все ее важнейшие свойства: вязкость, сжимаемость, плотность и т.д.
