
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
Из закона Рауля следует, что растворы нелетучих веществ обладают некоторыми особенностями, которые будут рассмотрены в этом параграфе.
Изученные закономерности для давления насыщенного пара в приложении к указанным разбавленным растворам нелетучих веществ дают возможность вычислить температуру кипения раствора.
Жидкость начинает кипеть, когда давление ее насыщенного пара становится равным внешнему давлению. Так как пар раствора нелетучего вещества фактически содержит лишь чистый растворитель, то, в соответствии с законом Рауля, давление насыщенного пара такого раствора будет всегда меньше давления насыщенного пара чистого растворителя при той же температуре.
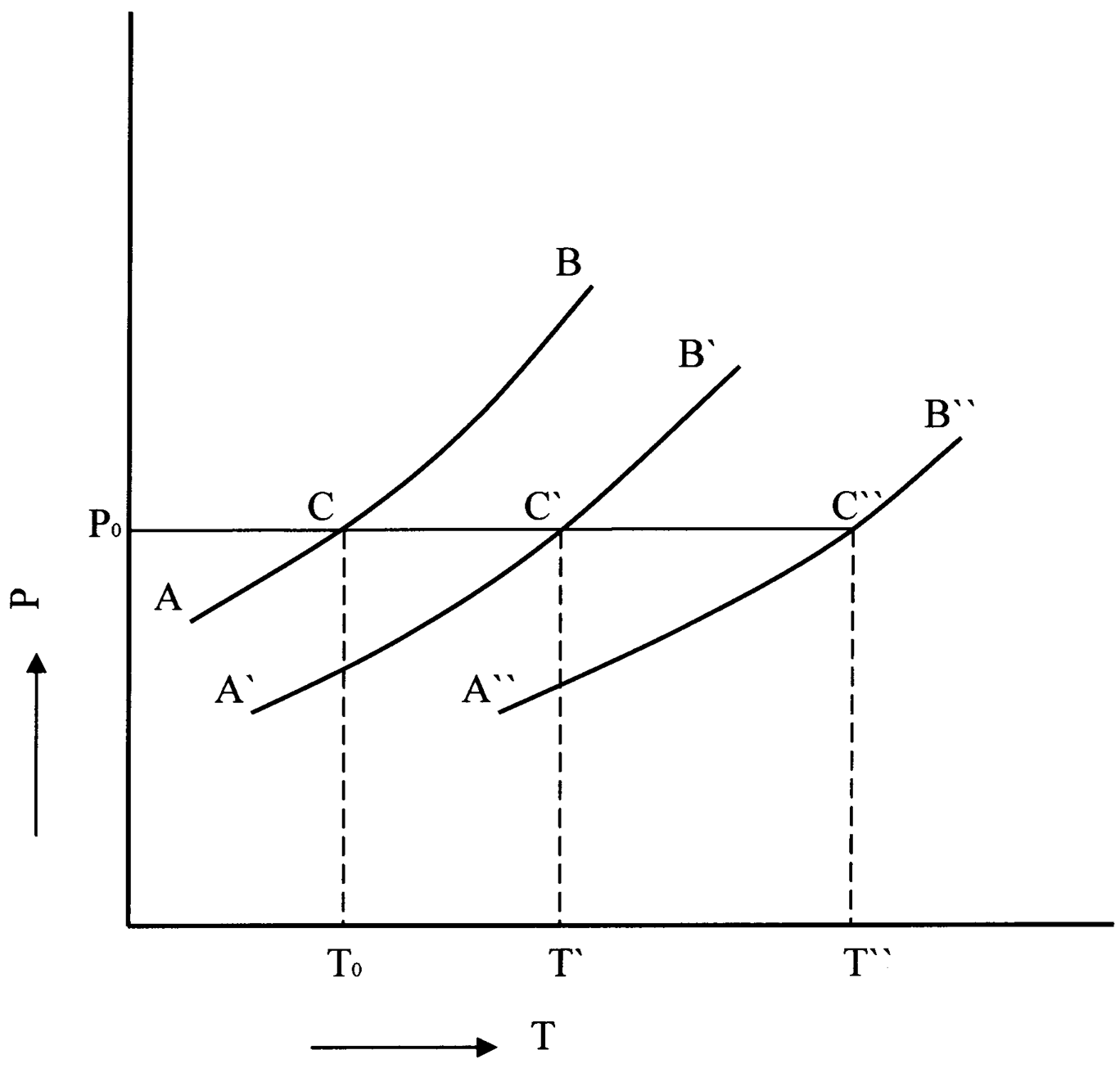
Рис.10. Повышение температуры кипения раствора.
На рис.10 схематически изображены зависимости давления насыщенного пара чистого растворителя (АВ) и растворов разной концентрации x’ и x’’(кривые A'В' и А''В" соответственно ) от температуры, причем x’ x’’. Как видно из рисунка, температура кипения раствора Т', отвечающая точке С' пересечения кривой А'В' с изобарой внешнего давления P0, всегда выше температуры кипения растворителя Т0 при том же давлении (точка С). Температура кипения раствора большей концентрации x’’, отвечающая точке С’’ пересечения кривой А’’В’’ с изобарой внешнего давления P0, выше температуры кипения растворителя Т0 и выше температуры кипения T’ раствора меньшей концентрации.
Разность
между температурой кипения раствора
(Т)
и
температурой кипения чистого растворителя
Т
= Т
- Т0
,очевидно,
тем больше, чем больше концентрация
растворенного
вещества. Пусть раствор настолько
разбавлен, что он подчиняется закону
Рауля (предельно разбавленный раствор).
Тогда количественная зависимость T
от концентрации раствора при давлении
насыщенного пара раствора, равном
постоянному внешнему давлению: P1
=
![]() = Р =
const,
выражается следующим образом:
= Р =
const,
выражается следующим образом:
![]() (V,
7),
(V,
7),
где М – моляльность раствора, а величина E постоянна для каждого растворителя и носит название эбуллиоскопической постоянной. Она не зависит от природы растворенного вещества. Формально эта величина равна повышению температуры кипения раствора одного моля вещества в 1000 г растворителя (М = 1) и называется также молекулярным повышением температуры кипения. В табл.2 приведены значения эбуллиоскопических постоянных некоторых жидкостей.
Таблица 2. Эбуллиоскопические постоянные некоторых жидкостей
Растворитель |
Tкип., °К при 1 атм |
Е, вычислено по (V, 7) |
Вода |
373,2 |
0,513 |
Этиловый спирт |
351,4 |
1,21 |
Ацетон |
329,2 |
1,762 |
Бензол |
353,3 |
2,52 |
Четыреххлористый углерод |
351,7 |
5,64 |
Уравнение (V, 7) дает возможность вычислить молекулярную массу растворенного вещества, если известно повышение температуры кипения T раствора, а также массы растворенного вещества и растворителя.
Метод определения молекулярной массы по уравнению (V, 7) называется обычно эбуллиоскопией4.
Изложенные факты и закономерности, относящиеся к растворимости твердых тел в жидкостях, охватывают и выделение твердого растворителя при охлаждении. В самом деле, температура затвердевания раствора с малой концентрацией растворенного вещества (точнее, температура начала затвердевания) обычно есть не что иное, как температура, при которой этот раствор становится насыщенным относительно твердого растворителя.
При температуре начала затвердевания раствор и твердый растворитель находятся в равновесии, при этом давления насыщенного пара растворителя над раствором и над твердым растворителем должны быть равны. Так как давление пара растворителя над раствором всегда меньше, чем давление пара над чистым жидким растворителем при той же температуре, то раствор будет затвердевать при более низкой температуре, чем растворитель. Это видно из рис.11.
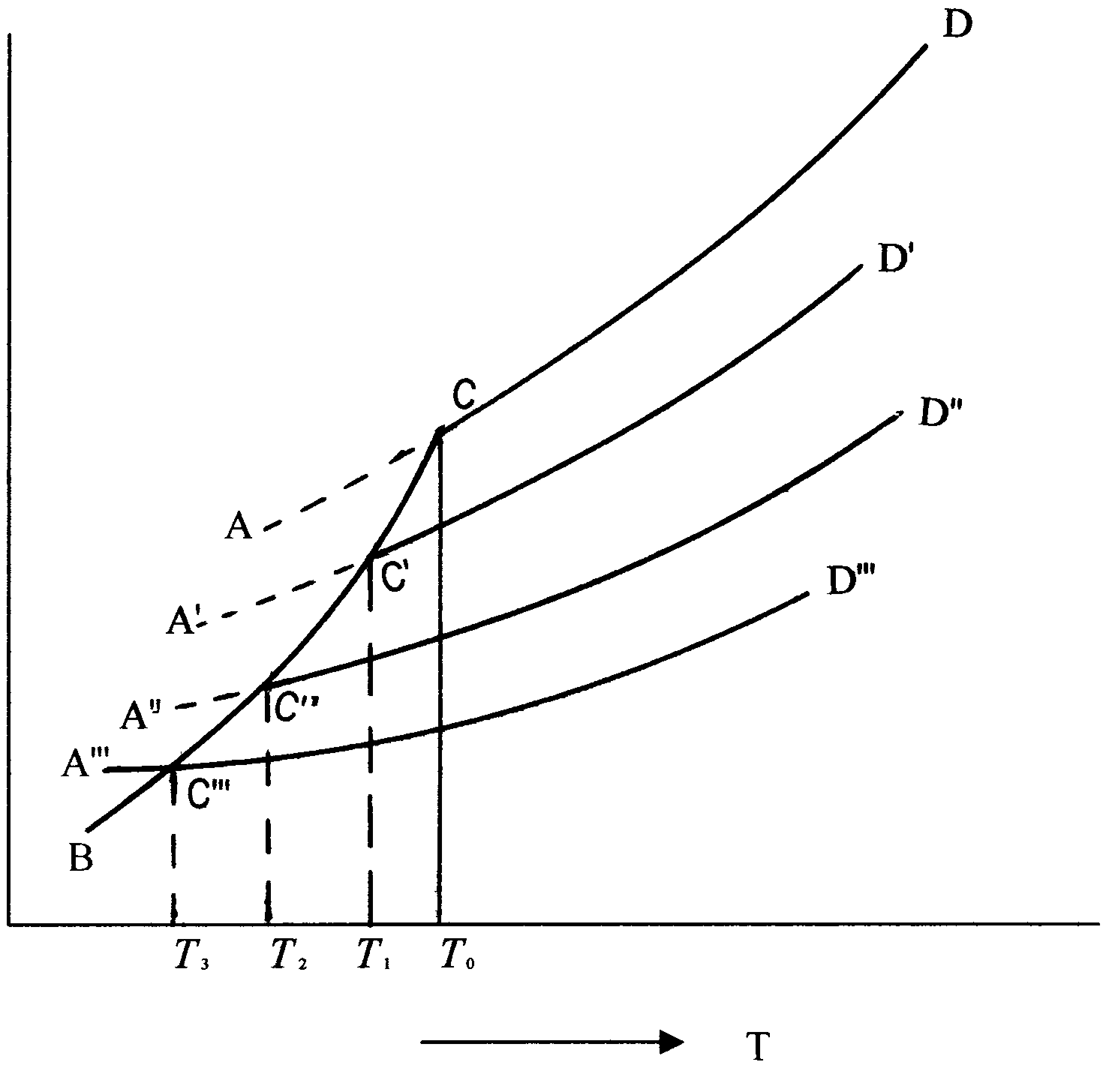
Рис.11. Понижение температуры затвердевания растворов.
На этом рисунке кривая AD показывает зависимость давления насыщенного пара чистого жидкого растворителя от температуры, кривая ВС - давление пара чистого твердого растворителя, кривые A'D', A" D" и А'"D"' - давление пара растворителя над растворами нелетучего вещества с постоянными концентрациями х'<х"<х'" и т. д.
Точки пересечения кривых AD, A'D', A"D" и т. д. с кривой ВС определяют температуры начала затвердевания соответственно чистого жидкого растворителя (Т0) и растворов (T1, Т2 и т. д.). Из рисунка видно, что понижение температуры начала затвердевания раствора (Т) по сравнению с температурой начала затвердевания чистого растворителя T = Т0 - T становится более значительным по мере увеличения концентрации раствора.
Количественная зависимость между понижением температуры начала затвердевания раствора и концентрацией определяется из уравнения:
![]() (V,
8)
(V,
8)
Константа К характерна для данного растворителя и зависит только от его свойств. Физический смысл этой константы таков: она равна понижению температуры затвердевания, которое наблюдалось бы в растворе одного моля вещества в 1000 г растворителя (при условии сохранения свойств предельно разбавленного раствора до этой концентрации).
Константа K называется молекулярным понижением точки затвердевания раствора. Уравнение (V, 8 ) дает возможность определить молекулярную массу растворенного вещества по понижению точки затвердевания T раствора этого вещества, содержащего m граммов его в 1000 г растворителя.
Правильные результаты получаются, естественно, при отсутствии диссоциации или ассоциации молекул растворенного вещества в разбавленном растворе. Изучение температур затвердевания растворов называют криоскопией, а метод определения молекулярных масс по уравнению (V, 8) - криоскопическим. Константа К поэтому называется также криоскопической константой. В табл.3 приводятся криоскопические константы некоторых растворителей.
Таблица 3. Криоскопические константы К некоторых растворителей
Растворитель |
tпл. °С |
К вычисленная по (V, 8) |
Вода |
0 |
1,856 |
Бензол |
5,5 |
5,146 |
Уксусная кислота |
16,6 |
3,81 |
Фенол |
42,7 |
6.81 |
Нафталин |
80,1 |
7,14 |
Камфора |
178,4 |
37,7 |
Для повышения точности измерения T удобно пользоваться растворителями с высокими значениями K , например, камфорой.
