
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
В простейшем случае зависимость парциального давления пара растворителя от состава бинарного раствора имеет следующий вид:
![]() (V,
1)
(V,
1)
Парциальное давление растворителя в паровой фазе пропорционально его мольной доле в растворе.
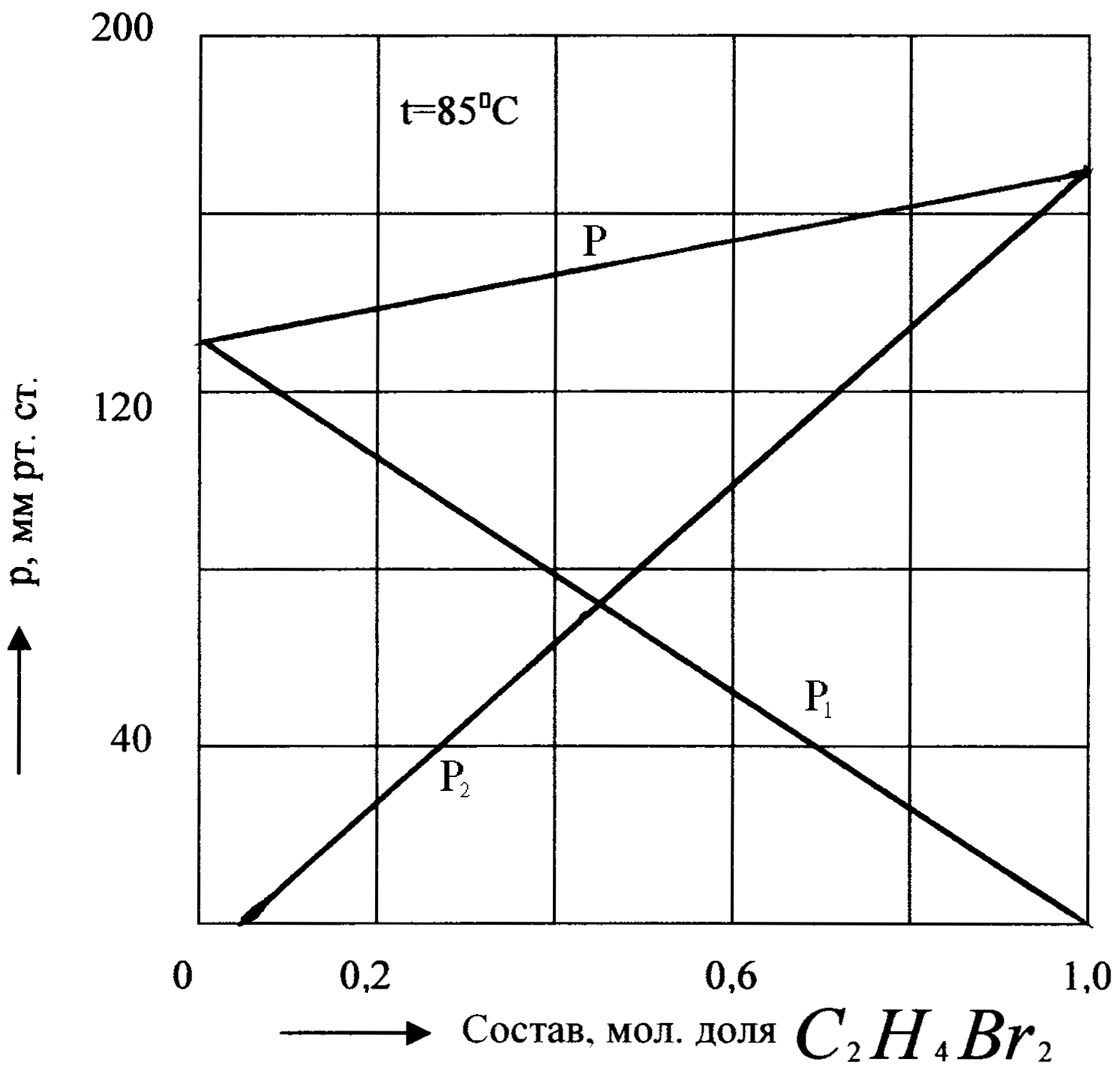
Рис.5. Общее и парциальные давления пара бинарного раствора: дибромпропан - дибромэтан. Парциальные давления на диаграмме P – x изображаются прямыми линиями.
Уравнению (V, 1) можно придать иной вид:
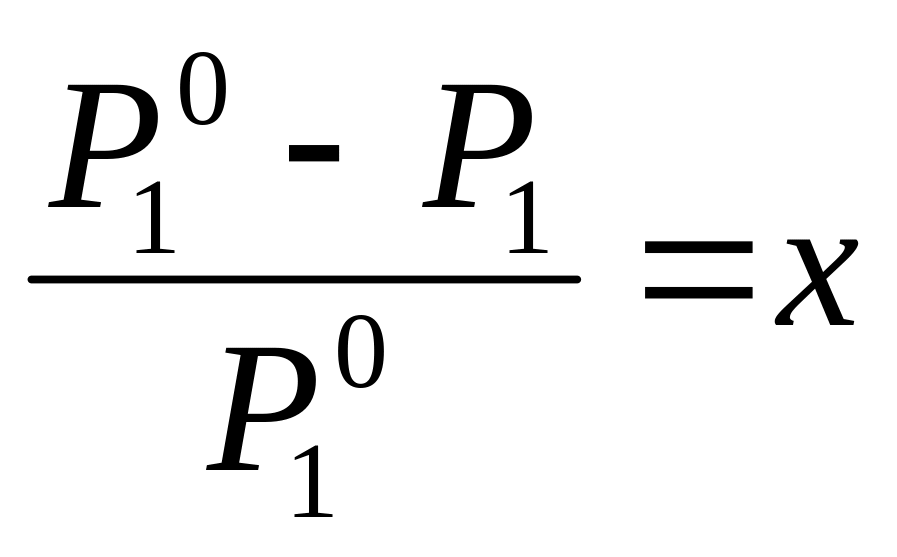 (V,
2)
(V,
2)
Относительное понижение парциального давления растворителя в паровой фазе равно мольной доле растворенного вещества (второго компонента). Уравнения (V, 1) и (V, 2) являются выражениями закона Рауля (1886). Закон Рауля, выраженный в форме уравнения (V, 1), применим к таким растворам, насыщенный пар которых ведет себя как идеальный газ, причем лишь немногие растворы подчиняются с достаточной точностью этому закону, при любых концентрациях (т. е. при значениях x, изменяющихся в интервале от 0 до 1).
Обычно при повышении температуры (пока давление насыщенного пара относительно невелико) отклонения от закона Рауля в форме (V, 1) уменьшаются. Но при достаточно высоких температурах, когда давление насыщенного пара раствора очень велико, уравнение (V, 1) становится неточным, так как возрастают отклонения пара от закона идеальных газов.
Растворы, следующие закону Рауля в форме уравнения (V, 1) при всех концентрациях и всех температурах, называются идеальными (совершенными) растворами, они являются предельным, простейшим типом жидких растворов.
Легко показать, что если для пара растворителя соблюдается уравнение (V, 1), то должно соблюдаться аналогичное уравнение для пара второго, растворенного компонента
![]() (V,
3)
(V,
3)
Уравнения (V, 1) и (V, 3) отражают свойства парциальных давлений идеальных растворов при малых давлениях. Совокупность этих уравнений носит название объединенного закона Рауля - Генри. В общем виде для многокомпонентного идеального раствора при невысоких давлениях получим:
![]() (V,
4)
(V,
4)
Уравнения (V, 1), (V, 3) и (V, 4) будут в дальнейшем изложении служить исходными для изучения термодинамических свойств идеальных растворов при небольших давлениях.
Полное давление пара идеального бинарного раствора, равное
![]() (V,
5)
(V,
5)
является также линейной функцией мольной доли.
Примерами идеальных растворов могут служить смеси (см. рис.5), бензол -толуол, бензол - дихлорэтан, гексан - октан и другие.
Составы
идеального раствора и его насыщенного
пара различны, т. е.
![]() х. В
данном случае легко найти связь между
и х.
В самом
деле, концентрация второго компонента
в паре
х. В
данном случае легко найти связь между
и х.
В самом
деле, концентрация второго компонента
в паре
![]() .
Подставив
в это выражение значение P2
из закона Рауля (уравнение (V,
3)) и значение P
из
уравнения (V,
5), получим:
.
Подставив
в это выражение значение P2
из закона Рауля (уравнение (V,
3)) и значение P
из
уравнения (V,
5), получим:
![]()
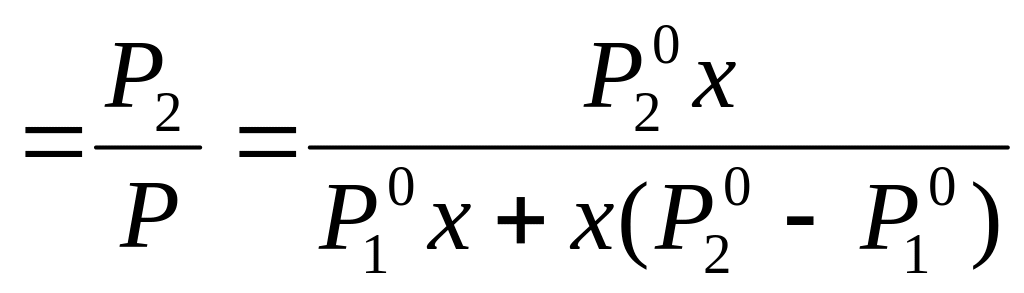 (V,
6)
(V,
6)
Отсюда
видно, что
= х только
при равенстве давлений насыщенного
пара обоих чистых компонентов, т.е. при
![]() .
.
§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
Закон Рауля не выполняется для реальных растворов. Парциальные давления этих растворов больше или меньше давлений паров идеальных растворов. Отклонения от закона Рауля в первом случае называются положительными (общее давление пара больше аддитивной величины), а во втором случае - отрицательными (общее давление пара меньше аддитивной величины).
Примерами растворов с положительными отклонениями от законов Рауля могут служить растворы:
Ацетон - этиловый спирт
Бензол - ацетон
Вода - метиловый спирт
На рис.6 изображена диаграмма P - х для одного из этих растворов (бензол - ацетон).
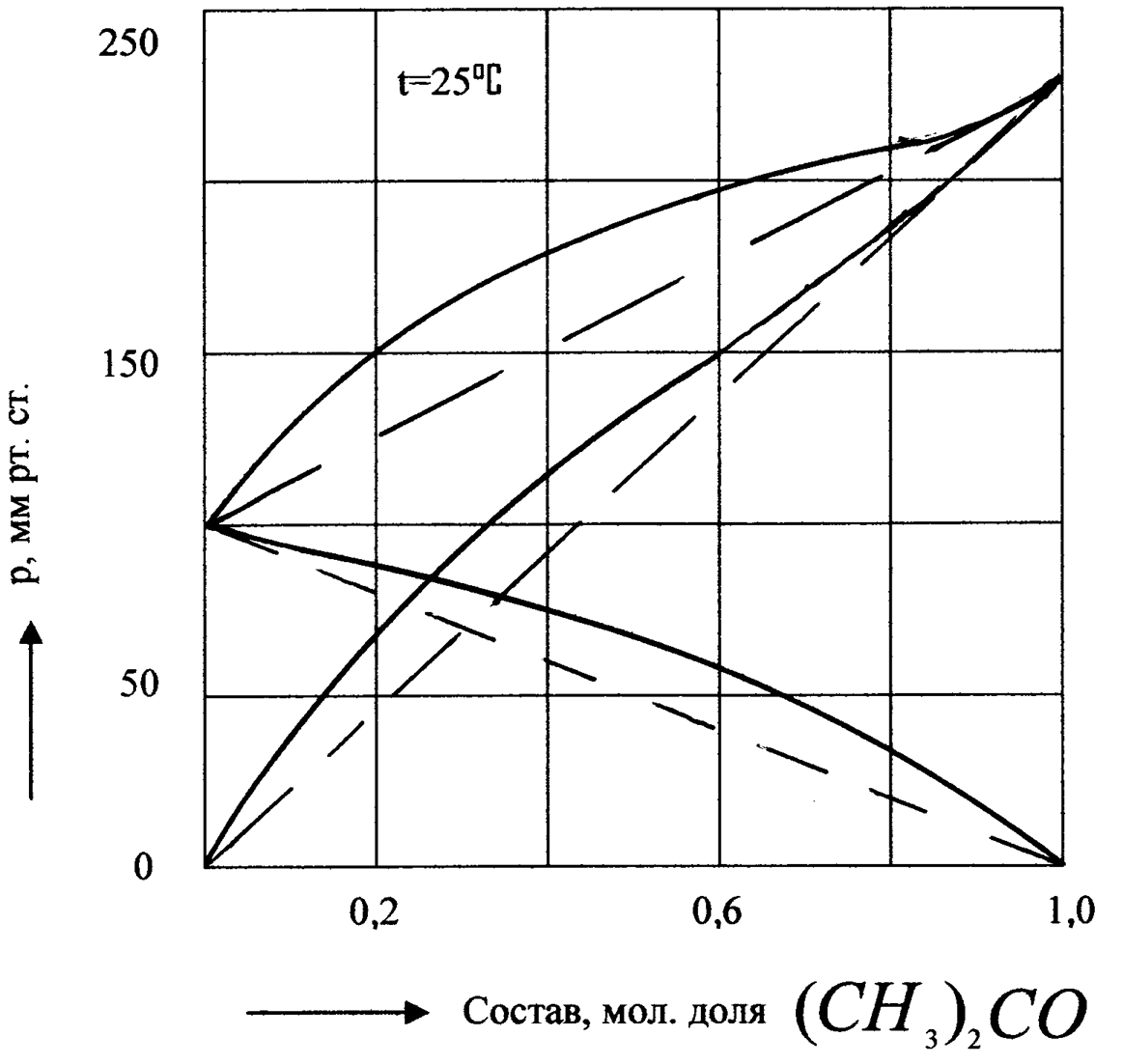
Рис.6. Диаграмма давления пара над раствором С6Н6 - (СН3)2СО.
К растворам с отрицательными отклонениями от законов Рауля относятся, например, растворы:
Хлороформ - бензол
Хлороформ - этиловый эфир
Диаграмма давления пара над раствором хлороформ - диэтиловый эфир показана на рис.7.
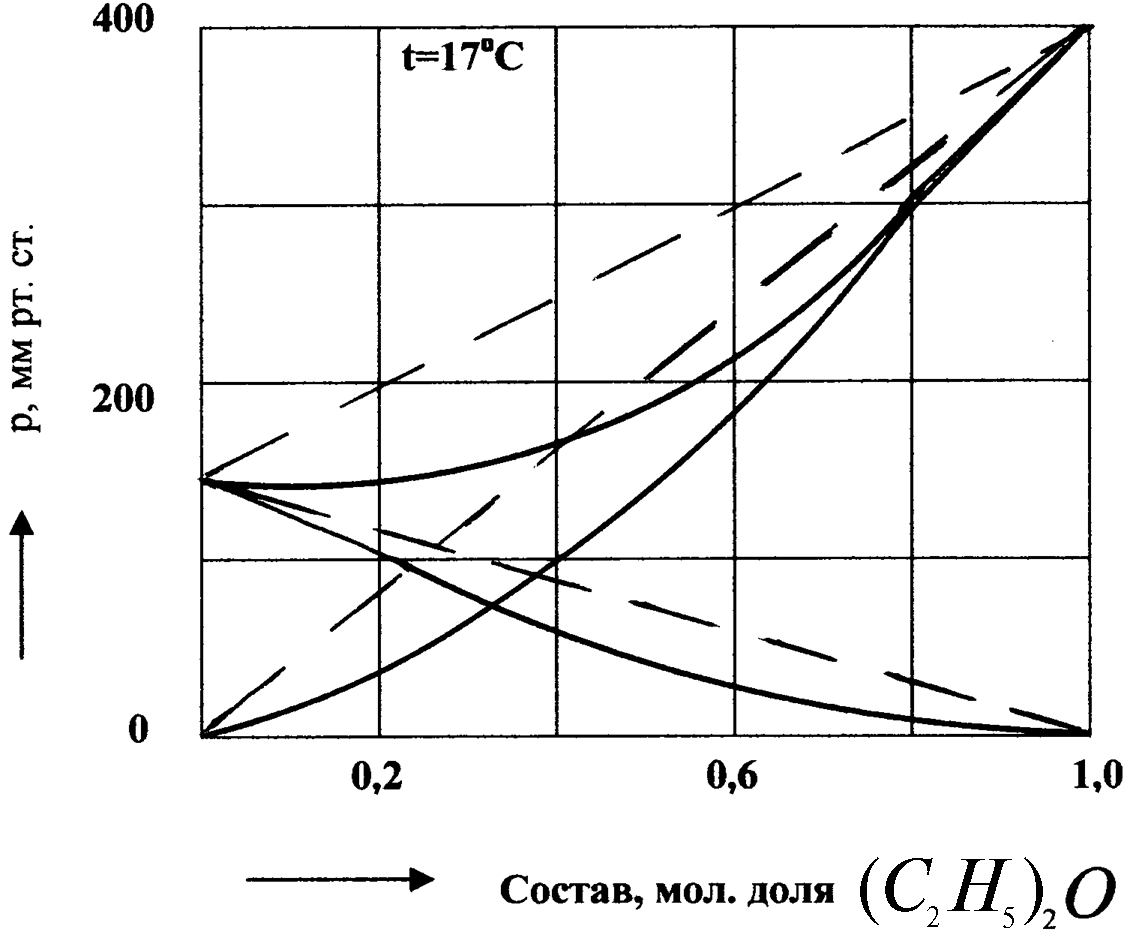
Рис.7. Диаграмма давления пара над раствором (С2Н5)2О - СНСl3.
Величины общего давления P в этих системах изменяются монотонно с изменением величины х. Если отклонения от закона идеальных растворов велики, то кривая общего давления пара проходит через максимум или минимум.
Положительные и отрицательные отклонения реальных растворов от закона Рауля обусловлены разными факторами. Если разнородные молекулы в растворе взаимно притягиваются с меньшей силой, чем однородные, то это облегчит переход молекул из жидкой фазы в газовую фазу (по сравнению с чистыми жидкостями) и будут наблюдаться положительные отклонения от закона Рауля. Усиление взаимного притяжения разнородных молекул в растворе (сольватация, образование водородной связи, образование химического соединения) затрудняет переход молекул в газовую фазу, поэтому будут наблюдаться отрицательные отклонения от закона Рауля.
Следует иметь в виду, что факторы, вызывающие положительные и отрицательные отклонения, могут действовать в растворе одновременно, поэтому наблюдаемые отклонения часто являются результатом наложения противоположных по знаку отклонений. Одновременное действие противоположных факторов особенно наглядно проявляется в растворах, в которых знак отклонений от закона Рауля - Генри изменяется с изменением концентрации.
