
- •Введение
- •Физическая химия § 1. Предмет физической химии. Ее значение
- •§ 2. Краткий очерк истории развития физической химии
- •§ 3. Разделы физической химии. Методы исследования
- •Глава I первый закон термодинамики § 1. Энергия. Закон сохранения и превращения энергии
- •§ 2. Предмет, метод и границы термодинамики
- •§ 3. Теплота и работа
- •§ 4. Эквивалентность теплоты и работы
- •§ 5. Внутренняя энергия.
- •§6. Первое начало термодинамики.
- •§ 7. Уравнения состояния.
- •§ 8. Калорические коэффициенты
- •§ 9. Работа различных процессов
- •§ 10. Теплоемкость. Вычисление теплоты различных процессов
- •§ 11. Энтальпия
- •§ 12. Применение первого закона термодинамики к идеальным газам
- •Глава II. Второй закон термодинамики
- •§ 1. Самопроизвольные и несамопроизвольные процессы
- •§ 2. Второй закон термодинамики
- •§ 3. Методы расчета энтропии
- •§ 4. Постулат Планка. Абсолютные значения энтропии
- •Глава III энергия гельмгольца. Энергия гиббса. Приложения второго закона термодинамики
- •§ 1. Энергия Гельмгольца
- •§ 2. Энергия Гиббса
- •§ 3. Фазовые переходы. Уравнение Клапейрона—Клаузиуса
- •§ 4. Фазовые переходы первого рода. Плавление. Испарение
- •§ 5. Зависимость давления насыщенного пара от температуры
- •Глава IV термодинамика растворов. Газовые смеси (растворы)
- •§ 1. Растворы (определение). Концентрация.
- •§ 2. О молекулярной структуре растворов
- •§ 3. О теориях растворов
- •Глава V. Равновесие: жидкий раствор — насыщенный пар
- •§ 1. Давление насыщенного пара бинарных жидких растворов
- •§ 2. Закон Рауля. Идеальные растворы. Предельно разбавленные растворы
- •§ 3. Реальные растворы. Положительные и отрицательные отклонения от закона Рауля
- •§ 4. Диаграммы равновесия жидкость - пар в бинарных системах. Первый закон Коновалова. Фракционная перегонка
- •§ 5. Температура кипения растворов нелетучих веществ. Эбуллиоскопия Температура замерзания растворов нелетучих веществ. Криоскопия
- •§ 6. Второй закон Коновалова. Азеотропные растворы
- •Глава VI равновесие жидких растворов с газами. Некоторые классы растворов
- •§ 1. Растворимость газов в жидкостях
- •§ 2. Влияние давления на растворимость газов. Закон Генри
- •§ 3. Зависимость растворимости газов от температуры
- •§ 4. Влияние третьего компонента на растворимость газов
- •§ 5. Совместная растворимость нескольких газов
- •Глава VII. Предмет коллоидной химии
- •§1. Определение предмета коллоидной химии
- •§2. Признаки объектов коллоидной химии
- •§3. Значение коллоидной химии
- •Глава VIII. Поверхностные явления и адсорбция
- •§1. Поверхностное натяжение.
- •§2. Когезионные и поверхностные силы
- •§3. Зависимость энергетических параметров поверхности от температуры
- •5. Самопроизвольное уменьшение поверхностной энергии и формирование поверхностного слоя
- •Глава IX. Адсорбция и поверхностное натяжение
- •§1. Виды адсорбции, ее количественные характеристики и их связь с параметрами системы
- •§2. Фундаментальное адсорбционное уравнение Гиббса и примеры его применения
- •§3. Поверхностная активность. Поверхностно-активные и инактивные вещества
- •§4. Мономолекулярная адсорбция. Изотерма адсорбции Ленгмюра
- •§5. Теория полимолекулярной адсорбции бэт
- •§6. Изотермы адсорбции и поверхностного натяжения растворов пав.
- •§7. Классификация и общая характеристика поверхностно-активных веществ. Правило Дюкло – Траубе
- •§8. Хроматография. Основы метода.
- •Глава хi. Адгезия, смачивание и растекание жидкостей
- •§1. Адгезия и работа адгезии
- •§2. Смачивание и краевой угол. Закон Юнга
- •§3. Связь работы адгезии с краевым углом
- •§4. Флотация
- •§5. Моющее действие пав. Роль пав в повышении нефтеотдачи пластов
- •Глава XII. Капиллярные явления
- •§1. Влияние кривизны поверхности на внутреннее давление. Закон Лапласа
- •§2. Капиллярные явления. Формула Жюрена
- •§3. Роль капиллярных явлений при вытеснении нефти водой из пористых сред
- •Глава XIII. Дисперсные системы
- •§1. Классификация дисперсных систем
- •§2. Два метода получения дисперсных систем – диспергирование и конденсация
- •§3.Молекулярно-кинетические свойства дисперсных систем
- •§4. Устойчивость дисперсных систем
- •§5. Седиментация
- •§6. Седиментационный анализ дисперсности
- •§7. Диффузионно-седиментационное равновесие.
- •§8. Агрегативная устойчивость дисперсных систем
- •§9. Стабилизация и разрушение эмульсий
- •Дисперсные системы с жидкой дисперсной фазой и жидкой дисперсионной средой называются эмульсиями.
- •Глава XIV. Структурно-механические свойства дисперсных систем
- •§1. Основные понятия и идеальные законы реологии
- •§2. Вязкость
- •§3. Моделирование реологических свойств тел
- •§4. Классификация дисперсных систем по структурно-механическим свойствам
- •§5. Реологические свойства дисперсных систем
- •Д. Ю. Митюк, в. И. Фролов физическая и коллоидная химия
- •117917, Москва, Ленинский проспект, д. 65
§ 2. О молекулярной структуре растворов
Представление о жидкости, как о совершенно аморфной фазе, в которой молекулы расположены хаотически, подобно молекулам газа, в настоящее время оставлено. Исследования по рассеянию света и рентгеновского излучения показали, что жидкости обладают элементами кристаллической структуры (наличием так называемого ближнего порядка в расположении молекул) и в этом отношении являются промежуточным образованием между твердыми кристаллами и газами. По мере нагревания жидкости сходство ее структуры с кристаллами уменьшается и увеличивается сходство с газами.
Взаимодействие между молекулами в индивидуальных жидкостях является в основном ван-дер-ваальсовым взаимодействием(ВВВ) Под этим названием объединяются несколько типов межмолекулярного притяжения, являющихся частными случаями электростатического взаимодействия. К ним относятся: ориентационное притяжение между молекулами с постоянным диполем, индукционное притяжение между молекулами с постоянным диполем и молекулами с наведенным диполем и дисперсионное притяжение между мгновенными диполями молекул, момент которых колеблется около нуля.
Энергия взаимного притяжения молекул для всех указанных типов взаимодействия обратно пропорциональна приблизительно шестой степени расстояния между молекулами. Указанные взаимодействия в некоторых случаях приводят к ассоциации молекул жидкости (так называемые ассоциированные жидкости). Между молекулами ассоциированной жидкости образуются неустойчивые связи. К таким связям относится водородная связь, которая создается за счет электростатического притяжения протона одной молекулы к аниону или электроотрицательному атому (главным образом к атомам фтора, кислорода, азота, хлора) другой молекулы. Водородная связь рассматривается также как взаимодействие донорных (электронопоставляющих) и акцепторных (электроносвязывающих) центров взаимодействующих молекул. Акцептором электронов в молекулах. как правило, выступает протон (Н+), а донором электронов являются атомы с несвязанной парой электронов (-ОН, - NH2, -SH и др.) Водородная связь определяется как средняя по энергии ВВВ и характеризуется энергией 20-40 кДж/моль [1].
Притяжению молекул противодействует отталкивание, имеющее значение при малых расстояниях и обусловленное, в основном, взаимодействием электронных оболочек. Это отталкивание в совокупности с тепловым движением уравновешивает притяжение. Таким образом, устанавливаются средние равновесные расстояния между движущимися (колеблющимися, вращающимися и эпизодически перемещающимися) молекулами жидкости.
Физические процессы, в которых основную роль играют вышеназванные взаимодействия, широко применяют в нефтеперерабатывающей и нефтехимической промышленности при переработке нефти, нефтяных фракций и газообразных углеводородов. К ним относятся такие процессы подготовки нефти к первичной переработке, как деэмульсация и осушка, ректификация нефтей, процессы экстракции ценных компонентов из нефти, адсорбционного выделения парафинов из парафинистых нефтяных фракций и др.
Разделение нефтей на нефтяные фракции, выделение индивидуальных углеводородов из нефтей, нефтяных фракций, газов и газоконденсатов связано с преодолением сил межмолекулярного взаимодействия, на что затрачивается значительное количество энергии. Природу этих взаимодействий изучают на основе знания законов и методов физики , химии, термодинамики, кристаллохимии, квантовой химии и квантовой механики, статистической физики и термодинамики.
Термодинамической мерой молекулярного взаимодействия в жидкости в известных границах может служить величина (U/V)P .
В растворе наряду с взаимодействием между молекулами одного из компонентов (однородные молекулы) существует взаимодействие между молекулами разных компонентов (разнородные молекулы). Эти взаимодействия при отсутствии химической реакции, так же как и в чистой жидкости, являются ван-дер-ваальсовыми. Однако молекулы растворенного вещества (второго компонента), изменяя окружение молекулы растворителя (первого компонента), могут существенно изменять интенсивность взаимодействия между молекулами последнего и сами взаимодействовать между собой иначе, чем в чистом втором компоненте. Взаимодействие между разнородными молекулами может следовать иным закономерностям, нежели взаимодействие между однородными молекулами.
Тенденции к ассоциации (соединение однородных молекул) и сольватации (соединение разнородных молекул) являются конкурирующими.
Рассмотрим здесь в качестве примеров диаграммы, изображающие зависимость некоторых свойств бинарных жидких систем от их состава, по которым можно установить наличие химического соединения между компонентами раствора. На рис.4 изображены изотермы теплоты смешения (Q) компонентов, объемного сжатия (V) при смешении и вязкости () растворов пиперидин - аллиловое горчичное масло (C3N5NCS). Все свойства обнаруживают более или менее резкий излом в максимуме при отношении компонентов 1:1. Точка излома в максимуме, называемая сингулярной точкой, указывает на образование прочного химического соединения, содержащего компоненты в приведенном отношении.
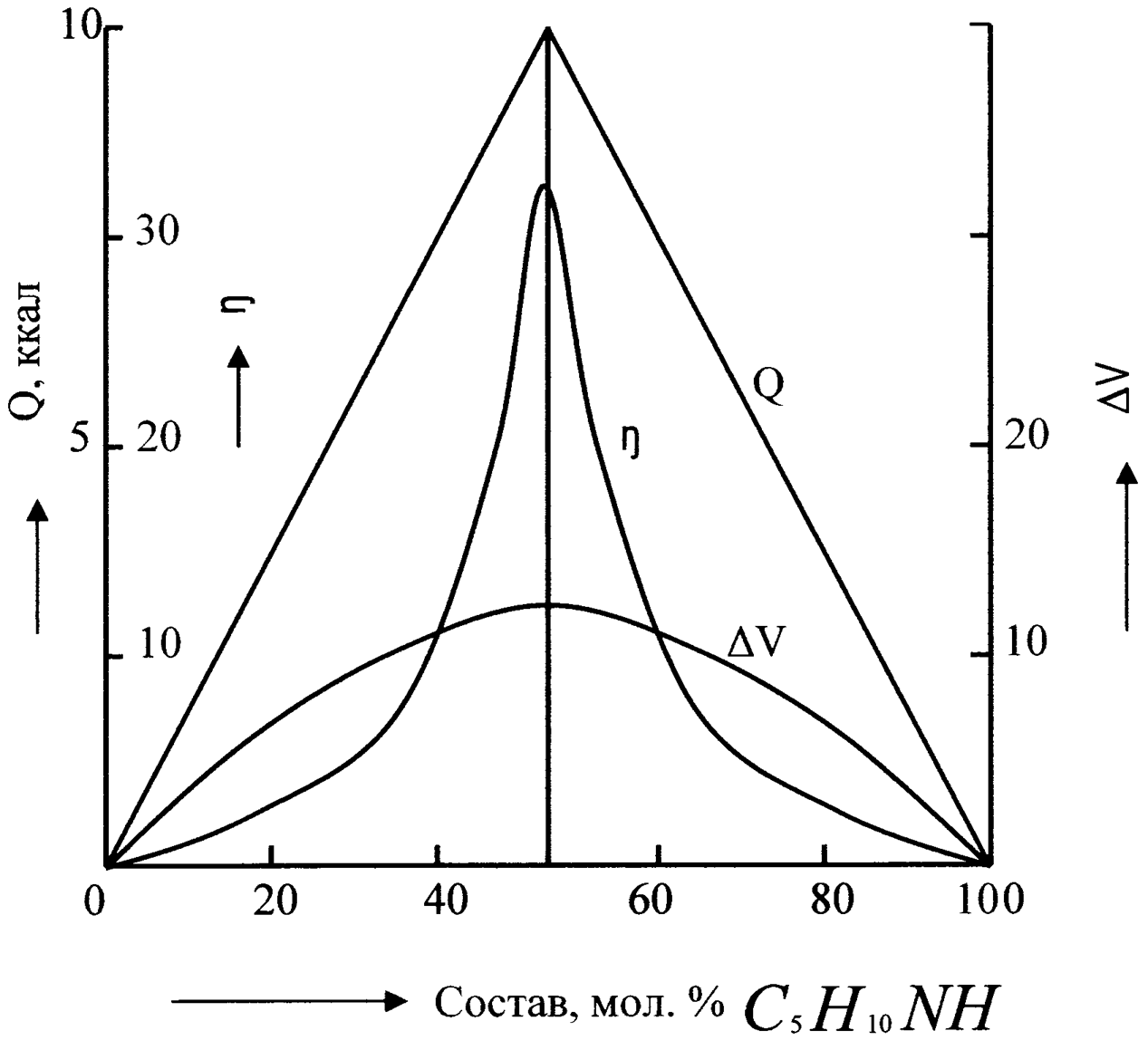
Рис.4. Зависимость некоторых свойств раствора С3Н5NCS - C5H10NH от состава.
Таким образом, физико-химический анализ однофазных жидких систем дает в отдельных случаях отчетливые указания на существование определенных химических соединений. Большей же частью, существование определенных соединений в растворе не может быть установлено.
