
- •Деякі найпоширеніші автоімунні захворювання, класифіковані відповідно до їх “органоспецифічності” чи “системності”
- •6. Серозит:
- •Схеми лікування у хворих на Автоімунний гепатит
- •Діагностичні критерії вузликового поліартеріїту
- •Діагностичні критерії гранульоматозу вегенера
- •Діагностичні критерії синдрому чарджа-стросса
- •Діагностичні критерії гігантоклітинного артеріїту
- •Критерії діагностики неспецифічного аортоартеріїту (хвороба Такаясу, Arend w.P. Et al. 1990)
- •Діагностичні критерії хвороби кавасакі
- •Міжнародні критерії хвороби бехчета
- •Діагностичні критерії геморагічного васкуліту –
- •Діагностичні критерії есенціального кріоглобулінемічного васкуліту
- •III. Вірусні:
Діагностичні критерії геморагічного васкуліту –
ПУРПУРИ ШЕНЛЯЙНА-ГЕНОХА (Mills J.A. et al., 1990)
Критерії |
Характеристика |
1. Пурпура, яка пальпується |
Дещо підвищені над поверхнею шкіри геморагічні висипання, які не зв’язанні з тромбоцитопенією |
2. Вік |
Вік початку хвороби < 20 років |
3. Біль у животі |
Дифузні болі живота, що посилюються після прийому їжі або ішемія кишечника (може бути кишкова кровотеча) |
4. Виявлення гранулоцитів при біопсії |
Гістологічні зміни характеризуються виявленням гранулоцитів у стінці артеріол і венул |
Діагностичні критерії есенціального кріоглобулінемічного васкуліту
Критерії |
Характеристика |
1. Зміни шкіри |
Підкреслені акрально-лейкоцито-кластичні і/або некротизуючі ураження шкіри |
2. Провокаційний фактор |
Поява або посилення на холоді або на вітрі |
3. Морфологічні зміни |
Гістологічне виявлення васкулопатії дрібних судин (артеріол, капілярів, венул) |
4. Лабораторні особливості |
Виявлення чіткого (не слідового) холодонестійкого сироваткового або плазмового білка (кріоглобуліну, кріофібриногену) |
Загальними лабораторними ознаками СВ є анемія, лейкоцитоз, збільшення ШОЕ, еозинофілія. Спостерігається незначне збільшення рівня печінкових ферментів. Гіпергаммаглобулінемія та збільшення рівня С-реактивного протеїну – часто відповідають активності СВ. Зміни аналізів сечі є несприятливим прогностичним показником в розвитку СВ. Зміни коагулограми з проявами гіперкогуляційних змін є характерними для СВ. Морфологічні дослідження використовуються як провідні в постановці діагнозу СВ. Гістологічний аналіз пошкоджених ділянок шкіри, нирок, легень дають позитивні результати майже в усіх випадках, які є специфічними до певних СВ. За допомогою імунофлюоресцентного аналізу можна виявити в клітинах-мішенях при СВ фіксовані імунні комплекси: комплементзалежні (С3R) – та комплементфіксовані (за FcR). Проведення мікробіологічних досліджень має важливе значення для визначення збудників та призначення специфічної терапії у хворих на СВ.
При СВ зростає продукція білків запалення: С-реактивного протеїну, фібронектину, амілоїну А тощо.
Характерними для більшості первинних та деяких вторинних СВ є виявлення ЦІК, при останніх часто знаходять також ревматоїдний фактор. Кріоглобуліни часто виявляються при СВ, але їх рівень особливо високий у хворих на есенціальний змішаний кріоглобулінемічний васкуліт.
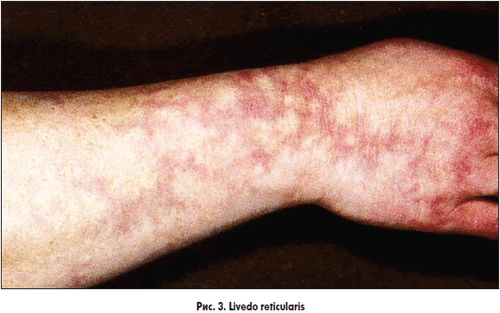
Особливо важливим при СВ є визначення АНЦА (класичних та перинуклеарних). Класичні АНЦА представлені в більшості випадків антитілами до протеази-3. Вони зустрічаються при хворобі Вегенера, вузликовому поліартеріїті, синдромі Чарджа-Стросса. Перинуклеарні АНЦА – це антитіла в більшості до мієлопероксидази і діагностуються в хворих на мікроскопічний поліангіїт, синдром Чарджа-Стросса, хворобу Крона, автоімунний гепатит, хворобу Шегрена, ревматоїдний артрит, системний червоний вовчак, хворобу Кавасакі, геморагічний васкуліт. Антифосфоліпідні АТ виявляються найчастіше при хворобі Кавасакі, вузликовому поліартеріїті, вовчаковому васкуліті. Антитіла до кардіоліпіну зустрічаються при хворобі Бехчета.
Антиедотеліальні антитіла при СВ виявляються у випадку пошкодження ендотелію крупних та середніх судин. Руйнування базальної мембрани, внутрішньої еластичної мембрани, медії веде до виявлення антибазальних, антиколагенових, антиеластичних антитіл. Важливе значення має виявлення фактора Віллебрандта, високих концентрацій тромбомодуліну. Пошкодження епітелію супроводжується зростанням розчинних форм молекул адгезії. Діагностично важливим є визначення маркерів апоптозу на нейтрофілах, макрофагах, ендотеліоцитах.
Виявлення специфічних маркерів вірусних і бактерійних інфекцій імунологічними методами, особливо динамічне спостереження за ними, є важливим для встановлення етіології СВ та призначення таким хворим етіотропної терапії.
Лікування СВ є складною проблемою. Застосування етіотропної терапії малоефективне, бо в значній кількості випадків причина СВ невідома. Навіть при верифікованому інфекційному походженні етіотропна терапія ефективна лише на початкових стадіях васкуліту.
Імунотерапія. Більш широко та ефективно використовується базова патогенетична терапія – здебільшого імуносупресивна (глюкокортикоїди та цитостатики). З метою зменшення активності процесу при СВ широко використовується плазмаферез.
Основними методами лікування антитілоасоційованних та імунокомплексних СВ залишаються глюкокортикостероїди (ГКС) і імунодепресанти. Серед яких перевагу надають алкілюючим сполукам (циклофосаміду). Використовуються різні методи лікування: прийом препаратів per os і пульс-терапія надвисокими дозами у поєднанні з плазмаферезом, особливо у хворих з швидко прогресуючим нефритом.
Лікування цитостатиками дає можливість досягти ремісії у 85 % випадків, прогноз у яких до недавнього часу залишається фатальним. При підгострому перебігу антитілозалежних СВ без ураження нирок може бути назначене лікування метотрексатом (0,3 мг/кг в тиждень).
Для підтримки ремісії при антитілозалежних СВ використовують триметоприм-сульфаметоксазол (бісептол), який також ефективний при локальних формах хвороби і інфекційних ускладненнях. Часто призначають азатіоприн (імуран). З’явились окремі повідомлення про ефективність нового імуномодулювального препарату лефлуноміду для підтримання ремісії в хворих на СВ.
У 10 % хворих на антитілозалежний СВ при лікуванні імунодепресантами і ГКС ремісія не досягається. У рефрактерних випадках додатково призначають імуноглобуліни внутрішньовенно. Ефективність лікування зростає при використанні засобів системної ензимотерапії (вобензим, флогензим, рибатран). При синдромі Чарджа-Стросса, резистентному до традиційної терапії, застосовують α-інтерферон. Ефективність терапії з використанням моноклонових антитіл (анти-СD4, анти-СD52), антилімфоцитарного глобуліну поки що переконливо не доведена.
Персистування інфекційного агента не є обов’язковим фактором для прогресування васкуліту. Навпаки, у багатьох випадках імуносупресивна терапія зберігає життя хворим, при цьому вони не вмирають від загострення інтеркурентної інфекції. Але можлива подальша реплікація вірусів і прогресування клітин-мішеней, тому при вірусасоційованних СВ запропоновано лікування плазмаферезом в поєднанні з противірусною терапією. Противірусні препарати пригнічують реплікацію вірусів гепатитів і герпесів та сприяють сероконверсії. Серед противірусних засобів найчастіше використовують препарати інтерферонів і нуклеозидів. Це лікування не виправдане у пацієнтів, інфікованих мутантними вірусами, а також при нирковій і серцевій недостатності, органічних ураженнях ЦНС.
У лікуванні більшості СВ глюкокортикостероїди залишаються основним патогенетичним засобом, але тривале їх використання призводить до небажаних ускладнень: остеопорозу, артеріальної гіпертензії, стероїдного діабету. Тому при рецидивних формах клітинозалежних СВ пропонується включення в схему лікування препаратів, що зменшують потребу в глюкокортикостероїдах. Для цієї мети рекомендують азатіоприн або метотрексат в низьких дозах.
Доведено, що метотрексат ефективніший, ніж великі дози стероїдів. При агресивних формах перебігу неспецифічного аортоартеріїту повинен використовуватись циклофосфан. У лікуванні хвороби Вегенера, Бехчета, вовчакового васкуліту широко призначають циклоспорин А.
Застосування довенних імуноглобулінів у лікування СВ значно зросло за останні роки і особливо ефективне при хворобі Кавасакі, геморагічному васкуліті. Використовуються в терапії СВ інші білкові препарати, особливо з ретроплацентарної крові та рекомбінантного походження.
Ефективність бісептолу (котримоксазолу) може бути пов’язана не тільки з антибактерійною, але і з м’якою імуносупресивною і антиоксидантною дією цього препарату.
У комплексному лікуванні СВ використовуються також дезагреганти, блокатори кальцієвих каналів, антикоагулянти, інгібітори серинових протеаз C1r i C1s, лізосомальних ферментів, ангіотензинперетворюючого ензиму тощо.
Реактивні артрити
Реактивні артрити (РА) «стерильне» запалення одного чи декількох суглобів, яке виникає внаслідок імунних розладів у середньому через 1-3 тижні після інфекції, локалізованої на відстані від ураженого суглоба. Значно рідше РА формуються одночасно з інфекційним процесом (як правило, у даному випадку рецидивним). При цьому ні сам збудник, ні його антигени при застосуванні стандартних методик дослідження у порожнині суглоба не визначаються.
Етіологія. У 22 % випадків формування РА пов’язане з хламідійною інфекцією (синдром Рейтера), у 20 % з єрсиніозною, у 8 % з іншими ентеробактеріями, у 12 % із стрептококами, у 9 % із стафілококами, у 4 % із змішаною інфекцією, у 20 % збудник не виявляється. Вважається також доведеним зв’язок РА з вірусами (Коксакі, гепатитів В і С) і грибами.
Імунопатогенез. Вирішальним фактором патогенезу, який визначає імуногенетичну схильність до РА, є наявність HLA B27 і CW2 антигенів. У багатьох хворих ці антигени можуть перехресно реагувати з антигенами вірусу чи бактерії. Вважається також, що наявність названих HLA-антигенів тісно пов’язана з недостатністю супресорної функції Т-лімфоцитів. У таких пацієнтів надмірна імунна відповідь макроорганізму на мікробні антигени, які знаходяться поза порожниною суглоба, призводить до утворення імунних комплексів та відкладання їх у синовіальній оболонці і формування запального процесу.
Загальні клініко-анамнестичні прояви типових РА (за А. Свінціцьким, 1999):
виникнення захворювання в осіб молодого віку (до 30-40 років);
хронологічний зв’язок з інфекцією, тобто розвиток суглобового синдрому через 2-4 тижні після епізоду інфекції;
гострий початок з вираженими місцевими і загальними ознаками запалення;
моно-, оліго-, рідше поліартикулярний тип ураження суглобів, з вираженою асиметрією суглобових змін, переважно в суглобах нижніх кінцівок, часто з ураженням сухожильно-зв’язкового апарату і бурс (ахілобурсит, підп’ятковий бурсит);
часте втягнення ілеосакральних суглобів (переважно однобічне) і хребта;
наявність інших ознак системного процесу (ураження серця, кишок, шкіри, суглобів тощо);
відсутність у сироватці крові ревматоїдного фактора;
часте виявлення у хворих антигену HLA-B27;
відносно доброякісний, хоч і торпідний, перебіг процесу, часто з повним зворотним розвитком симптомів запалення суглобів, але зі схильністю до рецидивування чи навіть хронізації захворювання приблизно в третини хворих. Але навіть при цьому зміни в суглобах щезають через 1-2 роки.
Крім типових варіантів перебігу РА, розрізняють декілька особливих форм, які відрізняються за перебігом і вирізняються як окремі нозологічні одиниці.
До таких варіантів належить ревматичний поліартрит. Виходячи з наявності дуже характерної клінічної картини ревматизму та історичних причин, ревматизм на сьогодні розглядається у більшості країн як окрема хвороба. Класичними особливостями, які відрізняють ревматизм від інших РА, є раннє ураження міокарда з порушенням функції провідності й збудливості, частим формуванням вад серця.
Особливою формою РА вважається також хвороба Рейтера. Її особливостями є часте ураження інших органів і систем (очей, шкіри, слизових оболонок, кишок, сечостатевої системи) з формуванням системного процесу.
На сьогодні вважається, що хвороба Бехтєрєва теж належить до реактивних артропатій.
Пусковим фактором може бути кишкова інфекція, зумовлена Klebsiella pneumoniae. Особливостями ураження суглобів при цьому є характерне ураження міжхребцевих суглобів, двобічний сакроілеїт (при інших РА частіше однобічний), відсутність кальцифікації зв’язок хребта.
Лікування РА полягає у санації вогнища інфекції та пригніченні активності запального процесу в суглобах.
Для санації вогнищ необхідно враховувати чутливість збудників до протибактерійних засобів. Але при відсутності результатів антибіотикограми найкраще застосовувати антибіотики з урахуванням локалізації вогнища.
Так, при кишкових інфекціях оптимальним є застосування аміноглікозидів (гентаміцин, нетроміцин, амікацин), амфеніколів (левоміцетин), нітрофуранів (ніфуроксазид). При урогенітальних процесах найкраще призначати цикліни (доксициклін, міноциклін, лізоклін) або макроліди (кларитроміцин, рокситроміцин, джозаміцин). При ЛОР-інфекціях засобами вибору є цефалоспорини ІІ-ІІІ поколінь, за необхідності разом з місцевою протизапальною терапією.
Застосування антибіотиків пеніцилінової групи, особливо при рецидивному перебігу, не доцільне, оскільки може призвести до утворення L-форми збудників (наприклад, хламідій) і посилити резистентність до протимікробних засобів.
Імунотерапія. Для впливу на імунокомплексний запальний процес, як правило, застосовують протизапальні засоби (теноксикам, мелоксикам, напроксен, суліндак). Перевагу слід надавати селективним інгібіторам ЦОГ-2 (мелоксикам), які у меншій мірі подразнюють слизові оболонки.
Глюкокортикоїди призначають при неефективності нестероїдних засобів, системних проявах, частих рецидивах. При моноартритах гормони іноді застосовують місцево (внутрішньосуглобово або білясуглобово).
При затяжних і хронічних формах додатково призначають препарати амінохінолінового ряду (плаквеніл, делагіл).
Цитостатики застосовують вкрай рідко, лише при наявності системних поліорганних уражень і швидко прогресуючого перебігу, а також у разі резистентності до стероїдної терапії. Серед цитостатиків перевагу надають циклофосфану, рідше метотрексату.
Ефективність імуносупресивної терапії та чутливість організму до медикаментів зростає після проведення інтенсивних детоксикаційних заходів. Якщо при зниженні чутливості до нестероїдних протизапальних засобів іноді буває достатньо курсу ентеросорбційної терапії, то за умови призначення цитостатиків необхідно провести гемосорбцію чи лімфоцитоплазмаферез.
ЕОЗИНОФІЛЬНИЙ СИНДРОМ
Еозинофілія – це збільшення числа еозинофільних лейкоцитів більше нормальних значень (0,2 Г/л) при проведенні диференційного підрахунку лейкоцитів у абсолютних значеннях. Рівень еозинофілів у організмі є суворо регульований. При певних захворюваннях еозинофіли можуть селективно накопичуватись у периферичній крові або в певних тканинах організму та зумовлювати складні клінічні і/або лабораторні прояви.
Можна виділити такі причини еозинофілії:
паразитарні інвазії, особливо тканинні паразити (тріхінельоз, ехінококоз, шистосомоз), рідше – кишкові паразити, тропічна еозинофілія ( в основному – філяріатоз) тощо;
алергічні захворювання: бронхіальна астма, кропив’янка, ангіоневротичний набряк, сінна лихоманка, деякі випадки підвищеної чутливості до лікарських препаратів;
хвороби системи крові: хронічний мієлолейкоз, справжня поліцитемія, перніціозна анемія, хвороба Ходжкіна, стан після спленектомії;
шкірні захворювання: міхурниця, шкірний лишай, еозинофільний целюліт (синдром Велля) та інші;
хвороби легень: синдром Леффлера, легенева інфільтрація з еозинофілією (ЛІЕ-синдром);
саркоїдоз;
інфекційні хвороби: туберкульоз, скарлатина, кір, лімфохоріональний вірус, стафілококова інфекція;
пухлини всіх типів, особливо при метастазуванні і некрозі пухлини;
системні васкуліти (синдром Чарджа-Стросса, вузликовий поліартеріїт);
автоімунні хвороби сполучної тканини: системний червоний вовчак, ревматоїдний артрит, склеродермія, еозинофільний фасціїт (синдром Шульмана), еозинофільний міозит;
хвороби шлунково-кишкового тракту: еозинофільна гастроентеропатія, виразковий коліт;
хвороби серця: синдром Дресслера, еозинофільний міокардит Кімурі, ендокардит Леффлера;
опромінення;
паління;
деякі отруєння (нікель, свинець);
адреналова гіперпродукція;
спадкові хвороби: лімфогістіоцитоз, синдром Джоба, тяжкий вроджений імунодефіцит, тромбоцитопенія в поєднанні з відсутністю променевої кістки;
недоношеність;
гіпервітаміноз вітаміну В12 (ціанокобаламіну).
Імунопатогенез. Еозинофілія зустрічається як результат чотирьох процесів:
1) посилення диференціації попередників клітин і проліферації еозинофілів у кістковому мозку;
2) активації взаємодії між еозинофілами і ендотеліальними клітинами, що веде до збільшення адгезії та міграції еозинофілів;
3) посилення хемокінових зв’язків з еозинофілами;
4) розлади активації та деструкції зрілих еозинофілів.
Клінічні аспекти еозинофілії. При клінічному обстеженні хворих з еозинофілією виявляються певні скарги.
1. Локальна підвищена чутливість та біль м’язів при натискуванні та після незначного фізичного навантаження.
2. Повзучі висипки, гранульоми на шкірі.
3. Спазми, болі в животі, блювота, бігунець, іноді з домішками крові.
4. Болючість при сечовипусканні.
5. Велика кількість хвороб і багато клінічних симптомів у одного хворого.
У хворого з еозинофілією варто вияснити додаткові дані анамнезу.
1. Тривалість симптомів хвороби.
2. Зв’язок симптомів з подорожами, контактом з токсичними речовинами, прийомом медикаментів.
3. Локальний чи генералізований характер симптомів.
4. Зв’язок генералізації симптомів зі зниженням маси тіла, загальною слабістю.
5. Детальний терапевтичний анамнез хворого за органами і системами.
6. Спадковий анамнез.
7. Особливості способу життя.
8. Лікувальні заходи в анамнезі (променева терапія, гемодіаліз).
9. Недоношеність.
Еозинофілія зустрічається в різноманітних варіантах і довільно класифікується як:
помірна та виражена (0,2-1,5 Г/л);
висока (> 1,5 Г/л);
надвисока (> 5,0 Г/л).
Більшість причин еозинофілії пов’язані з паразитарною та гельмінтною інфекціями, а ще частіше вона зустрічається в індустріальних регіонах, де поширені атопічні захворювання. При диференційній діагностиці еозинофілії необхідно розглядати історію хвороби пацієнта, яка може зазначати: кон’юктивіт, задишку, екзему (ознаки, що вказують на наявність атопічного захворювання), наявність протозойної інфекції, симптоми раку чи приймання медикаментів.
Найчастіше зустрічається помірна еозинофілія. Вона інколи може супроводжуватись тканинними пошкодженнями такими як при пневмонії, підвищеним відчуттям болю в м’язах, суглобах. Вибіркове накопичення еозинофілів в окремих органах і тканинах характерне для таких хвороб: еозинофільний целюліт (синдром Велля), еозинофільна пневмонія (синдром Лефлера), еозинофільне запалення фасції (синдром Шульмана). Асоціації еозинофілії з васкулітами, нейропатією та бронхіальною астмою вказує на наявність синдрому Чарджа-Стросса. Виражена і стабільна еозинофілія інколи ще супроводжується лейкоцитозом і спостерігається при пухирчатці, при шкірному лишаї. Еозинофілія виявляється в пацієнтів з ексфоліативним дерматитом, псоріазом, шкірним свербежем, екземою, токсичним дерматитом, іхтіозом, грибковими захворюваннями.
Висока еозинофілія буває присутня при медикаментозній алергії, еозинофільній лейкемії і супроводжується розмноженням молодих форм клітин у кістковому мозку чи крові і каріотипічною атиповістю.
Надвисока еозинофілія найчастіше зустрічається при паразитарних хворобах (трихінельоз, ехінококоз, філяріатоз). За відсутністю або недостатності етіологічних факторів надвисокої еозинофілії та кінцевого органа-мішені слід обміркувати діагноз ідіопатичного еозинофільного синдрому.
Діагностика еозинофілії у пацієнтів (слід обстежувати пацієнтів із стійкою, помірною та вираженою еозинофілією) включає морфологічний аналіз мазків крові, сечі, мокроти, серійні дослідження випорожнень на яйця і паразитів, імунологічні показники.
Кістковий мозок і хромосомний аналіз (для знаходження лейкозу) і тканинна біопсія можуть бути показовими теж при обстеженні хворих з високою та надвисокою еозинофілією.
Пацієнтів з еозинофілією слід періодично обстежувати ехокардіографічно та Х-променево, щоб встановити еозинофільне пошкодження серця чи легень. При високій і надвисокій еозинофілії іноді з діагностичною метою для встановлення її природи призначають глюкокортикоїди (преднізолону в дозі 1 мг/кг маси тіла на день, від 3 до 5 днів).
У першу чергу клінічному імунологу треба віддиференціювати інвазивну еозинофілію. Інвазія багатоклітинними паразитами є причиною значної і тривалої еозинофілії, рідше вона викликається найпростішими. Якщо паразити утворюють капсулу, то виникає слаба запальна реакція і незначна еозинофілія, тоді як їх проникнення в тканини приводить до вираженого збільшення концентрації еозинофілів. Еозинофілія при цьому захворюванні з’являється на 1-2-му тижні, досягає максимальних значень до кінця 3-го тижня і зберігається 6 місяців і довше. Виявлені випадки, при яких еозинофіли в таких хворих складали 85 % загальної кількості лейкоцитів, а їх абсолютна кількість дорівнювала 5,0 Г/л (трихінельоз).
При ехінококозах еозинофілія є незначною, але інколи буває і яскраво вираженою. Частіше за все еозинофілія має місце у зв’язку з виходом вмісту ехінококових кіст в тканини. При нагноєнні цих кіст еозинофілія зникає і розвивається нейтрофільоз.
На ранніх стадіях цистицеркозу виявляється помірна еозинофілія, яка зникає після інкапсулювання паразита. Також вона спостерігається в людини при токсоплазмозі. При шистосомозі еозинофілія може зустрічатись впродовж інкубаційного періоду. У крові пацієнтів з інфекцією реєструється від 20 до 78 % еозинофілів. Виражене збільшення кількості еозинофілів спостерігається за 24-36 годин до нападу малярії. Після періоду лихоманки і початку лікування хворого кількість еозинофілів повертається до свого висхідного рівня приблизно за 10 днів.
Інвазія кишкових паразитів рідше супроводжується еозинофілією і є незначно вираженою. Проте, збільшення вмісту еозинофілів до 10-30 % і навіть до 69 % може бути при стронгілоїдозі на ранніх стадіях, а при аскаридозі еозинофілія супроводжується діареєю і абдомінальними болями.
Під терміном «тропічна еозинофілія» описаний синдром, що зустрічається в Індії, південно-східній Азії, а останнім часом – і в Європі. Він починається з поступово наростаючого нездужання, потім іде втрата ваги, незначна лихоманка, покашлювання і, врешті, фізикальні симптоми, схожі з такими, як при бронхіальній астмі. У крові виявляють лейкоцитоз і тяжку еозинофілію ( від 5,0 до 60,0 Г/л). Може пальпуватись селезінка. При Х-променевому дослідженні виявляють дифузні двосторонні вкраплення в легенях, які нагадують картину дисемінованого туберкульозу. Через декілька тижнів захворювання переходить в хронічну стадію з нападами кашлю і постійними утрудненнями дихання, втрата маси переважно припиняється. Симптоми можуть зберігатись довгий час якщо не застосовувати лікування ударними дозами препаратів миш’яку чи диетиламінозину. Тропічна еозинофілія, являє собою гіперімунну реакцію, яка викликається різними паразитами, але головним чином мікрофіляріями. Філяріатоз супроводжується в 2/3 випадків значною еозинофілією.
Другою найпоширенішою причиною еозинофілії є реагінова алергія. Виявлення еозинофілії і наявність алергічного захворювання найдостовірніше підтверджується морфологічними, а також в порівнянні із шкірними пробами та визначення рівня сироваткового IgE. При алергічних станах еозинофілія переважно помірна ( загальна концентрація від 0,2 до 1,5 Г/л), але в деяких випадках може бути і вище, так при бронхіальній астмі чи ангіоневротичному набряку. Підвищена кількість еозинофілів звичайно виявляється у виділеннях слизової оболонки порожнини носа, слині алергізованих осіб. Єдиною характерною лабораторною знахідкою при алергічному риніті в період загострення є велика кількість еозинофілів у мазках носового секрету. Під час активного сезонного алергічного риніту може бути еозинофілія периферичної крові, яка досягає 12 % і більше. У пацієнтів з алергічним ринітом може бути значно підвищений рівень сироваткового IgE.
При сезонному алергічному кон’юнктивіті в слізній рідині виявляють підвищення загального рівня IgE, а також IgE, специфічних для сезонних алергенів, а також підвищений вміст еозинофілів і еозинофільного катіонного білка, що свідчить про активацію еозинофілів. Домінуючою діагностичною ознакою при встановленні діагнозу алергічного кон’юнктивіту є виявлення еозинофілів у відбитку з кон’юнктиви. У нормі в зішкрябах з кон’юнктиви еозинофіли відсутні, тому інформативною є наявність навіть однієї клітини еозинофіла.
Участь еозинофільних механізмів в формуванні секреторного середнього отиту достовірно доведено в плацебо-контрольованих дослідженнях з подвійною випадковою вибіркою і використанням назального провокаційного тесту з гістаміном і алергенами. У випотах середнього вуха виявлено медіатори еозинофільних клітин, базофілів, що веде до розвитку хронічного запалення.
Під час загострення бронхіальної астми в периферичній крові реєструється підвищена кількість активованих еозинофільних лейкоцитів, в мокроті і ділянках слизової оболонки, яка не має епітелію, виявляють еозинофіли і вироблені ними головний лужний білок і катіонні білки, які характеризується цитотоксичною активністю. Встановлено, що в пацієнтів з тяжким ступенем бронхіальної астми в кістковому мозку переважають еозинофіли; значна еозинофільна інфільтрація спостерігається і в міокарді цих хворих.
Медикаментозна еозинофілія часто виникає у відповідь на введення тих чи інших лікарських препаратів: антибіотиків пеніцилінового ряду парааміносаліцилової кислоти; дифеніну, імунодепресантів; терапевтичних цитокінів, каптоприлу, варфаміну і деяких інших лікарських препаратів. Крім того, зареєстрована еозинофільна реакція при лікуванні препаратами золота , триптофаном, йодом.
При справжній поліцитемії, мієлофіброзі, хворобі Ходжкіна часто діагностується еозинофілія до 16-23 % . Після спленектомії теж часто виявляється помірна еозинофілія разом з лімфоцитозом, які можуть тривати кілька місяців. При еозинофільному лейкозі виявляється інфільтрація легеневої тканини з ураженням міокарда і/або перикарда. Серед зареєстрованих випадків лімфобластного лейкозу і лімфом у 74 % пацієнтів виявляють еозинофільну асоціацію. Описана також еозинофілія при моносомії 7 і при мієлопроліферативних розладах. У пацієнтів з перніціозною анемією вміст еозинофілів може зростати до 20-60 %, а , окрім того, еозинофілією зазвичай супроводжується серповидно-клітинна анемія.
Для синдрому Лефлера, який характеризується перехідними клінічними проявами, і особливо інфільтрацією легеневої тканини, реакціями гіперчутливості, еозинофілія є характерною ознакою. Є різниця між синдромом легеневої інфільтрації еозинофілами (ЛІЕ-синдромом) і синдромом Лефлера. Синдром Лефлера є гострим станом, який проходить без лікування і із сприятливим розрішенням, тоді як ЛІЕ-синдром є хронічним, рецидивним захворюванням, яке супроводжується кашлем, задишкою, лихоманкою, вираженим нездужанням та іншими проявами. ЛІЕ-синдром може бути викликаний різними інфекціями (туберкульозом, кокцидомікозом, бруцельозом, вірусною чи бактерійною пневмонією). Крім того, він зустрічається при неопластичних процесах (хвороба Ходжкіна чи еозинофільна гранульома), алергічних реакціях, включаючи медикаментозну алергію та колагенози. Проте в багатьох випадках причина не є ясною, як і сам процес прояву еозинофілії без наявності відповідних сприяючих цьому стану довколишніх (внутрішніх) умов.
Саркоїдоз характеризується найчастіше двостороннім симетричним медіастенальним збільшенням лімфатичних вузлів, паренхіматозним пораженням легень, присутністю гранульом у біоптатах лімфатичних вузлів, еозинофілія тощо.
Поширений казеозний туберкульоз із пошкодженням легень та лімфатичних вузлів може супроводжуватись також еозинофілією.
Нерідко еозинофілія є важливим супроводжуючим фактором і навіть діагностичним критерієм при системних васкулітах та системних хворобах сполучної тканини.
Еозинофільно-гранульоматозне запалення з пошкодженням дихальних шляхів і некротизуючим васкулітом є характерним для синдрому Чарджа-Стросса. При цьому пошкоджуються дрібні і середні судини з проявами бронхіальної астми та еозинофілії.
Найчастіше поражаються мужчини середнього віку, які в анамнезі мають бронхіальну астму з частими нападами. Виявляються також легеневі інфільтрати, які закінчуються розвитком гранульом у легенях. У таких хворих нерідко спостерігаються алергічний риніт, рецидивний синусит і поліноз носа. Крім того, у хворих може спостерігатись еозинофільний гастрит з васкулітом кишок.
Пошкодження шкіри при еозинофілії та системних хворобах сполучної тканини характеризується більш вираженими проявами еритеми, пурпури, кропив’янки, вузликів. Еозинофілія супроводжує: вузликовий періартеріїт (близько 18 % хворих мають рівень еозинофілів, що досягає значних цифр), ревматоїдний артрит, ускладнений васкулітами і плевритами, еозинофільний фасциїт.
Алергічна еозинофільна гастроентеропатія характеризується еозинофільною інфільтрацією шлунково-кишкового тракту. Симптоми захворювання варіюють залежно від глибини ураження залучених у процес органів. При цьому часто реєструють еозинофілію периферичної крові (86,5 %), інші органи (6 %) в процес не залучуються. Найчастіше розвивається еозинофільна інфільтрація слизової оболонки різних відділів шлунково-кишкового тракту. Захворювання проявляються реєструючи наступні ознаки: після приймання їжі проявляються болі в животі, нудота, блювання, діарея, схуднення, затримка росту у дітей, наявність крові в стільці, анемія, гіпоальбумінемія, периферичні набряки. У рідкісних випадках (2,8 %) еозинофільна інфільтрація уражає очеревину, що веде до розвитку вираженого асциту. У 50 % дорослих хворих еозинофільною гастроентеропатією виявлено обтяжений алергологічний анамнез : хворі страждають бронхіальною астмою і алергічним ринітом. У хворих спостерігається також мононевропатія чи поліневропатія за типом рукавиць і панчіх. Лабораторний показник кількості еозинофілів сягає величин до 18-20 %, а також присутні наступні прояви : нормоцитарна анемія, лейкоцитоз, підвищення ШОЕ, гіпокомплементемія, збільшення ЦІК, підвищення концентрації IgE, наявність протеазних антинейтрофільних цитоплазматичних антитіл. У хворих на харчову алергію виявляють при дослідженні стільця нейтрофіли (до 7 %), еозинофіли (11-14 %).
Постінфарктний синдром Дресслера лабораторним показником якого є еозинофілія. У певних умовах вона стає діагностичною ознакою наявності саме даного, а не іншого захворювання, коли йдеться про імунозалежне ускладнення після інфаркту, або після комісуротомії, перікардіотомії. Автоімунний синдром Дресслера характеризується перикардитом, супутніми з яким є плеврит, пневмоніт і ураження синовіальних оболонок суглобів. У цьому випадку плеврит може бути сухим і ексудативним, одно- і двостороннім, з характерною клінічною картиною. Поява шуму тертя плеври звичайно сприяє правильній діагностиці (може бути запідозрений і інфаркт легені). Якщо виявляється рідина в плевральних порожнинах без попереднього шуму тертя плеври, то можлива підозра на наростання недостатності кровообігу. Ексудат, як і в порожнині перикарда, може бути серозним чи серозно-геморагічним, виявлена при цитологічному дослідженні велика кількість еозинофілів і лейкоцитів вказує саме на автоімунний синдром Дресслера ( до цього додаються ще результати об’єктивного клінічного обстеження, дані інструментальних методів тощо).
Недавно описаний еозинофільний міокардит Кімурі, який супроводжується також еозинофільною гіперпластичною лімфогранульомою. Приблизно 80 % випадків при цьому є прояви артралгій і мігруючого поліартриту з міалгіями і міозитом.
Еозинофілія реєструється при різних онкопроцесах. Так, при обстеженні 2000 пацієнтів зі злоякісними новоутвореннями еозинофілія виявлена у 0,5 %, особливо при їх метастазуванні.
Нерідко еозинофілія зустрічається в хронічних курців, а також у людей з професійними шкідливостями ( хронічний вплив свинцю, нікелю тощо).
Еозинофілія спостерігається у людей, які працюють з радіоактивними речовинами, а, отже, у людей після променевої терапії.
При ідіопатичному еозинофільному синдромі лейкоцитоз досягає 138,0 Г/л, при цьому 93 % з них – еозинофіли. Перебіг злоякісний, хворіють частіше мужчини молодого віку.
Існує також спадкова форма еозинофілії. Тип успадкування – автосомно-домінантний, перебіг захворювання доброякісний.
Підходи до імунотерапії еозинофілії. Велика кількість медикаментів інгібують продукцію еозинофілів, продуктів їх активування. Це в першу чергу глюкокортикоїди, мієлосупресорні медикаменти та α-інтерферон. Глюкокортикоїди, найбільш ефективні препарати для зниження кількості еозинофілів, пригнічують транскрипцію великої кількості генів для запальних медіаторів, включаючи гени ІЛ-3, ІЛ-4, ІЛ-5 і GM-CSF, а також різні види хемокінів. Крім того, глюкокортикоїди інгібують цитокінозалежне виживання еозинофілів. У більшості пацієнтів, які вживають системні чи локальні (дихальні чи інтраназальні) глюкокортикоїди спричинюють швидке зниження еозинофілів, проте деякі пацієнти мають резистентність до глюкокортикоїдів, що супроводжується зростанням еозинофілів, не дивлячись на високі дози. Механізм резистентності до глюкокортикоїдів незрозумілий. Пацієнти з резистентністю до глюкокортикоїдів інколи потребують іншої терапії, такої як мієлосупресивні медикаменти (циклофілін, циклоспорин) або препарати інтерферону. Інтерферон-α пригнічує дегрануляцію і ефекторну функцію еозинофілів, оскільки він блокує транскрипцію великої кількості еозинофільно-активних цитокінів (ІЛ-5, GM-CSF).
Медикаменти, які стикаються з еозинофільним хемотактичним сигналом, включають антагоністи й інгібітори лейкотрієнів. Інгібітори 5-ліпооксигенази (зилеутон) пригнічують синтез лейкотрієнів та інгібують дегенерацію хімічного зв’язку лейкотрієну В4 і сульфідопептидних лейкотрієнів. Ці медикаменти спричинюють зниження респіраторного запалення еозинофілами під час пізньої фази відповіді. Медикаменти, які блокують рецептори до лейкотрієнів D4, C4 і Е4, запобігають м’язовому скороченню і зменшуючи проникність еозинофілів, опосередковану лейкотрієнами. Деякі з третього покоління антигістамінів (цетиризин) пригнічують вакуолізацію (акумуляцію еозинофілів після дії алергенів і прямо пригнічують еозинофіли in vitro). Кромолін і недокроміл гальмують ефекторну функцію еозинофілів, зокрема їх цитотоксичність. Інгібітори фосфодіестерази пригнічують активацію еозинофілів і блокують еозинофільні ізоензими 4-го типу.
Ідентифікація молекул, які специфічно регулюють функцію чи продукцію еозинофілів, вимагає нових терапевтичних стратегій. Антитіла проти ІЛ-5 блокують алергічний компонент при хворобах, які передаються повітряно-крапельним шляхом. Створена терапевтична форма моноклонових антитіл до ІЛ-5 та еотаксинів, які блокують їх взаємодію з клітинами.
Відомі препарати, які знижують активність Tх2-лімфоцитної відповіді. Це було змодельовано в тварин при призначенні ІЛ-12 під час алергічної сенсибілізації. ІЛ-12 пригнічує продукцію ІЛ-4 і ІЛ-5, знижує пульмональну еозинофілію після контакту з алергеном.
Отже, завдання клінічного імунолога віддиференціювати еозинофілію при паразитарних, інфекційних, гематологічних та інших соматичних хворобах як консультанту і скерувати цих хворих до відповідних спеціалістів. У випадку еозинофілії алергічного, автоімунного, спадкового генезу клінічний імунолог лікує хворих і проводить за ними динамічне спостереження.
Канцерогенез. Імунологія пухлин
Визначення поняття
Канцерогенез - багатофакторний процес і багатоступеневий, що включає в себе ланцюг генетичних і епігенетичних ушкоджень клітини, конвертований на ранніх стадіях і прогресуючий лише у людей, схильних до ризику.
Причини захворювання
Агенти, які сприяють злоякісній трансформації клітини отримали назву канцерогенів. Виділяють 4 групи канцерогенів:
I. Хімічні:
1.Канцерогенні хімічні речовини - з'єднання, які ймовірно викликають утворення пухлини або хоча б викликають збільшення частоти виникнення раку.
а). Викликають або зміни в ДНК - пошкодження пуринових і піримідинових підстав, розриви полінуклеотидних ланцюгів і утворення перехресних зв'язків між ними - або індукують хромосомні аберації (зокрема, делеції хромосом).
б). Діють епігенетично, викликаючи зміни в білках, що регулюють зростання клітини.
в). Діють синергічно з вірусами (дерепрессія онкогенів) або служать промоторами для канцерогенних речовин.
2. Харчові канцерогени.
3. Канцерогени-гормони: а). Естрогени. б). Глюкокортикоїди.
II. Фізичні канцерогени: (різні види випромінювання, що приводять до розвитку пухлин, найбільш ймовірно, в результаті прямого впливу на ДНК або посередництвом активації клітинних онкогенів):
1. Ультрафіолетове випромінювання.
2. Рентгенівське випромінювання.
3. Випромінювання радіоізотопів.
4. Радіоактивне забруднення місцевості
