- •Коллоидное состояние вещества специфические особенности дисперсных систем
- •Принципы классификации дисперсных систем
- •Классификация по дисперсности
- •Классификация по агрегатному состоянию
- •Типы дисперсных систем
- •Представители дисперсных систем
- •Классификация по межфазному взаимодействию
- •Суспензоиды и молекулярные коллоиды
- •Получение и очистка дисперсных систем
- •Диспергационные методы
- •Конденсационные методы
- •Физическая конденсация
- •Очистка дисперсных систем
Коллоидное состояние вещества специфические особенности дисперсных систем
Физическая химия дисперсных систем и поверхностных явлений, называемая в силу традиции и краткости коллоидной химией, — одна из важнейших и самостоятельных физико-химических дисциплин.
Представление о коллоидах как об особой группе веществ вошло в науку в середине XIX в.; растворы этих веществ отличались от обычных рядом признаков, в частности тем, что растворенное вещество не проходило через мембраны с очень тонкими порами (пергамент, животный пузырь) и не обнаруживало заметной диффузии. Вначале считали, что эти признаки присущи соединениям, не способным кристаллизоваться из раствора (например, крахмал, клей, желатина), однако круг их постепенно расширялся, включая все новые и новые, в том числе многие кристаллические вещества.
В начале XX века было установлено, что любое вещество может быть получено в виде коллоида и, следовательно, нужно говорить (это было впервые сформулировано профессором Санкт-Петербургского горного института Веймарном) не о коллоидных веществах, а о коллоидном состоянии, как о всеобщем особом состоянии материи.
Коллоидное состояние характеризуется определенной дисперсностью (раздробленностью) вещества. Вещество в этом состоянии диспергировано до очень малых частиц или пронизано тончайшими порами; эти частицы и поры невидимы в оптическом микроскопе, но превышают по размерам обычные молекулы. Поскольку раздробленное вещество находится всегда в какой-либо среде, с которой оно в большей или меньшей степени взаимодействует, свойства его нельзя рассматривать в отрыве от этой среды. Следовательно, коллоидные или дисперсные системы состоят из двух (или более) фаз: дисперсной фазы (одной или нескольких) — совокупности частиц или пор — и дисперсионной среды, т. е. являются гетерогенными. Таким образом, коллоиды — это не вещества (как считали раньше), а гетерогенные системы, содержащие вещества в высокодисперсном состоянии.
Наиболее общие закономерности, связывающие воедино коллоидные системы с молекулярными, атомными, ядерными и другими, могут быть установлены лишь на основе универсальности понятия дисперсности. Однако в начале изучения коллоидной химии целесообразно, прежде всего, уяснить специфику ее объектов. Понятие дисперсности будет применяться лишь к крупным (относительно обычных молекул) частицам и макромолекулам. В соответствии с этим все дисперсные системы можно классифицировать следующим образом:
Классификация систем |
Размер частиц или пор |
|
Грубодисперсные системы (суспензии, эмульсии) |
> 10-4 см |
> 10-6м |
Системы промежуточной дисперсности (тонкие взвеси, дымы, пористые тела) |
10-4 - 10-5 см |
10-6 - 10-7 м |
Высокодисперсные системы (собственно коллоиды) |
10-5 - 10-7 см |
10-7 - 10-9 м |
Объектом изучения современной коллоидной химии являются не только коллоидные, но и грубодисперсные системы.
Выделение коллоидной химии как самостоятельной области знания соответствует свое специфическое содержание, и именно здесь количественные изменения приводят к возникновению нового качества. Так, коллоидные частицы обладают более интенсивной окраской, большей прочностью и твердостью, чем крупные частицы того же вещества. Многие вещества, практически не растворимые, проявляют заметную растворимость в коллоидном состоянии. Наряду с изменениями свойств появляются и совершенно новые, характерные для коллоидного состояния свойства.
Новое качество заключается в появлении в коллоидной области новой независимой переменной — дисперсности, функциями которой становятся все свойства вещества. Увеличение числа переменных усложняет систему.
Усложняются и законы, поскольку они являются обобщением свойств. Многие основные законы [например, закон постоянства состава, закон Фарадея, правило фаз] в коллоидной области приобретают совершенно иное звучание, т.к. законы физической химии были установлены для идеализированных предельных систем (идеальных газов, бесконечно разбавленных растворов).
Реальный окружающий нас мир (и мы сами) состоит из дисперсных систем. Поэтому применение законов химии к реальному миру неизбежно несет на себе отпечаток «коллоидно-химического» своеобразия. Изучение последнего при переходе от химических веществ и предельных систем к реальным телам и материалам и составляет предмет коллоидной химии. Коллоидную химию можно назвать химией реальных тел. В этом заключается принципиальное значение, самостоятельность и особая привлекательность коллоидной химии.
Чем же объясняется своеобразие свойств вещества в коллоидном состоянии? Для ответа на этот вопрос рассмотрим изменения, происходящие при диспергировании вещества. Количественной мерой дисперсности может служить удельная поверхность (S0)
![]() где
S
и V
— суммарные поверхность и объем
дисперсной фазы.
где
S
и V
— суммарные поверхность и объем
дисперсной фазы.
В качестве простейшей модели рассмотрим частицу кубической формы, состоящую из однородных молекул. Тогда:
![]() , где
l
— длина ребра куба
, где
l
— длина ребра куба
(для сферических частиц ![]() ) .
) .
Следовательно, по мере диспергирования S0 возрастает обратно пропорционально линейному размеру и в коллоидной области достигает огромных значений.
Например, для частиц с l = 10-8 м удельная поверхность составляет 600 м2 на 1 см3 дисперсной фазы.
С ростом S0 увеличивается и доля молекул, находящихся на поверхности раздела фаз. Расположение в несимметричном силовом поле (на границе фаз) делает их по энергетическому состоянию отличными от молекул в объеме фазы. Поверхностные молекулы обладают избыточной свободной энергией, накопленной при совершении над системой работы по разрыву связей в процессе диспергирования. Эти энергетические изменения и оказывают существенное влияние на все свойства вещества, поскольку с ростом S0 суммарная избыточная энергия становится весьма значительной.
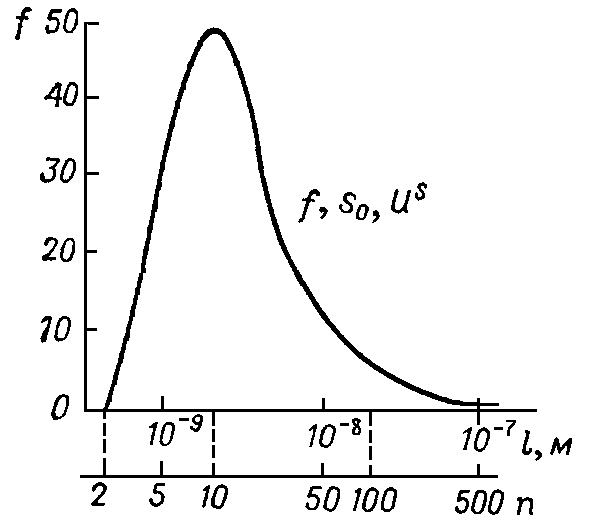
Рис. 1. Изменение доли f «особенных» молекул, удельной поверхности S0 и поверхностной энергии US с ростом дисперсности. |
Доля «особенных» (отличных от большинства) молекул f 6/n (где n — число молекул на ребре) возрастает вначале линейно с ростом S0, поскольку l = nd (где d — диаметр молекулы) и достигает половины от всех молекул для куба, состоящего из 1000 молекул (n = 10, f = 0,49). При дальнейшем диспергировании, однако, доля особенных молекул начинает уменьшаться, поскольку доля «объемных» молекул становится малой и при n = 2 исчезает совсем. Величина S0 при этом теряет физический смысл, т.к. исчезает тот объем, «по верху» которого она располагается. Зависимость f от n (или от l, считая d = 2 ·10 -10 м) дает кривую с максимумом, представленную на рис. 1. |
Таким образом, неограниченное диспергирование гетерогенной дисперсной системы переводит ее в гомогенный молекулярный раствор. Этот переход сочетает единство непрерывности и скачка, как и обратный процесс — возникновения новой фазы в гомогенной среде.
Минимальный размер частиц дисперсной фазы (нижняя граница коллоидной области) является относительным. Но, несмотря на это, он может быть определен величиной f. Эта область начинается там, где доля f близка к максимуму (гармоническое соотношение между S0 и V при l 10 -9 м) и кончается там (верхняя граница), где эта доля практически отлична от нуля, т.е. может быть еще экспериментально обнаружена по изменениям свойств, связанным с «особенными» молекулами.
Например, при относительной точности определения, равной 1 % f = 0,01 и
![]() м
м
Эту величину и принимали ранее в качестве верхней границы коллоидной области. Сейчас, когда для многих свойств отклонение в 0,1 % уже становится заметным, f = 10-3 и l = 10-4 м. Мы видим, что по мере усовершенствования методов исследования, область распространения коллоидного состояния расширяется и его закономерности приобретают все более универсальный характер.
Таким образом, выбор границ коллоидной области не и определяется тем, что «особенные» молекулы составляют заметную долю от всех молекул дисперсной фазы.
Величина f, характеризующая молекулярную неоднородность, определяет своеобразие свойств дисперсных систем, отличающихся как от молекулярных растворов, так и от крупных тел. Экстремальный характер изменения этих свойств можно рассматривать как следствие возрастания f, S0 и поверхностной энергии US до максимальных значений с ростом дисперсности. Увеличение удельной поверхности, а, следовательно, и возрастание с ростом дисперсности роли поверхностных явлений (происходящих в поверхностных слоях) — основа единства рассмотрения дисперсных систем и поверхностных явлений.
Это единство и составляет содержание современной коллоидной химии, определяемой в настоящее время как физическая химия дисперсных систем и поверхностных явлений.
Реальные тела взаимодействуют с окружающей средой через поверхность.
Основная и важнейшая особенность коллоидного состояния заключается в том, что значительная доля всей массы и свободной энергии системы сосредоточены в межфазных поверхностных слоях.
Следует отметить также ряд свойств, связанных с этой основной особенностью, но имеющих самостоятельное значение. Так, молекулы, расположенные в поверхностном слое на границе раздела фаз, не только отличаются от «объемных», но различаются и между собой. Поверхность реальной частицы твердого тела состоит из выступов, впадин, участков различной кривизны. Силовое поле, а, следовательно, и локальные значения поверхностной энергии различны на этих участках; поэтому две системы одного и того же состава с одинаковой величиной удельной поверхности могут оказаться энергетически неравноценными.
При переходе от обычных физико-химических систем к коллоидному состоянию мы встречаемся с таким свойством, как невоспроизводимость системы, ее индивидуальность.
Например, в технологическом процессе, полностью отработанном и совершенно стандартном, не удается получить идентичные образцы активированного угля и цемента.
Поверхностные слои обычно характеризуются дальним порядком расположения ориентированных молекул. Эта особенность весьма существенна, т.к. в результате организации микроструктур в дисперсных системах часто образуются ориентированные макроструктуры.
Обладая избытком свободной энергии, типичные высокодисперсные системы являются термодинамически неустойчивыми. Для них характерны самопроизвольные процессы, снижающие указанный избыток путем уменьшения дисперсности. При этом система, оставаясь неизменной по своему химическому составу, изменяет энергетические характеристики, а, следовательно, и коллоидно-химические свойства. В рассматриваемых процессах, в отличие от химических, система проявляет неустойчивость, изменчивость, высокую лабильность, в то же время сохраняя состав.