
- •Метод нейтрализации
- •Определение концентрации раствора соляной кислоты
- •Раздельное определение едких щелочей и карбонатов в смеси
- •Комплексонометрия
- •II. Определение содержания кальция в фармпрепаратах
- •Редокс титрование. Перманганатометрия
- •Приготовление стандартного раствора щавелевой кислоты (или оксалата натрия)
- •II. Стандартизация раствора перманганата калия
- •Определение массы железа (II) в растворе соли мора
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 4 йодометрия и йодиметрия
- •I. Стандартизация раствора тиосульфата натрия
- •II. Определение содержания аскорбиновой кислоты
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 5 броматометрия
- •Приготовление стандартного раствора бромата калия
- •II. Определение содержания стрептоцида
- •Нитритометрия
- •I. Стандартизация раствора нитрита натрия
- •II. Определение содержания стрептоцида
- •Вопросы для контроля усвоения темы
- •Электрохимические методы анализа
- •Потенциометрия
- •Потенциометрическое титрование
- •Определение содержания аскорбиновой кислоты методом окислительно-восстановительного титрования
- •Вопросы для контроля усвоения темы
- •Определение содержания ацетилсалициловой кислоты методом кислотно-основного титрования
- •Вопросы для контроля усвоения темы
- •Прямая потенциометрия
- •Определение концентрации различных ионов методом градуировочного графика
- •Определение концентрации хлорид-ионов в растворах
- •Определение концентрации ионов no3− в сельхозпродуктах
- •Вопросы для контроля усвоения темы
- •Кондуктометрия
- •Кондуктометрическое титрование определение содержания соляной кислоты и хлорида аммония при совместном присутствии методом кислотно-основного титрования
- •Вопросы для контроля усвоения темы
- •Изучение абсорбционных спектров растворов бихромата калия и перманганата калия
- •Определение хрома и марганца при совместном присутствии
- •Вопросы для контроля усвоения темы
- •Фотометрическое титрование
- •Определение содержания меди
- •Определение меди
- •Вопросы для контроля усвоения темы
- •Тонкослойная хроматография
- •Техника выполнения анализа методом тсх
- •Разделение галогенидов методом одномерной восходящей тсх
- •Вопросы для контроля усвоения темы
Метод нейтрализации
Метод нейтрализации служит для определения концентрации кислот, щелочей, солей, подвергающихся гидролизу, и веществ, реагирующих с кислотами и щелочами. В основе этого метода лежит реакция образования молекул воды из ионов гидроксония и гидроксила:
H3O+ + OH- 2H2O
Окончание титрования устанавливается по изменению окраски добавленного к раствору индикатора. Наиболее распространенными индикаторами в методе нейтрализации являются:
метиловый оранжевый (интервал изменения окраски при рН 3,1 - 4,4);
фенолфталеин (интервал изменения окраски при рН 8,0 – 9,8).
В методе нейтрализации в качестве титрантов применяются растворы сильных кислот и щелочей.
Определение концентрации раствора соляной кислоты
Для определения концентрации раствора кислоты используют кристаллическую буру (тетраборат натрия) Na2B4O710H2O. Бура отвечает требованиям, предъявляемым к первичным стандартам. Водные растворы буры, как соли сильного основания и слабой кислоты, вследствие гидролиза имеют щелочную реакцию:
Na2B4O7 + 7H2O 4H3BO3 + 2NaOH
Из уравнения реакции нейтрализации:
Na2B4O7 + 7H2O 4H3BO3 + 2NaOH
2NaOH + 2HCl 2NaCl + 2H2O
Na2B4O7 + 2HCl + 5H2O 4H3BO3 + 2NaCl
следует, что:

Для определения концентрации кислоты титруют определенный объем точно приготовленного раствора буры. В мерной колбе предварительно готовят раствор буры приблизительно такой же концентрации, как и кислоты. Для приготовления 250 мл 0,100 н. раствора буры необходимо взять навеску:

Навеску буры количественно переносят в мерную колбу емкостью 250 мл, растворяют в небольшом объеме дистиллированной воды при нагревании. Раствор охлаждают до комнатной температуры и доводят водой до метки.
Затем закрывают пробкой и перемешивают. Отбирают пипеткой 10 мл раствора буры в колбу для титрования, прибавляют 1 каплю 0,1% раствора метилоранжа и титруют раствором соляной кислоты до появления слабой оранжевой окраски. Молярную концентрацию эквивалента раствора соляной кислоты рассчитывают по формуле:
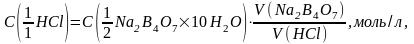
где V(HCl) - объем раствора соляной кислоты, мл, израсходованный на титрование V(Na2B4O7) мл раствора буры, за вычетом "глухого опыта" (к 20-30 мл дистиллированной воды добавляют 1 каплю 0,1%-го раствора метилоранжа и раствор соляной кислоты до оранжевой окраски).
Раздельное определение едких щелочей и карбонатов в смеси
Едкая щелочь почти всегда содержит примесь карбоната. При титровании такой щелочи кислотой имеют место следующие реакции:
(1) NaOH + HCl NaCl + H2O;
(2) Na2CO3 + HCl NaCl + NaHCO3;
(3) NaHCO3 + HCl NaCl + H2O + CO2.
Первые две реакции протекают одновременно, они заканчиваются при рН 9. Индикатором окончания этих реакций является изменение цвета фенолфталеина (рТ 9). При дальнейшем прибавлении соляной кислоты нейтрализуется образовавшийся в результате второй реакции гидрокарбонат. Реакция заканчивается при рН 4 - индикатор - метилоранж с рТ 3,8.
Анализируемый
раствор, содержащий
 и
и
 ,
помещают в мерную колбу, доводят до
метки дистиллированной водой и
перемешивают. В колбу для титрования
отбирают пипеткой 10 мл полученного
раствора и 3-4 капли раствора
фенолфталеина. От добавления фенолфталеина
раствор окрашивается в малиновый цвет.
Титруют раствором соляной кислот до
обесцвечивания. Замечают объем соляной
кислоты
,
помещают в мерную колбу, доводят до
метки дистиллированной водой и
перемешивают. В колбу для титрования
отбирают пипеткой 10 мл полученного
раствора и 3-4 капли раствора
фенолфталеина. От добавления фенолфталеина
раствор окрашивается в малиновый цвет.
Титруют раствором соляной кислот до
обесцвечивания. Замечают объем соляной
кислоты
 ,
пошедший на титрование. Затем добавляют
1 каплю метилоранжа, окрашивающего
раствор в желтый цвет. Продолжают
титровать соляной кислотой до перехода
окраски в оранжевую. Замечают суммарный
объем соляной кислоты
,
пошедший на титрование. Затем добавляют
1 каплю метилоранжа, окрашивающего
раствор в желтый цвет. Продолжают
титровать соляной кислотой до перехода
окраски в оранжевую. Замечают суммарный
объем соляной кислоты
 .
.
Рассчитывают массы карбоната и щелочи:

или:

и

