
- •1. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул.
- •2. Первое начало термодинамики
- •3. Работа газа при изменении его объема
- •4. Теплоемкость. Уравнение Клапейрона — Менделеева
- •9. Круговые процессы
- •10.Энтропия…
- •11. 2Е начало термодинмики
- •13. Тепловая диаграмма
- •14. Второе начало термодинамики
- •15. Циклы псу
- •16. Цикл с промежуточным перегревом пара
- •17. Тепловые двигатели. Общие положения
- •18. Классификация двс:
- •19. Устройство и диаграмма рабочего процесса двигателей внутреннего сгорания.
- •20. Цикл двигателей внутреннего сгорания с подводом тепла при постоянном объеме (цикл Отто).
- •21. Цикл двигателей внутреннего сгорания с подводом тепла при постоянном давлении (цикл Дизеля).
- •22. Цикл д. В. С. Со смешанным подводом тепла (цикл Тринклера)
- •23.Принцип действия и схемы газотурбинных установок
- •24. Цикл газотурбинной установки с изобарным подводом теплоты
- •25. Цикл газотурбинной установки с изохорным подводом теплоты
- •26.Реальные газы.Фазовые переходы.
- •27.Водяной пар.Т-Sдиагр.
- •28.Процесс образ-я водяного пара из воды.
- •29. Тепловые двигатели и холодильные машины.
- •30. Основные понятия и законы переноса теплоты. Конвективный теплообмен
- •31. Основные понятия и законы переноса теплоты. Теплопроводность
- •32. Основные понятия и законы переноса теплоты. Лучистый теплообмен
- •33.Назначение, устройство и принцип работы гидроэлектростанций
- •34.Назначение, устройство и принцип работы ветроэнергетических установок.
- •35. Назначение, устройство и принцип работы солнечных энергоустановок.
- •38. Основное теплофикационное оборудование
- •39. Основные энергетические насосы тэс
- •40. Назначение, устройство и принцип работы центробежных вентиляторов
1. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул
2. Первое начало термодинамики
3. Работа газа при изменении его объема
4. Теплоемкость. Уравнение Клапейрона — Менделеева
5. Применение первого начала термодинамики к изопроцессам. Изохорный процесс (V = const).
6. Применение первого начала термодинамики к изопроцессам. Изобарный процесс (р=const)
7. Применение первого начала термодинамики к изопроцессам. Изотермический процесс (T=const)
8. Адиабатический процесс. Политропный процесс
9. Круговой процесс (цикл). Обратимые и необратимые процессы
10. Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
11. Второе начало термодинамики. Энтальпия
12. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы.
13. Тепловая Т-S диаграмма. Цикл Карно.
14. Второй закон термодинамики.
15. Циклы паросиловых установок. Цикл Ренкина.
16. Цикл с промежуточным перегревом пара.
17. Тепловые двигатели. Общие положения.
18. Классификация двигателей внутреннего сгорания.
19. Устройство и диаграмма рабочего процесса двигателей внутреннего сгорания.
20. Цикл двигателей внутреннего сгорания с подводом тепла при постоянном объеме (цикл Отта)
21. Цикл двигателей внутреннего сгорания с подводом тепла при постоянном давлении (цикл Дизеля)
22. Цикл двигателей внутреннего сгорания со смешанным подводом тепла (цикл Тринклера)
23. Принцип действия и схема газотурбинной установки.
24. Цикл газотурбинной установки с изобарным подводом теплоты
25. Цикл газотурбинной установки с изохорным подводом теплоты
26. Реальные газы. Фазовые переходы.
27. Водяной пар. T-S диаграмма.
28. Процесс образования водяного пара из воды.
29. Тепловые двигатели и холодильные машины.
30. Основные понятия и законы переноса теплоты. Конвективный теплообмен.жжжжжжжжжжжжжжжжжжжжжжжжжжжжжжжжжж
31. Основные понятия и законы переноса теплоты. Теплопроводность.
32. Основные понятия и законы переноса теплоты. Лучистый теплообмен.
33. Назначение, устройство и принцип работы гидроэлектростанций.
34. Назначение, устройство и принцип работы ветроэнергетических установок.
35. Назначение, устройство и принцип работы солнечных энергоустановок.
36. Назначение, устройство и принцип тепловых электрических станций.
37. Классификация систем теплоснабжения.
38. Основное теплофикационное оборудование.
39. Основные энергетические насосы ТЭС.
40. Назначение, устройство и принцип работы центробежных вентиляторов.
41. Назначение, устройство и принцип работы поршневого компрессора.
42. Мощность и к.п.д. компрессора.
1. Число степеней свободы молекулы. Закон равномерного распределения энергии по степеням свободы молекул.
Важнейш характеристикой термодинамич системы является ее внутренняя энергия υ. Это энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер..) и энергия взаимодействия этих частиц.
Внутр энергия однозначная функция термодинамич состояния систем. В каждом состоянии система обладает вполне определенной внутр энергией, не зависящей от того, как система пришла в данное состояние. Это означает, что при переходе из одной системы, из одного состояний в другое изменения внутр энергии определяются только разностью значений внутр энергии этих состояний и не зависит от пути перехода.
Число степеней свободы- число независимых переменных, полностью определяющих положение системы в пространстве.
Для реальн молекул:
Ни одна из поступ степеней свободы не имеет преимущества перед другими. Поэтому на каждый из них приходится в среднем одинаковая энергия, равная 1/3
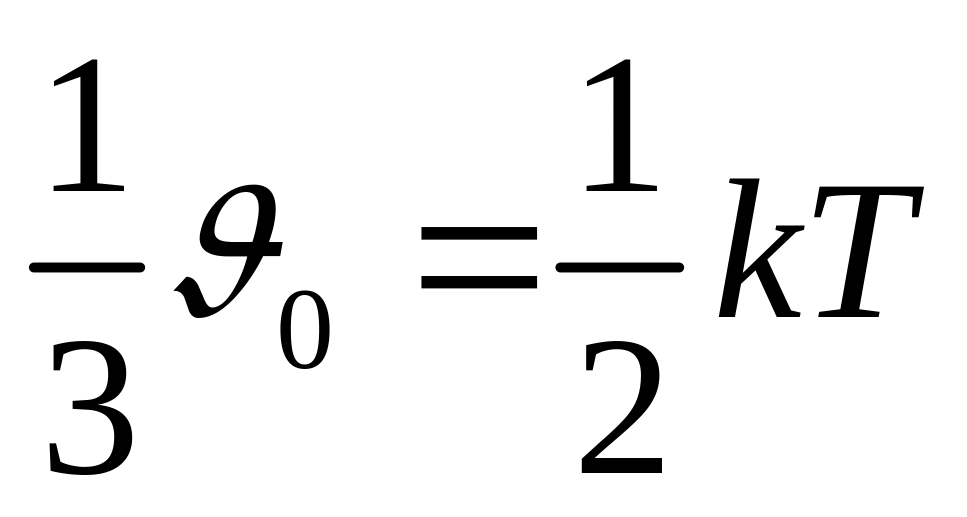
В
классической статистической физике
выводится закон Больцмана о равномерном
распределении энергии по степеням
свободы молекул. Для статистич системы,
находящейся в термодинамич равновесии
на каждые поступательные и вращателные
степени свободы приходится в среднем
кинетическая энергия
![]() , а
на каждую колебательную
степень свободы в среднем энергия
, а
на каждую колебательную
степень свободы в среднем энергия
![]() .
.
![]()
Т.к.
в идеальном газе взаимн потенц энергия
=0 (молекулы между собой не взаимодействуют,
то внутр энергия, отнесенная к одному
молю газа будет равна сумме кинетическ
энергии
![]() в
молекуле)
в
молекуле)

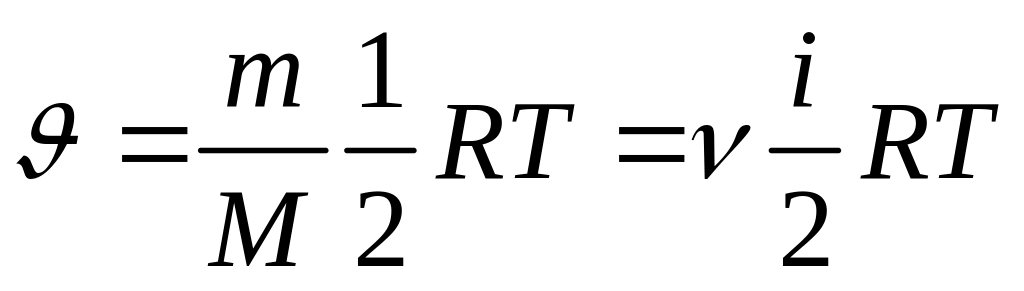 ---внутр
энергия для произвольной массы газа
---внутр
энергия для произвольной массы газа
М- молярная масса
R- молярная газовая постоянная
![]() -
количество веществ
-
количество веществ
2. Первое начало термодинамики
Внутр энергия системы может изменяться в результате различных процессов, напр, совершение над системой работы и сообщение ей теплоты.
Т.о.
можно говорить о 2-х способах передачи
эл/энергии от одних тел: в работе и в
теплоте. При этих превращениях соблюдается
закон сохранения энергии и превращения
энергии. Допустим, что некотор система
облает внутр энергией v1.
Получило некоторое кол-во теплоты Q
и перейдя в новое состояние, характеризуется
внутр энергией v2
совершило работу А над внешней средой,
т.е. против внешних сил. Количество
теплоты считается положительным, когда
оно подводится к системе, а работа
считается продолжительной, когда система
совершает ее против внешних сил. В
соответствии с законом сохранения
энергии, при любом способе перехода
системы из I
состояния во II
изменение внутр энергии ΔQ
будет Δv=![]() будет одинакова и равна разности между
количеством теплоты Q
полученным в системе и работо А,
совершенной против внешних сил.
будет одинакова и равна разности между
количеством теплоты Q
полученным в системе и работо А,
совершенной против внешних сил.
Q= Δv+A
ΔQ=dv+dA ---выражает I начало термодинамики
Т.е. теплота, сообщаемая системе, расходуется на изменение ее внутр энергии и на совершение ею работы против внешних сил.
Если система периодически возвращается в первоначальное состояние, то изменение ее внутр энергии Δv=0 , dA=dQ , тогда согласно I началу термодинамики A=Q
Вечный двигатель I рода (периодически действующий двигатель), который совершал бы большую работу, чем сообщаемое ему извне энергии невозможен.
