
- •Получение металлов
- •Промышленная классификация металлов
- •Металлургические процессы
- •7.1. Алюминий и его сплавы
- •7.2. Получение оксида алюминия из бокситов.
- •7.2.2. Производство оксида алюминия сухим щелочным способом или методом спекания.
- •7.3. Электрическое производство алюминия
- •7.4. Очистка и рафинирование алюминия
- •7.4.1. Рафинирование алюминия с помощью субсоединений
Металлургические процессы
В основе производства металлов лежат металлургические процессы, то есть технологические процессы извлечения металлов из руд и отходов производства. В общем случае металлургический процесс включает три последовательных стадии:
подготовка руды — превращение ее в состояние, обеспечивающее извлечение из руды металла;
восстановление химического соединения, в виде которого металл содержится в руде, до свободного металла;
вторичная обработка полученного металла.
Подготовка руды состоит из ряда механических и физико-химических операций, содержание которых зависит от состава руды и формы химического соединения металла в ней. К таким операциям относят измельчение или укрупнение, классификацию и обогащение руды, а также превращение содержащего металл соединения в форму, пригодную для восстановления. Необходимость последней операции связана с тем, что восстановлению подвергаются преимущественно оксиды, реже галогениды металлов, поэтому все остальные соединения (сульфиды, гидроксиды) должны быть переведены в них. Это достигается воздействием на обогащенную руду высокой температуры или соответствующих реагентов:

В соответствии с методом технологические процессы подготовки руды подразделяются на пирометаллургические и гидрометаллургические.
Пирометаллургические процессы проводятся при высоких температурах с полным или частичным расплавлением руды. К ним относят:
обжиг — процесс, проводимый при высокой (500—1200°С) температуре в твердой фазе с целью изменения химического состава руды. Условия обжига зависят от состава руды и назначения процесса. Руды, содержащие сульфиды металлов, подвергаются окислительному обжигу до их оксидов; руды для последующего магнитного обогащения подвергаются восстановительному обжигу;
восстановительная плавка — процесс восстановления оксидов металлов при температурах, обеспечивающих полное расплавление руды;
дистилляция — процесс испарения перерабатываемого вещества с целью разделения его компонентов на основе их различной летучести.
Гидрометаллургические процессы проводятся в водных средах при температурах до 300°С на границе раздела твердой и жидкой фаз.
Наиболее распространенным гидрометаллургическим процессом является выщелачивание — процесс перевода в жидкую фазу (раствор) извлекаемых из руды соединений металлов при воздействии на нее растворителей. Выщелачивание может быть физическим процессом (растворитель вода) или химическим процессом (растворитель — реагент, взаимодействующий с извлекаемым компонентом).
Вторичная обработка восстановленного металла проводится для его очистки, а также с целью перестройки кристаллической структуры металла, изменения его состава и свойств. К операциям вторичной обработки относятся очистка металла методами дистилляции, электролиза, электрошлакового переплава и зонной плавки; получение сплавов, закалка, отжиг, отпуск, цементирование и др. Некоторые из них рассматриваются ниже.
На рис. 1.2 представлена общая схема производства металлов из руд (металлургического процесса).
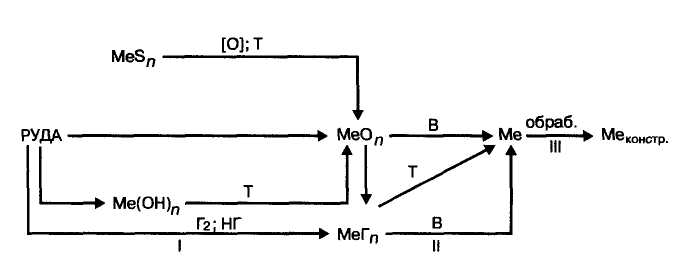
Рис. 1.2. Общая схема производства металлов из руд:
I — подготовка руды, II — восстановление, III — вторичная обработка, В — восстановитель, [О] — окисление, Т — термическая обработка
Существуют несколько основных способов получения — металлов. Восстановление:
— из их оксидов углем или оксидом углерода (II)
ZnО + С = Zn + СО
Fе2О3 + ЗСО = 2Fе + ЗСО2
— водородом
WO3 + 3H2 =W + 3H2O
СоО + Н2 = Со + Н2О
— алюминотермия (металлотермия, силикотермия..)
4Аl + 3МnО2 = 2А12О3 + 3Мn
Обжигом сульфидов металлов и последующим восстановлением образовавшихся оксидов (например, углем)
2ZnS + 3О2 = 2ZnО + 2SО2
ZnО + С = СО + Zn
Электролизом расплавов солей
СuСl2, ® Сu2+ + 2Сl-
Катод (восстановление): Анод (окисление):
Сu2+ + 2е- = Сuо 2Cl- - 2е- = Сl°2
Физико-химические основы восстановления металлов из руд
Процессы восстановления металлов из руд различаются по природе восстановителя и по условиям восстановления. В качестве восстановителей применяют химические вещества (водород, оксид углерода (II), углерод, металлы) или электрический ток, а процесс восстановления можно проводить в растворе, в расплаве или в твердой фазе. В зависимости от этого различают следующие методы восстановления:
1. Гидрометаллургическое восстановление — восстановление химическими восстановителями из водных растворов, на пример:
CuSO4 + Zn = Си + ZnSO4
2. Пирометаллургическое восстановление — восстановление химическими восстановителями при высокой температуре из расплавов или твердой фазы, например:
FeO + СО = Fe + СО2
3. Электрогидрометаллургическое восстановление — восстановление электрическим током из водных растворов, например:
CuSO4 + 2e- = Сu + SO42-
4. Электропирометаллургическое восстановление — восстановление электрическим током при высокой температуре из расплавов, например:
А12О3 + 6 e- = 2А1 + 3O-2
Оба случая восстановления электрическим током представляют собой процессы электролиза в водных растворах или расплавах электролитов, при которых восстанавливаемый металл выделяется на катоде.
При восстановлении металлов из их соединений необходимо учитывать как принципиальную осуществимость этого процесса, так и полноту его протекания, от которой зависит экономичность процесса.
Принципиальная возможность процесса восстановления определяется условием G<0, где G — изобарно-изотермический потенциал равный:
G=H-TS (1.1)
Скорость самопроизвольно протекающей реакции восстановления тем выше, чем больше по абсолютному значению величина G. Из 1.1 следует, что соблюдению неравенства AG<0 способствует уменьшение энтальпии (Н<0), увеличение энтропии (S>0) и проведение процесса при максимально осуществимой в данных условиях температуре Т. Использование температурного фактора позволяет в ряде случаев применять для восстановления слабые восстановители, которые не «работают» при обычных температурах.
Наиболее распространенный процесс восстановления оксидов металлов описывается общим уравнением:
МеО + В Me + ВО (а)
где: В — восстановитель, ВО — продукт окисления восстановителя.
Производство алюминия
По объёму производства и масштабам практического использования алюминий занимает первое место среди цветных металлов.
