- •Лекция 7 Электрохимические производства.
- •7.1. Электротермические и электрохимические процессы.
- •7.1.1. Электролиз
- •7.2 Теоретические основы промышленного электролиза.
- •7.2.1 Напряжение разложения
- •Значения ηк и ηа для электродов, изготовленных из различных материалов, имеются в справочниках
- •7.2.2. Теория электролиза основана на законах Фарадея:
- •7.3. Производство хлора, водорода и натрий гидроксида
- •7.3.1. Электролиз раствора хлорида натрия в электролизерах с твёрдым катодом.
- •7.3.2. Электролизёр непрерывного действия с вертикальной фильтрующей диафрагмой.
- •7.3.3. Электролиз раствора хлорида натрия в ваннах с ртутным катодом.
7.3.1. Электролиз раствора хлорида натрия в электролизерах с твёрдым катодом.
В водном растворе хлорида натрия содержатся ионы Na+, H+, Cl- и OH-.
При прохождении постоянного электрического тока последовательность разряда этих ионов определяется в первую очередь величинами и соотношениями их электродных потенциалов.
Восстановление ионов натрия на стальном катоде невозможно, так как потенциал этого процесса имеет высокое значение и равен 2,71 В. По этой причине на катоде образуется водород, равновесный потенциал разряда которого в насыщенном растворе хлорида натрия равен 1,1В (без учета перенапряжения - 0,415 В).
2H2O + 2ê = H2 + 2OH-
Оставшиеся в катодном пространстве гидроксид-ионы образуют с ионами натрия нейтральные молекулы гидроксида натрия:
OH- + Na+ → NaOH
На аноде выделяется хлор:
2Cl- → Cl2 + 2ê
Равновесный потенциал разряда иона хлора в насыщенном растворе выше, чем равновесный потенциал гидроксид ионов φOH- = 0,82 В; φCl2 = 1,32 В.
Однако на графитовых и оксидно-рутеневых анодах ионы гидроксида OH- разряжаются с большим перенапряжением, поэтому на аноде происходит выделение газообразного хлора.
Суммарно процесс электролиза хлорида натрия можно представить так:
2H2O + 2NaCl = Cl2 + H 2 + 2NaOH
На практике наряду с основными реакциями происходит и ряд побочных реакций. На аноде образуется кислород:
2OH- - 2ê = 0,5O2 + H2O
При взаимодействии кислорода с углеродом образуется оксид углерода (IV).
В жидкости анодного пространства вследствие растворения в ней хлора идут вторичные реакции образования гипохлорита NaClO, хлората NaClO3 и хлорида натрия.
Все побочные реакции снижают выход по току основных продуктов, а также степень использования энергии.
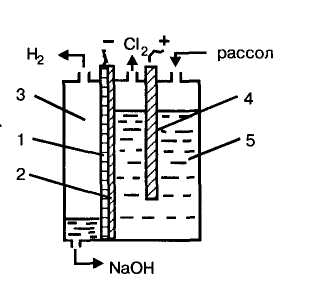
7.3.2. Электролизёр непрерывного действия с вертикальной фильтрующей диафрагмой.
Корпус электролизёра (ванной) разделён на катодное и анодное пространство диафрагмой из асбеста, которая плотно прилегает к стальному перфорированному катоду. В анодном пространстве расположен графитовый анод (рис. 6.1):
|
Рис. 6.1. Схема электролизной ванны с фильтрующей диафрагмой (ЭЛЕКТРОЛИЗЕР ВЕРТИКАЛЬНОГО ТИПА): 1 — перфорированный катод, 2 — пористая асбестовая диафрагма, 3 — катодное пространство, 4 — графитовый анод, 5 — анодное пространство
|
Очищенный рассол подают в анодное пространство, и благодаря гидростатическому давлению он фильтруется через диафрагму катода.
При прохождении электрического тока на катоде выделяется и отводится из ванны водород, а на аноде – хлор.
В катодном пространстве образуется гидроксид натрия, непрерывно удаляемый из ванны.
Содержание хлора в образующемся хлор-газе 95-96%. Хлор-газ сушат охлаждением до 20°С и промывают концентрированной серной кислотой, затем сжижают под давлением. Жидкий хлор перевозят в баллонах или цистернах.
В катодном продукте – растворе гидроксида натрия - содержится 120-140 г/дм3 NaOH и 170-180 г/дм3 неразложившегося хлорида натрия. Раствор выпаривают, при этом хлорид натрия переходит в твёрдую фазу, так как его растворимость резко понижается с увеличением концентрации гидроксида натрия. После выпарки и плавки щёлоков получают безводный гидроксид натрия, содержащий 92-95% NaOH и 2-4% NaCl.
Выход по току достигает 96%, выход по энергии - 65%.