
- •Отчет по лабораторным работам по дисциплине химия
- •I. Цель работы.
- •II. Оборудование и реактивы.
- •III. Теоретические основы.
- •IV. Ход работы.
- •V. Техника безопасности.
- •VI. Контрольные вопросы.
- •VII. Контрольные ответы.
- •4 Ход работы
- •5 Техника безопасности
- •6 Контрольные вопросы
- •7 Контрольные ответы
- •4 Ход работы
- •5 Техника безопасности
- •6 Контрольные вопросы
- •7 Контрольные ответы
- •4 Ход работы
- •5 Техника безопасности
- •6 Контрольные вопросы
- •7 Контрольные ответы
Министерство образования и молодежной политики Ставропольского края
государственное бюджетное образовательное учреждение
среднего профессионального образования
«Невинномысский химический колледж»
ПРЕДМЕТНО-ЦИКЛОВАЯ КОМИССИЯ ХИМИЧЕСКИХ ТЕХНОЛОГИЙ
СПЕЦИАЛЬНОСТЬ 230401 Информационные системы (по отраслям)
Отчет по лабораторным работам по дисциплине химия
Студент группы __ И-11-13_, курс _1__ _____________________________
Фамилия, имя, отчество
Преподаватель_______________________ _______Карепова Н.В._______
Подпись Фамилия, имя, отчество
Отчет принят "____"__ __2014г.
2014 год
 СОДЕРЖАНИЕ
СОДЕРЖАНИЕ
1. Лабораторные работы:
1.1. Гидролиз солей различного типа
1.2. Обратимые и необратимые реакции
1.3. Качественное обнаружение водорода, углерода и хлора в молекулах органических соединений
1.4 Получение метана, этилена, ацетилена и изучение их свойств
1.5 Изучение свойств спиртов и альдегидов
2. Список литературы
I. Цель работы.
1.1. Опытным путем закрепить знания и умения по определению солей, подвергающихся гидролизу.
1.2. Опытным путем подтвердить значение рН среды растворов солей определенных теоретически.
II. Оборудование и реактивы.
2.1. Нитрат свинца (II)
2.2. Карбонат натрия
2.3. Иодид калия
2.4. Хлорид железа (III)
2.5. Сульфат меди (II)
2.6. Хлорид бария
2.7. Сульфат железа (II)
2.8. Набор пробирок
2.9. Штатив для пробирок
2.10.Универсальный индикатор
III. Теоретические основы.
Реакция ионного обмена между молекулами соли и воды, в результате которой происходит разрушение молекулы воды и образование слабого электролита называется гидролизом соли.
Любую соль можно представить, как продукт взаимодействия основания и кислоты:
основание + кислота
 Kt
OH
HAn
Kt
OH
HAn


KtAn
Соль
В зависимости от силы электролитов (основания и кислоты) образующих соль, различают следующие типы солей:
1. Соль образованная сильным основанием и слабой кислотой;
2. Соль образованная слабым основанием и сильной кислотой;
3. Соль образованная слабым основанием и кислотой;
4. Соль образованная сильным основанием и кислотой.
Первые три типа солей гидролизу подвергаются, а четвертый тип соли гидролизу не подвергается, т.к. образован двумя сильными электролитами и при взаимодействии с водой не образует слабого электролита.
В зависимости от того, какой из ионов, катион или анион у соли «слабый» механизм протекания различен:
1. Если «слабый» катион, то гидролиз идет по катиону (Kt):
Kt+ + Н+ОН- ↔ KtOН + Н+
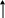 | |
| |


в растворе накапливаются катионы водорода, среда кислая, рН< 7
 2.
Если «слабый» анион, то гидролиз идет
по аннону (An):
2.
Если «слабый» анион, то гидролиз идет
по аннону (An):
An- + Н+ОН- ↔ НАn + ОH-
|


в растворе накапливаются анионы гидроксила, среда щелочная, рН >7
3. Если «слабые» и катион и анион, то гидролиз идет по Kt и An
H+
OH-
| |
An- + Н+ОН- ↔ НАn +
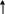 |
|
в растворе накапливаются как ионы водорода, т.к. и ионы гидроксила, которые связываются в молекулу воды, т.е. среда нейтральная, рН = 7
В этом случае гидролиз идет, как правило ступенчато даже при обычных условиях.
В первых двух случаях гидролиз при обычных условиях идет только по первой ступени.
