
- •Главный редактор л. А. Суевалова
- •680035, Хабаровск, ул. Тихоокеанская, 136.
- •680035, Хабаровск, ул. Тихоокеанская, 136.
- •Основные классы
- •Основные гидроксиды (основания)
- •Кислоты
- •Способы получения солей. Кроме реакций кислотно-основного обмена, соли можно получать другими способами:
- •2. Правила составления структурных формул
- •3. Тестовые задания
- •4. Задания для самоподготовки
- •5. Примеры выполнения заданий
- •Изменение кислотно-основных свойств оксидов и гидроксидов элементов в зависимости от степени окисления элемента
- •Степени окисления металла
- •Оглавление
- •Наталья Леонидовна Мара Главный редактор л. А. Суевалова
- •680035, Хабаровск, ул. Тихоокеанская, 136.
- •680035, Хабаровск, ул. Тихоокеанская, 136.
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«Тихоокеанский государственный университет»
ОСНОВНЫЕ КЛАССЫ
НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Методические указания
к изучению раздела курса общей химии
Хабаровск
Издательство ТОГУ
2007
УДК 546
Основные классы неорганических соединений : методические указания к изучению раздела курса общей химии / cост. Н. Л. Мара. – Хабаровск : Изд-во Тихоокеан. гос. ун-та, 2007. – 44 с.
Методические указания составлены на кафедре «Химия». Содержат общие сведения, включающие классификацию, номенклатуру, химические свойства и способы получения основных классов неорганических соединений, многовариантные задачи и тесты для закрепления данной темы.
Предназначены для самостоятельной аудиторной и внеаудиторной работы студентов 1-го курса всех специальностей, изучающих химию.
Печатается в соответствии с решениями кафедры «Химия» и методического совета факультета математического моделирования и процессов управления.
Главный редактор л. А. Суевалова
Редактор Е. Н. Ярулина
Оператор компьютерного набора А. Р. Деменкова
Оператор компьютерной верстки О. А. Суворова
Подписано в печать 15.09.06. Формат 60 84 1/16.
Бумага писчая. Гарнитура «Таймс». Печать цифровая. Усл. печ. л. 2,56.
Тираж 490 экз. Заказ .
Издательство Тихоокеанского государственного университета.
680035, Хабаровск, ул. Тихоокеанская, 136.
Отдел оперативной полиграфии издательства Тихоокеанского государственного университета.
680035, Хабаровск, ул. Тихоокеанская, 136.
© Тихоокеанский государственный
университет, 2007
Неорганические соединения находят широкое применение в химии, химической технологии и в различных отраслях промышленности: автомобильной, лесохимической, строительной.
Современному инженеру любой специальности необходимы знания свойств химических элементов и их соединений. Так, в строительном производстве инженер имеет дело с воздушными и гидравлическими, известковыми и гипсовыми вяжущими смесями, которые включают оксиды, соли, основания. Инженер-механик, связанный с эксплуатацией машин, механизмов, химических источников тока, имеет дело с различными композиционными материалами, металлами и сплавами, топливами, в состав которых входят разнообразные неорганические соединения.
Цель данных методических указаний – научить студентов систематизировать и классифицировать неорганические вещества, расширить представление о номенклатуре неорганических соединений, их свойствах и способах получения.
Классификация веществ облегчает их изучение. Зная особенности классов соединений, можно охарактеризовать свойства отдельных их представителей. Все вещества делятся на две основные группы – простые и сложные. Если вещество образовано одинаковыми атомами, то его называют простым, если же различными – сложным. Сложные вещества являются химическими соединениями и подразделяются на основные классы и неосновные. К основным классам химических соединений относятся оксиды, основания, кислоты, соли. К неосновным классам относятся, пероксиды, гидриды, галогенангидриды и другие, которые в данных методических указаниях не рассматриваются.
Основные классы
неорганических соединений
ОKCИДЫ
Оксидами называются сложные вещества, состоящие из двух элементов, одним из которых является кислород (ЭхOу). Оксиды образуют все химические элементы, кроме Не, Ne, Ar (прил. 1).
Названия оксидов. В названиях оксидов придерживаются следующих правил: вначале указывают слово «оксид», затем в родительном падеже название элемента. Если же элемент образует несколько оксидов, то в их названиях указывается валентность элемента римской цифрой в скобках сразу после названия. Например, Na2O – оксид натрия, FeO – оксид железа (II), Fe2O3 – оксид железа (III), Р2О5 – оксид фосфора (V). Для некоторых оксидов применяют традиционные названия: СO2 – углекислый газ, CaO – негашеная известь, CO – угарный газ.
Классификация оксидов
ОКСИДЫ



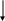 Несолеобразующие Солеобразующие
Несолеобразующие Солеобразующие
 NO, СО
NO, СО
Основные Амфотерные Кислотные
Na2O,СаО ZnO, Al2O3 CО2, SO3, Cl2O7
MnO MnO2 CrO3, Mn2O7
Cr2O3
Основными оксидами называют такие оксиды, которым соответствуют основания. Основные оксиды образуются только металлами в низкой степени окисления (+1, +2), кроме бериллия, цинка..
Основные оксиды взаимодействуют с веществами кислотного характера, а именно: с кислотными оксидами и кислотами.
СаО + СО2 = СаСО3;
CuO + H2SO4 = CuSO4 + Н2О;
CaO + 2H3PO4 = Ca(H2PO4)2 + H2O.
Кислотными оксидами называются такие оксиды, которым соответствуют кислотные гидроксиды. Кислотные оксиды образуются неметаллами и некоторыми металлами в высоких степенях окисления +5, +6, +7. Большинство кислотных оксидов образуют кислоты при взаимодействии с водой.
СO2 + H2O ⇄ H2СO3;
SO2 + H2O = H2SO3;
Mn2O7 + H2O = 2HМnO4.
Кислотные оксиды взаимодействуют с веществами основного характера – основными оксидами и основаниями.
SiO2 + FeO = FeSiO3;
SO2 + 2NaOH = Na2SO3 + H2O;
2CrO3 + 2KOH = K2Cr2O7 + H2O.
Амфотерными оксидами называют оксиды, которые образуют соли при взаимодействии как с кислотами, так и со щелочами. В зависимости от условий они проявляют основные или кислотные свойства, т. е. это соединения двойственной функции.
К ним относятся некоторые оксиды металлов с низкой постоянной степенью окисления +2, +3 (например, ВеО, ZnO, Al2O3) и оксиды металлов с несколькими степенями окисления, как правило, в промежуточных степенях окисления +2, +3, +4 (например, PbO, Cr2O3, SnO2, MnO2).
Амфотерные оксиды с водой непосредственно не соединяются, но они реагируют с веществами кислотного и основного характера: сплавляются с кислотными и основными оксидами и сухими щелочами.
2ZnO + SiO2 = Zn2SiO4;
ZnO + CaO = CaZnO2;
цинкат кальция
Al2O3 + 2NaOH = 2NaAlO2 + H2O;
метаалюминат натрия
Амфотерные оксиды взаимодействуют с растворами кислот и щелочей.
Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O;
сульфат алюминия
Al2O3 + 2NaОН + 3Н2О = 2Na[Al(OH)4].
тетрагидроксиалюминат натрия
ГИДРОКСИДЫ
Гидроксидами (гидратами оксидов) называют водные формы оксидов. Это химические соединения с общей формулой ЭxOy ∙ NH2O. По отношению к кислотам и щелочам гидроксиды делятся на основные (основания), кислотные (кислоты) и амфотерные (амфолиты) (прил. 1).
Классификация гидроксидов
Г

 ИДРОКСИДЫ
ИДРОКСИДЫ
Основные Амфотерные Кислотные
NaOH, Ca(OH)2 Zn (OH)2, Al(OH)3 HNO3, HMnO4
Mn(OH)2, Cr(OH)2 Cr(OH)3, Mn(OH)4 H2SO4, H2CrO4
