- •Реологічні властивості крові.
- •1. Поняття про систему крові
- •2. Функції крові
- •Еритроцити, гемоглобін
- •3. Об’єм крові, поняття про депо
- •4. Склад крові, кількісна оцінка
- •5. Функціональне значення білків плазми
- •6. Буферні системи крові.
- •7. Вплив складу плазми на реологію крові:
- •2 Функції еритроцитів
- •3 Розвиток еритроцитів
- •4. Регуляція еритропоезу.
- •5. Фізіологічний аналіз швидкості осідання еритроцитів (шое)
- •2. Сполуки гемоглобіну, їх особливості.
- •3. Сполуки гемоглобіну з газами
- •4. Методи визначення гемоглобіну
- •5. Обмін заліза в організмі.
- •6. Поняття про колірний показник, середній вміст гемоглобіну.
- •7. Міоглобін
- •Реологічні властивості крові. Вікові особливості системи крові
- •Білки плазми крові
- •Буферні системи крові
- •Показники для кислотно-основної рівноваги
- •Фізико-хімічні властивості крові
- •Періоди кровотворення
- •Вікові зміни крові
- •Вікові зміни гемоглобіну
- •Методика забору крові
- •Визначення гемоглобіну ціанметгемоглобіновим методом
4. Регуляція еритропоезу.
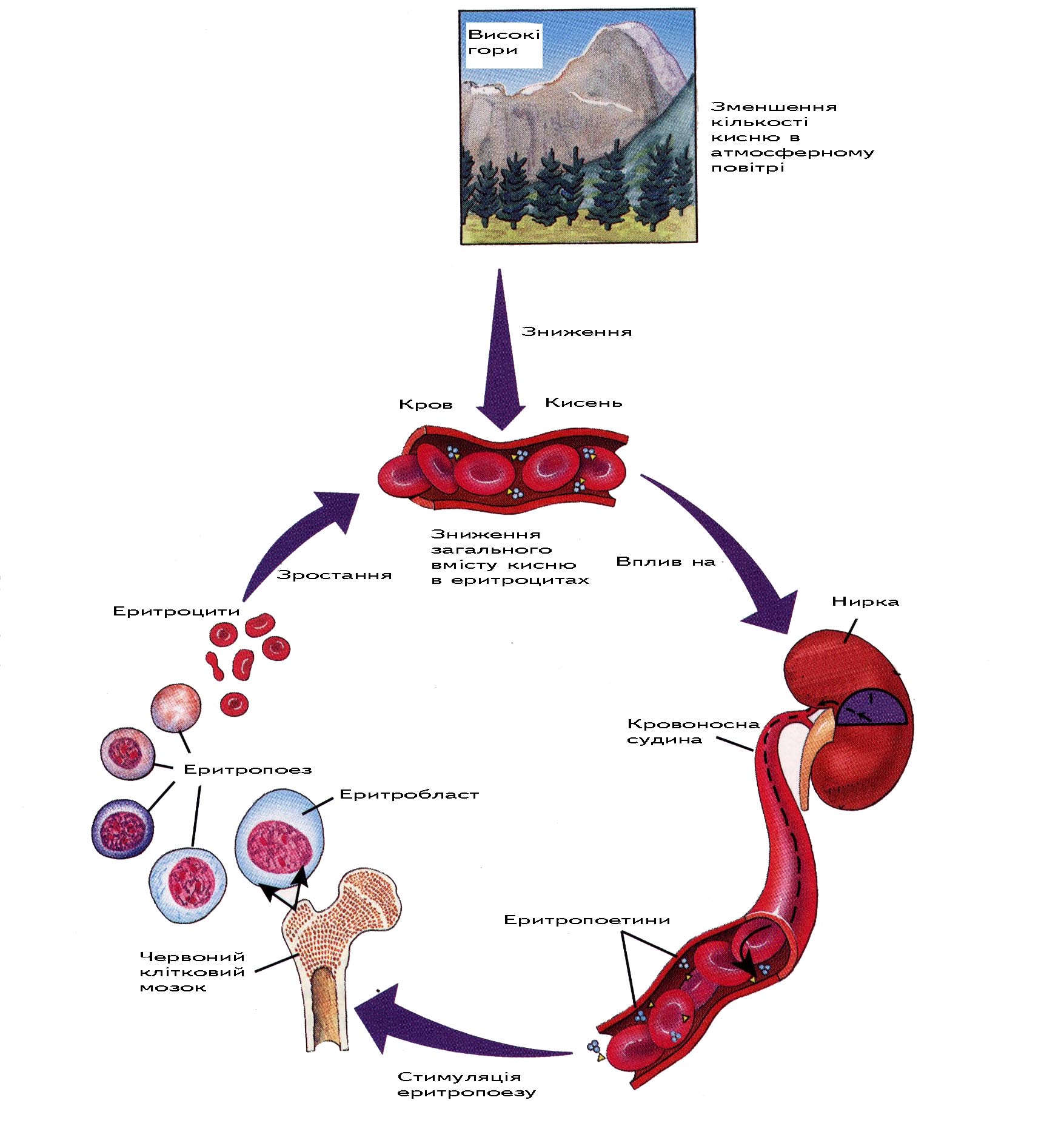

Могутнім стимулятором еритропоезу є зниження парціального тиску кисню. При цьому спостерігається невідповідність між потребою тканин у кисні та його поступленням (гіпоксія). Це приводить до зростання в плазмі особливої речовини, яка прискорює еритропоез -–еритропоетину. Він стимулює диференціацію і пришвидшує проліферацію стовбурових клітин еритроїдного ряду в кістковому мозку; крім того, він збільшує швидкість синтезу гемоглобіну в еритробластах. Це приводить до зменшення гіпоксії.
Еритропоетини є могутніми стимуляторами еритропоезу. Хімічна будова їх ще до кінця не вияснена, можливо це глікопротеїд з молекулярною масою біля 33000. Головну роль у синтезі еритропоетину відіграють нирки. При експериментальній двобічній нефректомії концентрація еритропоетину в крові різко знижується. Рахують, що він також у невеликих кількостях виробляється печінкою і підщелепними слинними залозами. Але з нирок ученим не вдалося виділити еритропоетин. У зв’язку з цим припускають, що нирки виділяють у кров нирковий фактор еритропоезу – фермент, під дією якого розщеплюється один з глобулінів плазми і утворюється глікопротеїнова молекула еритропоетину.
Одним з основних екстраренальних джерел еритропоетинів є макрофаги. У плода еритропоетини виробляють купферівські клітини. У дорослої людини макрофаги печінки знову починають продукувати еритропоетини в умовах регенеруючої печінки. В печінці дорослих знайдено профактор еритропоетину. І сьогодні залишається до кінця неясним: продукуються у нирках еритропоетини чи фактор еритрогенін, який активує попередник еритропоетину, що існує в печінці, плазмі.
До зростання еритропоезу може призвести піднімання на значні висоти, зростання активності гормонів щитовидної залози, чоловічих статевих гормонів. До зниження – тривала нерухомість (ліжковий режим), виключення з продуктів харчування білкової їжі, зростання активності жіночих статевих гормонів.
Існує поняття регуляції необхідної кількості клітин у даний момент. Для еритроцитів не існує спеціального кістковомозкового резерву, але вони депонуються в судинах шкіри, печінці, селезінці. У депо відбувається і деяке деплазмування крові. У селезінці співвідношення плазма:еритроцити замість 6:4 у нормі змінюється на 2:8. Подібні процеси деякої концентрації еритроцитів спостерігаються і в шкірних депо. резерви еритроцитів відносно менші, ніж білих кров’яних тілець.
5. Фізіологічний аналіз швидкості осідання еритроцитів (шое)
При розміщенні крові, яка не має здатності до зсідання, у вертикальному стані спостерігається повільне осідання еритроцитів на дно. Це відбувається тому, що відносна густина еритроцитів вища (становить 1,090-1,098 г/см3), ніж плазми (1,025-1,034 г/см3). Це швидкість осідання еритроцитів. Вона виражається в міліметрах висоти стовпчика плазми, що з’явилася над шаром еритроцитів, які осіли, за одиницю часу (звичайно за годину).
У здорових людей ШОЕ становить: у жінок – 2-15 мм/год; у чоловіків –2-10 мм/год.
Механізм осідання еритроцитів є складним і залежить від багатьох факторів. До них належить кількість еритроцитів, їх морфологічні особливості, величина заряду, здатність до агломерації, білковий склад плазми.
Так ШОЕ буває збільшена при схильності еритроцитів до утворення агрегатів. Опір таких агрегатів тертю менший, ніж сумарний опір складових їх елементів, так як при утворенні агрегатів знижується відношення поверхні до об’єму; тому вони осідають швидше.
ШОЕ збільшується при значному зменшенні числа еритроцитів, так як при цьому знижується в’язкість крові; при збільшенні гематокриту (зростанні числа еритроцитів) спостерігається зворотний процес.
ШОЕ значно змінюється при зміні білкового складу плазми. ШОЕ знижується при збільшенні в плазмі альбумінів і збільшується при збільшенні фібриногену, гаптоглобіну, церулоплазміну і ліпопротеїнів, а також парапротеїнів – імуноглобулінів, які утворюються в надлишку при деяких патологічних станах. Кожен з цих факторів може посилювати інший. Білки плазми, які пришвидшують осідання еритроцитів називаються агломеринами. Було відмічено, що альбуміни і глобуліни мають протилежну дію на ШОЕ. При зсуві альбуміно-глобулінового коефіцієнту в бік глобулінів ШОЕ зростає.
На величину ШОЕ впливає фізіологічний стан організму. Осідання значно пришвидшується при вагітності (зростає кількість високомолекулярних білків, фібриногену), при посиленій м’язовій роботі. У новонароджених ШОЕ низьке (мало високомолекулярних білків).
6. Загальна характеристика резистентності еритроцитів:
а) визначення понять "резистентність" та "гемоліз";
Резистентність – це стійкість еритроцитів у різних сольових розчинах.
Гемоліз – це вихід еритроцитарного вмісту (гемоглобіну) у кров.
б) види гемолізу.
Фізіологічний, патологічний. Осмотичний, термічний, механічний, біологічний.
ДИХАЛЬНІ ПІГМЕНТИ
1. Гемоглобін. Однією з найважливіших функцій крові є перенесення кисню, який поглинається в легенях, до органів і тканин, а також у транспорті вуглекислоти від тканин до легень. Цю функцію виконують еритроцити, які містять червоний кров’яний пігмент – гемоглобін. Він може з’єднуватися з киснем в капілярах легень і вивільняти його в капілярах тканин. Крім того, гемоглобін може зв’язувати деяку кількість вуглекислоти, яка утворюється в процесі клітинного метаболізму (у легенях зв’язок гемоглобіну з вуглекислим газом розпадається). У зв’язку з цим гемоглобін відіграє важливу роль у перенесенні дихальних газів.
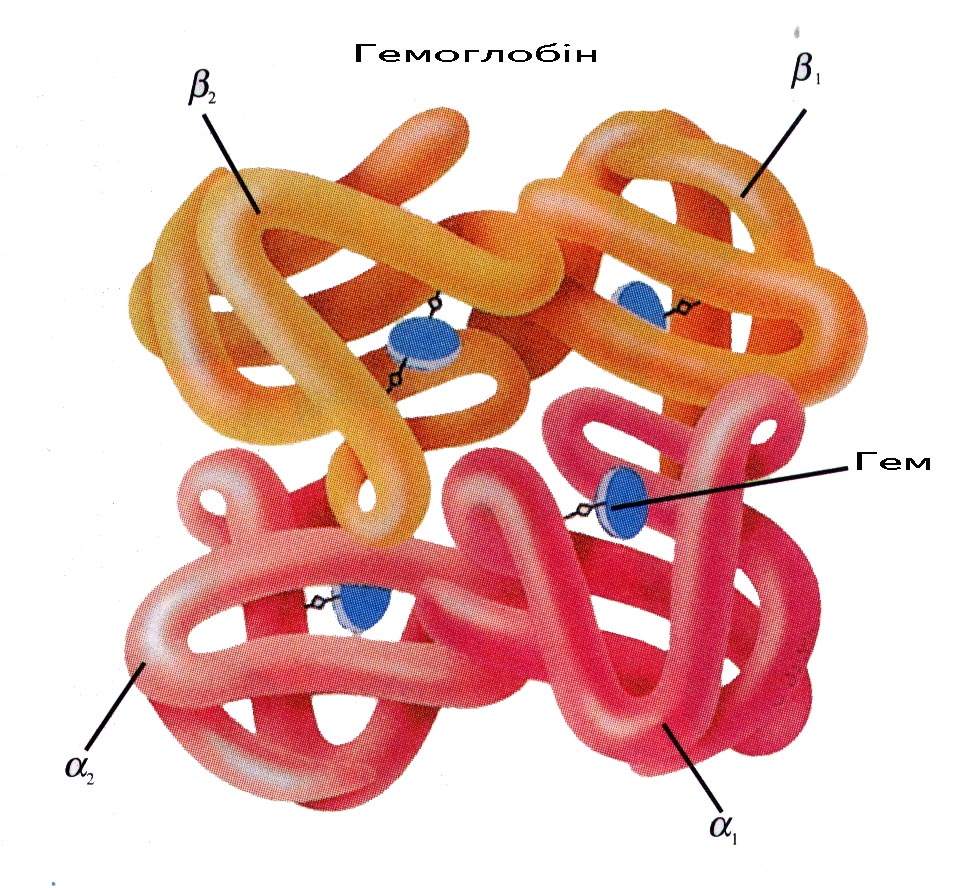
Гемоглобін відноситься до класу хромопротеїнів. Це білки, молекула яких складається з простого білка глобіну і забарвленої простетичної групи небілкового характеру – гема. Молекула гемоглобіну складається з чотирьох поліпептидних ланцюжків, до складу кожної входить особливий пігмент – гем. Простий білок глобін і гем знаходяться, відповідно, у співвідношенні 96 % і 4 % від маси молекули.
До складу молекули гемоглобіну входять чотири однакові групи гему. Гем є протопорфірином, у центрі якого розміщений іон двовалентного заліза. Ключову роль у діяльності гемоглобіну відіграє іон заліза, який розміщений у центрі молекули протопорфірину. Останній, сполучений з цим іоном двома координаційними зв’язками, які утворилися внаслідок заміщення водню, називається гемом.
Одна з валентностей заліза реалізується при зв’язуванні гему з глобіном, до другої приєднується кисень або інші ліганди – вода, вуглекислота, азиди. Білкова і простетична частина молекули не тільки зв’язані, але й постійно мають один на одного сильний вплив. Глобін змінює властивості гему, визначаючи його здатність до зв’язування кисню. У свою чергу, гем забезпечує стійкість глобіну до дії фізичних факторів, розщеплення ферментами тощо.
Білковий компонент гемоглобіну
Більша частина молекули гемоглобіну, яка складаєтьс приблизно з 10000 атомів припадає на долю білкового компоненту. Він складається з чотирьох окремих поліпептидних ланцюгів, до складу кожного з яких входить більше 140 амінокислотних залишків. Хімічний аналіз дозволив розкрити амінокислотну послідовність поліпептидних ланцюгів гемоглобіну. За останні роки за допомогою рентгеноструктурного аналізу було встановлено просторове розміщення цих ланцюгів.
Так, молекула гемоглобіну складається з двох симетричних “світлих ланцюгів”, які тісно переплетені з двома симетричними “темними” ланцюгами. Вся молекула має приблизно сферичну форму. Біля її поверхні в спеціальних “впадинах” розміщуються групи гему. Світлі субодиниці гемоглобіну дорослого (adult) – НвА, кожна з яких складається з 141 амінокислотного залишку, називається a-ланцюжками, а темні субодиниці (по 146 амінокислот) – b-ланцюжками. У гемоглобіну плода (fetus) людини (HbF) замість b-ланцюжків є два так званих g-ланцюжки, які відрізняються амінокислотною послідовністю. Після народження НвF замінюється на НвА.
Так, на 12 тижні внутрішньоутробного розвитку є 100 % НвF; на 20 тижні – 90 % НвF; у новонароджених – 60-85 % НвF; в 1-2 роки – 2,5 % НвF; у дорослих – НвF.